文章信息
- 刘鹏, 徐根娣.
- Liu Peng, Xu Gendi.
- 在生境片断化中光对七子花生理特性的影响
- EFFECT OF LIGHT IN SITE FRAGMENTATION ON PHYSIOLOGICAL CHARACTERISTICS OF HEPTACODIUM MICONIOIDES
- 林业科学, 2003, 39(4): 43-48.
- Scientia Silvae Sinicae, 2003, 39(4): 43-48.
-
文章历史
- 收稿日期:2001-08-20
-
作者相关文章
七子花(Heptacodium miconioides)是中国特有的珍稀濒危植物,属国家二级重点保护植物,先后被列为中国被子植物关键类群中高度濒危种类(陈灵芝,1993)和中国生物多样性保护行动中优先保护的物种(中国生物多样性保护行动计划总报告编写组,1994)。七子花分布范围非常狭小,仅间断分布于浙江的金华、天台、宁波、新昌、缙云、建德,安徽的泾县、宣城和湖北的兴山(现已灭绝)等少数几个地区,七子花群落仅在天台山(金则新,1998)和金华北山(刘鹏等,1997)有小片残留。七子花的分布较为独特,主要分布在海拔600~1 000 m水沟边或乱石中,生长土壤为微酸性,喜弱光但不耐强光,较耐寒但畏炎热,而七子花的各主要分布地(北山,天台山和四明山等),由于森林砍伐和破坏使其生境片断化,使其原有的生长环境产生新的变化,整个群落从外向内产生生态环境梯度,光照、温度、湿度等条件都发生了改变,从而有可能加重七子花的濒危状态。目前尚无生境片断化所引起的光照、温度、湿度等条件变化对七子花生理和生态影响的研究报道,本文从生理学角度探讨浙江北山生境片断化所引起的光照强度的变化对七子花的生理影响,以期为七子花的濒危机制的研究和生物多样性保护提供新的资料和理论依据。
1 材料与方法 1.1 取样研究样地设在位于浙江省金华市北郊的北山,地理坐标为北纬29°13′,东经119°38′,是七子花的主要自然分布地。北山的气候属中亚热带季风气候,温暖湿润,雨量充沛,年均降雨量为1 500~1 800 mm,年平均气温15.1℃,7月份均温26.4℃,1月份均温3.6℃,极端最高气温41.3℃,极端最低气温-9.5℃,≥10℃积温为5 504.5℃。七子花成片分布在北山南坡海拔600 m的水管附近,总面积约1 000 m2,水管左侧500 m2(群落Ⅰ)植被保存完好,林冠浑圆,林内湿润,荫蔽性好,成层现象明显,七子花生长良好(刘鹏等,1997)。水管右侧500 m2(群落Ⅱ)的七子花群落因在1992年该群落和周围植被遭受过大规模的砍伐,附近高大树木都已不存在,林内3 m以上的乔木稀少,光照强烈,湿度低,生境较为干旱。
分别沿群落Ⅰ和群落Ⅱ的E—W方向从林缘到林内中心点每隔一定距离设一样点,2个群落各设4个样点,共8个样点。于上午10:30测定各样点的光照强度、叶片的光合速率和气孔导度,并取样。光合速率和其它生理指标测定均取七子花的第3对叶片,除光照强度、气孔导度和光合速率在野外直接测定外,用于叶片特性测定的样品装入塑料袋,用于生理指标测定的样品放入冰壶。样点1~8所测定的光照强度分别为:180,350,520,590,630,720,870,1 040 μmol·m-2s-1,其中样点1、2、3、5为位于群落Ⅰ内的样方,样点4、6、7、8为位于群落Ⅱ内的样方。以样点1(群落Ⅰ林内中心点),光照强度最低,七子花的荫蔽度最高;样点8(群落Ⅱ的林缘),光照强度最高。
1.2 测定方法各样点的光照强度用照度计(德国GOSSEN公司生产)测定,以μmol·m-2s-1表示;光合速率和气孔导度分别用国产GXH-305型便携式红外分析仪和澳大利亚ADC公司生产的LCA-4光合系统测定;叶绿素测定采用张志良(1990)的方法;叶面积采用打孔法(张宪政,1994);电导率采用电导法(张宪政,1994),用DDS-IIA型电导仪测定浸出液和煮沸后浸出液电导率的相对比率;丙二醛(MDA)含量采用硫代巴比妥酸法(TBA)(林植芳等,1984);过氧化物酶(POD)活性(ΔA470·g-1FW min-1)采用愈创木酚法(Amako et al., 1994);过氧化氢酶(CAT)活性(U·g-1FW)采用曾韶西等(1991)的方法,以1 min变化0.01个OD值为一个活力单位;超氧化物歧化酶(SOD)活性(U·g-1FW)采用王爱国等(1983)的方法,以抑制氮蓝四唑(NBT)光氧化还原50%的酶量为1个活力单位;抗坏血酸过氧化物酶(AP)活性(U·g-1FW)采用Nakano和Asada(1981)的方法,以1 min催化1 μmol AsA氧化的酶量为一个活力单位。实验重复5次,文中各数值都为平均值。
2 结果与分析 2.1 光照强度变化对七子花叶片特性的影响从表 1可以看出,七子花表现出一定的耐荫植物性状,随着光照强度减弱,七子花的叶面积增加,单位叶面积的鲜重和含水量都减少。植物叶面积的增加有助于同化有机物质的增长和呼吸消耗的降低,也是多数耐荫植物对弱光环境适应的主要特性(采尼克尔,1986)。当生境片断化使七子花暴露在强光和高温(光强变化也会导致气温的改变)下,七子花叶面积减少,单位叶面积的鲜重和含水量明显增加,有利于七子花适应这种强光和高温生境,维持植物体内水份的供应,稳定同化作用。
|
|
从实验结果还可以看出,光照适度减弱,七子花叶片叶绿素的含量逐渐增加,叶绿素a/b值降低,提高叶绿素含量和降低叶绿素a/b值是耐荫植物从生理上对生境的适应(采尼克尔,1986;叶勇等,2001)。但光照太弱(低于350 μmol·m-2s-1)时,叶绿素含量也会有所减少,因为叶绿素在形成过程中需要光的参与。另一方面,随着光照的增强,七子花叶片的叶绿素含量逐渐减少,当光强为1 040 μmol·m-2s-1 时,七子花叶片的叶绿素含量较光照为520 μmol·m-2s-1时降低45.39 %,这是由于强光下,植物难以全部消耗过量的光能,这些过量的光能将产生光抑制,不利于植物叶绿素的形成,可能还会使叶绿素产生分解(徐志防等, 1999)。表 1还显示,七子花叶片的气孔导度与光强密切相关,在180~720 μmol·m-2s-1光照范围内,气孔导度随着光照的增强而增加,当光强超过720 μmol·m-2s-1时,七子花叶片的气孔导度反而降低,说明光强超过一定的程度七子花难以忍受,七子花减少叶片的气孔导度对降低蒸腾作用有利,但同时也不利于其光合作用的进行。
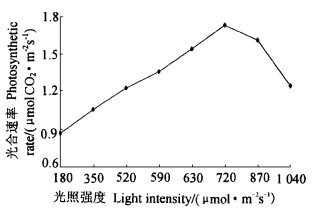
2.2 光照强度变化对七子花光合速率的影响从图 1可看出,生境片断化所引起的光照强度变化对七子花叶片的光合速率产生了较大的影响,光强在180~720 μmol·m-2s-1,光合速率随着光照强度的增加而不断提高,几乎呈直线上升,光强为180 μmol·m-2s-1时,七子花光合速率最低,当光强达720 μmol·m-2s-1时,七子花叶片的光合速率最高,较光强为180 μmol·m-2s-1的光合速率增加了98.85%。当光强超过720 μmol·m-2s-1时,七子花光合速率不再提高,反而有所下降,光强达到1 040 μmol·m-2s-1时,光合速率较光强为720 μmol·m-2 s-1的光合速率下降了27.7%,表明生境片断化使林缘的七子花暴露在强光下,对其光合速率产生了较大的抑制作用。虽然光强达到1 040 μmol·m-2s-1时,光合速率较光强为720 μmol·m-2s-1的光合速率明显下降,但仍大大高于光强为180 μmol·m-2s-1时的光合速率,说明尽管七子花不能适应强光,但光照过低也明显不利其光合作用。
|
图 1 在生境片断化中光对七子花光合速率的影响 Fig. 1 The effect of light in site fragmentation on photosynthesis of H. miconioides leaves |
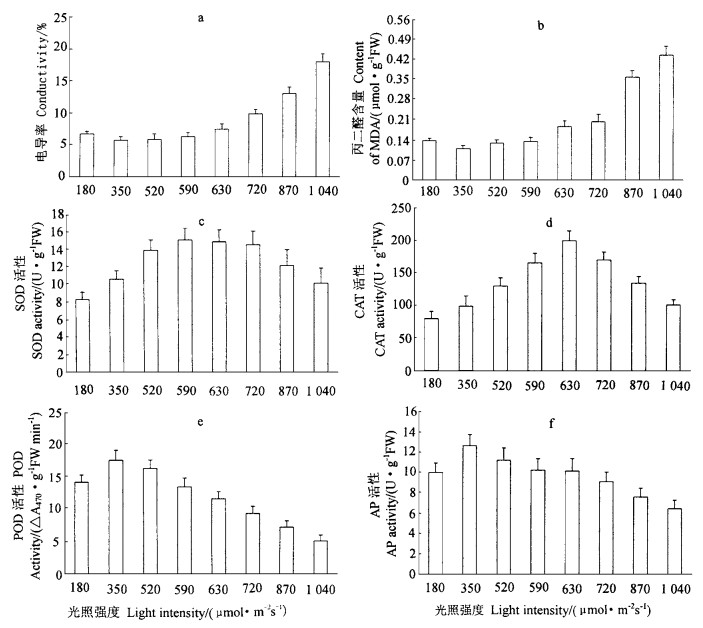
植物细胞的电导率(电解质外渗量)可反映逆境条件下植物细胞膜伤害或变性程度,丙二醛(MDA)可表现植物膜脂过氧化程度,在不同的外界条件下测定上述2项指标,其变化可以分析植物对外界环境条件的适应。从图 2-a, b可知,当光强较低(180~590 μmol·m-2s-1)时,七子花叶片的电导率和MDA含量都处于较低的水平,随着光照强度的增强,七子花叶片的电导率明显增加,MDA含量也大大上升,当光强达到1 040 μmol·m-2s-1时,七子花叶片电导率和MDA的含量都达到最大值。此外,相关性分析表明,七子花叶片的电导率和MDA含量二者呈显著的正相关(r=0.908**, n=40)。
|
图 2 在生境片断化中光对七子花叶片电导率和丙二醛含量及SOD、CAT、POD和AP活性的影响 Fig. 2 The effect of light in site fragmentation on conductivity, content of MDA, and activities of SOD, CAT, POD and AP of H. miconioides leaves |
SOD和CAT都是植物体内重要的保护酶,SOD主要将O2.-歧化为H2O2和O2,CAT与POD一起主要担负清除H2O2的功能。从图 2-c, d可知,生境片断化所引起的光照强度的变化对七子花叶片SOD和CAT活性产生较大的影响,光照过低或过高,二者的活性都有一定的下降,尤其当光强为180 μmol·m-2s-1时,二者活性都处于最低水平。在最大值之前,2种酶的活性都随着光照强度增加逐渐增强。当光强增加至520~720 μmol·m-2s-1时,SOD活性增至最大值范围,超过该光照强度范围后,SOD活性有所下降,而当光强达到1 040 μmol·m-2s-1时,SOD活性有较大的下降(较最大值降低33.1%),而CAT活性的最高值出现在光强为630 μmol·m-2s-1时,超过该光照强度后,CAT活性迅速下降,光强为1 040 μmol·m-2s-1时,CAT活性较最大值下降了49.27%。从图 2-c, d还可看出,即使在强光下(1 040 μmol·m-2s-1),POD和CA T活性分别较180 μmol·m-2s-1时的活性增加了16.4%和26.9%,2种酶的活性仍高于弱光下(180 μmol·m-2s-1)的活性,说明光照过弱同样不利于七子花保护酶类及对逆境的抵御。
POD和AP在植物体内都可清除过氧化所产生的H2O2,虽然2种酶催化还原H2O2的电子供体不相同,AP的电子供体为抗坏血酸,POD的电子供体为酚类、胺类、杂环化合物或一些无机离子,但七子花在不同光照条件下二者的变化趋势非常一致,呈显著正相关(r =0.925**,n=40)。当光强为350 μmol· m-2s-1时,二者活性最高,当七子花处于强光下(1 040 μmol·m-2s-1)时,二者活性最低,POD和AP活性分别较最高值降低了70.7%和48.8%。由此可见,生境片断化导致七子花暴露在强光下,抑制了七子花POD和AP等保护酶的活性,将非常不利于七子花体内保护系统对活性氧的清除和对逆境的抵御。
3 讨论七子花是濒临灭绝的珍稀濒危植物,其濒危机制的研究对于七子花的生物多样性的保护具有非常重要的意义。从近几年的调查研究来看,七子花各分布地的生态环境不断恶化,乱砍滥伐导致七子花生境片断化,使七子花种群不断变小,植株数量急剧减少,且分布区由连续性向间断性过度,七子花的濒危状态进一步加剧,七子花模式标本产地湖北兴山的七子花已灭绝就是一例。生境片断化产生边缘(Raijman, 1994),边缘的产生将使植物的光照强度大大增强,光饱和点和相对湿度降低(Brown, 1993),地表及土壤表层的温度日较差变大(Sunder et al., 1991),透入林内光的成分发生变化,对喜凉爽、不耐强光、畏炎热的七子花产生生理和生态上的胁迫。本研究结果表明,七子花生境片断化所导致的光照强度的增加对七子花在生理上产生了非常大的影响,虽然光照增强,七子花的光合速率有所增加,七子花通过叶片单位面积的含水量和鲜重及气孔导度上升来适应这种变化,但叶片叶绿素含量减少,电导率显著增加,MDA产量大大提高,体内的保护酶类的活性明显降低,将对七子花的生长产生较大的胁迫。连续5 a未发现群落Ⅱ内的七子花有种子产生(另文待发表),可能与这种胁迫有关。另一方面,光照过弱(尤其光照强度为180 μmol·m-2s -1时),气孔导度、光合速率、SOD和CAT等保护酶活性都处于最低水平,说明耐荫性的植物也并不是光照强度越低越好,也须要一定的光照强度满足其生理上的基本需要。
不少研究(刘鹏等,2000;林植芳等,1999;阎成士等,1999)都认为,植物在逆境胁迫下,植物体内活性氧的产生与清除之间的平衡被破坏,活性氧量大大增加,植物膜系统将成为活性氧首先进攻的重要靶点,活性氧导致植物叶片膜的损伤,电解质外渗加剧,进而引起其它生理生化的异常,且随着胁迫时间的推移,植物膜脂过氧化增强,膜脂过氧化的产物增加,对植物产生的伤害更加严重。在本实验所测定的各项指标中,电导率和MDA对光照强度的变化最为敏感,当光强达1 040 μmol·m-2s-1时,电导率和MDA的含量较最低值(光强为350 μmol·m-2s-1)分别增加了210%和298%(见图 2-a,b),其变化幅度超过了其它指标的变化幅度,因而认为强光对七子花叶片影响的本质是强光导致了叶片膜系统的损伤,使电解质外渗量和MDA含量增加,进而引起其它生理特性的变化。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(AP)等保护酶是植物体内酶促防御系统中重要的酶,这4种酶在有效地清除活性氧和自由基过程中相互协助,共同维护植物体内膜系统的稳定。从本实验结果来看,SOD和CAT、POD和AP分别呈显著正相关,但SOD与POD和AP的相关性系数分别为-0.039 (n=40)和0. 083 4(n=40),CAT与POD和AP的相关性系数分别为-0.147 (n=40)和0.097 8(n=40),而另外有实验显示(刘鹏等,2000),钼、硼处理后,大豆叶片中的上述4种酶在抵御钼、硼逆境过程中彼此间都呈正相关。出现上述差异可能由于CAT是光失活酶,其酶活性的维持依赖于光下连续合成CAT蛋白(阎成士等, 1999),另一方面,光照也可促进SOD蛋白质的合成,提高SOD的活性(郭振飞等,1997),因而光照对CAT和SOD活性的重要性明显大于POD和AP,因而CAT和SO D在180 μmol·m-2s-1时酶的活性最低,甚至低于强光(1 040 μmol·m-2s-1)下酶的活性。
综述本实验结果,七子花属于中等耐荫性植物,较为适宜生长在光照强度为350~650 μmol·m-2s-1的环境条件,生境片断化所引起的强光(大于800 μmol·m-2s-1)非常不利于七子花的生长发育,当然光照过弱也会对七子花的生长产生不利的影响,因此在进行七子花生物多样性保护,尤其进行迁地保护时,应优先考虑适宜的光照条件。
采尼克尔.木本植物耐阴性的生理学原理.王世绩译.北京: 科学出版社, 1986
|
陈灵芝(主编).中国的生物多样性—现状及其保护对策.北京: 科学出版社, 1993
|
郭振飞, 樊剑鸣, 卢少云, 等. 1997. 光照对玉米幼苗超氧化物歧化酶活性的影响. 植物生理学报, 23(3): 279-282. |
金则新. 1998. 浙江天台山七子花群落研究. 生态学报, 18(2): 127-131. DOI:10.3321/j.issn:1000-0933.1998.02.003 |
林植芳, 李双顺, 林桂珠, 等. 1984. 水稻叶片的衰老与超氧化物歧化酶活性及脂质过氧化作用的关系. 植物学报, 26(6): 605-615. |
林植芳, 彭长连, 林桂珠. 1999. 光氧化作用引起几种亚热带木本植物膜损伤和PS II失活. 植物学报, 41(8): 871-876. DOI:10.3321/j.issn:1672-9072.1999.08.017 |
刘鹏, 郭水良, 赵铁桥, 等. 1997. 浙江北山七子花群落及生物多样性保护. 华东森林经理, (2): 16-19. |
刘鹏, 杨玉爱. 2000. 钼、硼对大豆叶片膜脂过氧化及体内保护系统的影响. 植物学报, 42(5): 461-466. DOI:10.3321/j.issn:1672-9072.2000.05.004 |
王爱国, 罗广华, 邵从本, 等. 1983. 大豆种子超氧化物歧化酶的研究. 植物学报, 25(1): 77-84. DOI:10.3321/j.issn:1000-4025.1983.01.010 |
徐志防, 罗广华, 王爱国, 等. 1999. 强光及活性氧对大豆光合作用的影响. 植物学报, 41(8): 862-866. DOI:10.3321/j.issn:1672-9072.1999.08.015 |
阎成士, 李德成, 张建华. 1999. 植物叶片衰老与氧化胁迫. 植物学通报, 16(4): 398-404. DOI:10.3969/j.issn.1674-3466.1999.04.012 |
叶勇, 谭凤仪. 2001. 土壤结构与光照水平对秋茄某些生长和生理参数的影响. 植物生态学报, 25(1): 42-49. DOI:10.3321/j.issn:1005-264X.2001.01.008 |
曾韶西, 王以柔, 刘鸿先. 1991. 低温光照下与黄瓜子叶叶绿素降低有关的酶促反应. 植物生理学报, 17(2): 177-182. DOI:10.3321/j.issn:1671-3877.1991.02.005 |
张志良. 1990. 植物生理学实验指导. 第二版. 北京: 高等教育出版社, 133-135.
|
张宪政. 1994. 作物生理研究法. 北京: 农业出版社.
|
中国生物多样性保护行动计划总报告编写组. 1994. 中国生物多样性保护行动计划. 北京: 中国环境科学出版社.
|
Amako K, Chen G X, Asade K. 1994. Separate assays specific for ascorbate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase in plants. Plant Cell Physiol, 35: 497-504. |
Browm N. 1993. The implications of climate and gap microclimate for seedling growth conditions in Bornean lowland rain forest. J Trop Ecol, 9: 153-168. DOI:10.1017/S0266467400007136 |
Nakano Y, Asada K. 1981. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant Cell Physiol, 22: 867-880. |
Raijmann L E L. 1994. Genetic variation and outcrossing rate in relation to population size in Gentiana pneumonanthe L.. Conserv Biol, 8: 1014-1026. DOI:10.1046/j.1523-1739.1994.08041014.x |
Sunder D A, Hobbs R J, Margules C R. 1991. Biological consequences of ecosystem fragmentation: A review. Conserv Biol, 5: 18-32. DOI:10.1111/j.1523-1739.1991.tb00384.x |
 2003, Vol. 39
2003, Vol. 39