文章信息
- 王文卿, 林鹏.
- Wang Wenqing, Lin Peng.
- 红树植物体内元素分布特点与抗盐机理
- ELEMENT DISTRIBUTION IN MANGROVES AND SALT-TOLERANT MECHANISM
- 林业科学, 2003, 39(4): 30-36.
- Scientia Silvae Sinicae, 2003, 39(4): 30-36.
-
文章历史
- 收稿日期:2001-06-19
-
作者相关文章
红树林适应于高盐生境,在生理生化及形态方面形成了一系列适应机制。长期以来一直认为红树植物可分为2类,具盐腺的泌盐红树植物(secreters)和不具盐腺的拒盐红树植物(exclu ders)(Scholander, 1968)。老鼠NFDA4属(Acanthus)、桐花树属(Aegiceras)及白骨壤属(Avicennia)植物的叶片均具盐腺,通过盐腺分泌Na、Cl使叶片得以保持盐分平衡(Tomlinson, 1986);而红树属(Rhizophora)、秋茄属(Kandelia)和木榄属(Bruguiera)植物主要是通过木质部的高负压,从含盐基质中分离出淡水,所以称之为拒盐红树植物(林鹏,1984)。多年来,许多学者从光合(Ball et al., 1984)、呼吸(Burchett et al., 1984)、生长(Downton, 1982; Clarke et al., 1970; Burchett et al., 1984; 林鹏,1993;王文卿等,1999)、盐分平衡(Atkinson et al., 1967; Field, 1984; Waisel et al., 1986)、渗透调节(Downton, 1982; 赵可夫等,1999)、叶片发育及衰老过程中盐分动态(Wang et al., 1999)等角度对红树植物的抗盐生理生态进行了研究。从盐分的吸收、转移和分配角度研究红树植物的抗盐生理生态的报道不多,且集中于泌盐红树植物白骨壤属的植物,对拒盐红树植物和泌盐红树植物的比较研究很少(Atkinson et al., 1967; Mallery et al., 1984)。研究植物的抗盐性必须跟踪盐分的吸收、运输和分配,盐生植物体内盐分浓度的调节是植物生存的关键(Omer et al., 1983)。
本研究以拒盐红树植物秋茄(Kandelia candel)、海莲(Bruguiera sexangula)和红海榄(Rhizophora stylosa)及泌盐红树植物桐花树(Aegiceras corniculatum)和白骨壤(Avicennia marina)为对象,对植物体各器官元素含量进行比较研究,同时与陆生非盐生植物武夷山的甜槠(Castanopsis eyrei)进行比较,以更好地了解红树植物的抗盐机制。
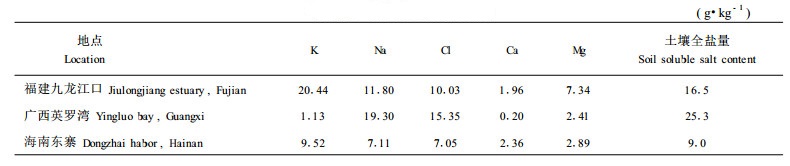
1 材料与方法研究地点位于福建九龙江口的龙海市浮宫镇草埔头村(24°24′N,117°55′E)秋茄林、海南东寨港国家级红树林保护区河港村(19°30′N,110°14′E)的海莲林和广西合浦县英罗湾山口国家级红树林保护区(21°28′N,109°43′E)的红海榄林。样地详细情况见林鹏(1990;1993)的报道。样地土壤元素含量(全量)见表 1。在样地内选择标准木3棵,分别采集叶片、幼枝、多年生枝、树干材、树干皮和地下根(分成直径>2.0 cm、直径0.5~2.0 cm和直径 < 0.5 cm 3个等级),其中叶片和幼枝取自树冠外围,样品清洗干净后105℃杀青10 min,80℃烘干、磨粉,贮于磨口试剂瓶备用。采集植物样品的同时采集20~30 cm层土壤样品,风干磨碎过100目筛备用。在采集九龙江口秋茄样品的同时,收集林内桐花树和白骨壤植物样品,采样方法同上。此外,为研究红海榄根系的盐分分布情况,将红海榄的根细分为4级,Ⅰ:d < 2 mm,Ⅱ:d 2~5 mm,Ⅲ:d 5~15 mm,Ⅳ:d>15 mm。测定不同径级根的Na、Cl含量。以上样品的采样均在1月至4月间进行。植物Cl用AgNO3滴定法测定,样品经HNO3-HClO4消化后,K、Na、Ca、Mg含量用原子吸收分光光度法测定(波钦诺克,1981;中国科学院南京土壤研究所,1978)。土壤和植物元素含量均以干样质量计,单位为g·kg-1。
|
|
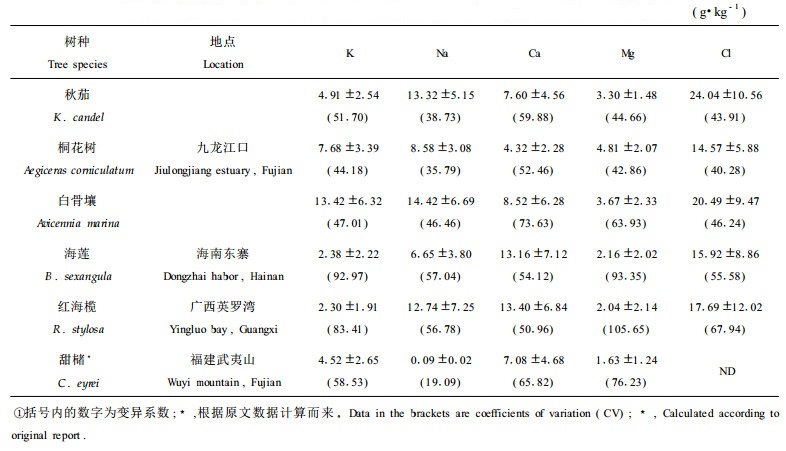
植物体各器官元素含量见表 2,其统计结果见表 3。从表 2可看出,秋茄和桐花树各器官元素含量大小顺序基本相同。除树皮和根外,秋茄各器官元素含量顺序为Cl>Na>Ca>K>M g;除树干和树皮外,桐花树各器官元素含量顺序为Cl>Na>K>Mg>Ca;白骨壤叶、幼枝、树干和根的元素含量顺序为Cl>Na>K>Ca>Mg, 多年生枝为K>Cl>Na>Ca>Mg, 树皮为Cl>K>Ca>Na>Mg。海莲和红海榄各器官元素含量顺序差别较明显,海莲叶片、多年生枝和树干材的元素含量顺序为Cl>Ca>Na>K>Mg,幼枝和树皮的元素含量顺序为Ca>Cl>Na>K>Mg,根的顺序为Cl>Na>Ca>M g>K;红海榄叶片和根的元素含量顺序为Cl>Na>Ca>Mg>K,幼枝和多年生枝为Ca>Cl>Na>K>Mg,树干材和树皮为Ca>Cl>Na>K, Mg。总之,5种红树植物各器官都具有高Cl、Na元素含量的特点。泌盐的桐花树和白骨壤各器官具高Cl、Na和低Mg、Ca的特点,而非泌盐的秋茄、海莲和红海榄各器官的Cl、Na和Ca含量较高,Mg和K的含量较低。以上结果与一般的植物不同。
|
|
|
|
从表 2还可以看出:K在叶片、幼枝及树皮中含量较高,树干材最低;Cl、Na在叶片、幼枝及根中含量较高,树干材最低;Mg在叶片、根及幼枝中含量较高(白骨壤植物体各器官中Mg含量最高的是树皮),树干材最低;Ca与其他元素不同,在皮、叶片及幼枝中含量较高,而在树干材及根中含量最低。
从表 3可看出,除桐花树的Ca含量较低外,5种红树植物的Na、Ca、Mg含量均高于陆生植物,尤其是Na含量差别较大,如白骨壤的Na含量比武夷山的甜槠高156倍。因为目前没有相关树种各器官Cl含量的资料,无法对Cl进行比较。红树植物和陆生植物K含量差别不大,九龙江口的秋茄、桐花树和白骨壤K含量较高,武夷山的甜槠次之,海南的海莲和广西的红海榄K含量最低。从表 3还可看出,同一元素在同种植物不同器官之间含量差别较大,变异系数均超过35%,海莲和红海榄则超过50%。这说明红树植物体内存在一有效的养分重新分配机制。陆生植物K、Ca和Mg的变异系数也很高,均在60%以上,但值得注意的是,甜槠不同器官间Na含量的差别很小,变异系数分别为19.1%和29.8%。这说明相对于红树植物来说,Na在陆生植物体内的分布是比较均匀的,陆生植物体内养分重新分配机制对Na作用不大。
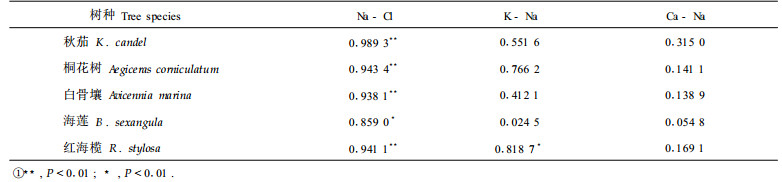
2.2 元素之间的关系考察了同一植物体不同器官元素含量之间的关系。秋茄、桐花树、白骨壤、海莲和红海榄植物体各器官的Na和Cl之间均存在显著的正相关关系,除海莲外,相关关系均达极显著水平(表 4)。秋茄、桐花树、白骨壤、海莲和红海榄各器官K和Na含量之间正相关,但除红海榄外,相关关系达不到显著水平,若不考虑根,则秋茄各器官K和Na含量之间显著正相关。所有红树植物各器官Ca与Na之间的相关关系均不显著。
|
|
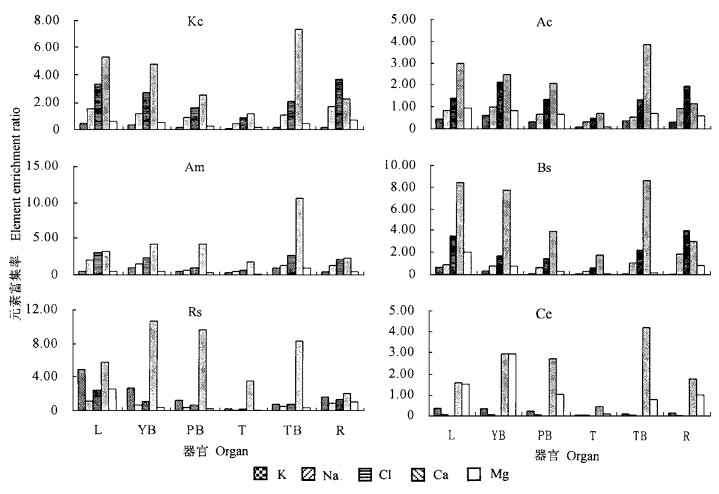
除个别器官外,秋茄、桐花树、白骨壤和海莲各器官对土壤元素的富集系数的大小顺序为Ca >Cl>Na>Mg, K,红海榄为Ca>K>Cl>Mg>Na。所有红树植物对土壤Ca的富集能力均高于其他元素,且富集率均大于1。相对而言,树皮对土壤Ca的富集能力高于其他器官(红海榄除外),如白骨壤树皮对土壤Ca的富集能力高达10.67。值得注意的是,秋茄、桐花树、白骨壤和海莲各器官对土壤K的富集能力均小于1,且对土壤K的富集能力低于Ca、Cl、Na和Mg。红海榄与其他红树植物不同,除树干材和树皮外,叶片、幼枝、多年生枝条和根对土壤K的富集率均大于1(图 1)。由此可见,红海榄和其他4种红树植物在元素积累及分配上存在较大的差别。从图 1还可看出,除个别器官外,秋茄、桐花树、白骨壤、海莲和红海榄植物体所有器官的Na、Cl含量均高于土壤,表现为元素富集率大于1;而甜槠各器官对土壤Na的富集率均小于0.1。所有红树植物各器官对土壤Cl的富集率均小于Na。
|
图 1 红树植物及甜槠各器官对土壤元素的富集率 Fig. 1 Element enrichment coefficients of various organs of mangrove species and C. eyrei to soils Kc: 秋茄K. candel;Ac: 桐花树Aegiceras corniculatum;Am: 白骨壤Avicennia marina;Bs: 海莲B. sexangula;Rs: 红海榄 R. stylosa;Ce: 甜槠C. eyrei.下同。the same below. L: 叶Leaf; YB: 幼枝Young branch; PB: 多年生枝Perennial branch; T: 树干材Trunk; TB: 树皮Trunk bark; R: 根Root. |
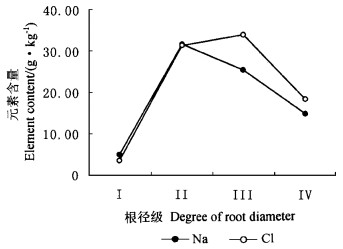
不同径级红海榄根的Na、Cl含量差别很大。从图 2可看出,随着根直径的增加,Na、Cl先是升高,然后下降。Ⅰ级根Na含量只有Ⅱ级根的15.4%,Cl含量也只有Ⅱ级根的9.8%。Na和Cl含量分别是Ⅱ级、Ⅲ级根最高(图 2)。
|
图 2 不同径级红海榄根Na、Cl含量 Fig. 2 Content of Na and Cl in various degree roots of R. stylosa |
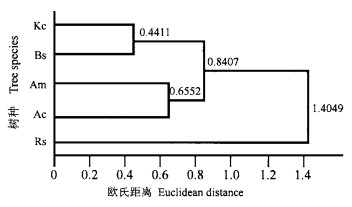
近年来,聚类分析方法被大量应用于系统分类学和群落调查(阳含熙等,1981),但利用聚类分析方法研究植物抗性的报道不多。任文伟等(1997)利用聚类分析方法对不同种源羊草( Leymus chinensis)的抗旱性进行了研究。考虑到本文所研究的5种红树植物来源于3个地点,因此没有利用各器官元素含量而是利用各器官对土壤元素的富集率和K/Na比进行聚类,采用欧氏距离的最短距离系数作为分类依据,详细方法见文献(阳含熙等,1981)。结果见图 3。可把5种红树植物分成3类,秋茄和海莲为一类,白骨壤和桐花树为一类,红海榄单独一类。
|
图 3 5种红树植物聚类图 Fig. 3 Agglomerative classification of five mangrove species |
红树植物Na、Cl含量高是与其盐渍生境相适应。盐生植物在蛋白质合成过程中,需较高浓度的Mg才可使合成酶达到最大活性(王宝山等,1997)。这可能是红树植物体内Mg含量高的原因。一般来说,植物对K的吸收是一个主动的生理过程,K在阳离子的吸收上有较强的竞争力(Flowers,1983),绝大多数红树植物中存在一非常有效的吸收K的机制(Field,1984)。这与本实验的结果不符。秋茄、桐花树、白骨壤和海莲各器官对土壤K的富集能力均小于1,且对土壤K的富集能力低于Ca、Cl、Na和Mg (图 1)。可能的原因是Na/K拮抗,高浓度的Na抵制了K的吸收。但是,对各器官K、Na关系的研究表明,秋茄、桐花树、白骨壤和海莲K、Na之间并不存在负相关关系(表 4),若不考虑根,秋茄各器官K与Na含量之间显著正相关(r =0.9464,P < 0.05)。红海榄各器官K与Na含量之间也显著正相关(r=0.8187,P < 0.05)。由此可见,K与Na在红树植物体内不是拮抗而是协同,这与一般的植物不同。可能的原因是Na可以部分代替K的功能(Flowers, 1983)。而红海榄除树干材和多年生枝外,各器官对土壤K富集率均大于1,这与其他红树植物不同。
在进行植物体对盐分的吸收、转移及分配机制的研究中,多数研究集中于Na,而对Cl没有引起足够的重视(王宝山等,1997;马斯纳,1991;Yeo et al., 1986)。本研究发现,无论是拒盐红树植物还是泌盐红树植物,植物体各器官Na与Cl含量之间均存在显著的正线性相关关系(表 4)。对拒盐红树植物秋茄叶片发育及衰老过程的跟踪研究也发现Na和Cl的行为相同(Wang et al., 1999)。这说明Na和Cl进入植物体后,以几乎相同的比例分配于各器官。由此可见,植物体内盐分吸收、转移及分配机制不仅对Na起作用,对Cl也起作用。至于是何种机制决定Cl在植物体内的重新分配,目前尚无相关报道。可能是Cl作为Na的主要反离子而伴随着Na进行重新分配的。
除个别器官外,秋茄、桐花树、白骨壤、海莲和红海榄植物体所有器官的Na、Cl含量均高于土壤,表现为元素富集率大于1,远高于陆生植物甜槠(图 1)。因此,从某种意义上讲,秋茄、桐花树、白骨壤、海莲和红海榄均为聚盐型植物(吸盐型植物),而甜槠为拒盐型植物。对秋茄和白骨壤渗透调节物质的研究(赵可夫等,1999)也证实了这种观点。研究发现,九龙江口秋茄和白骨壤Na、Cl、K、Ca和Mg等无机离子对渗透调节的贡献率约占88%,其中起主要作用的是Na和Cl (赵可夫等,1999)。拒盐红树植物如榄李属(Lumnitzera)、红树属及海桑属(Sonneratia)等属的木质部液流中的含盐量比典型的非盐生植物高10~50倍(Scholander, 1968)。以上事实说明,秋茄、桐花树、白骨壤、海莲和红海榄主要是通过积累盐分来抵御渗透胁迫的,这种积累是否为主动过程尚需进一步研究。
但是,这些红树植物的根系在减少盐分的过多吸收方面也起了很大作用。除白骨壤外,所有红树植物的根的元素含量在所有器官中均是比较高的,秋茄和海莲根的Na、Cl含量均高于其他器官,桐花树根的Na、Cl含量仅次于幼枝,红海榄根的Na、Cl含量仅次于叶片(表 2)。尽管泌盐红树植物白骨壤木质部液流中的盐分含量相对较高,达基质盐浓度的1/10,根系对盐分的进入也具有一定的排斥作用(Tomlinson, 1986)。Waisel等(1986)的研究表明,根系对盐分的排斥作用是泌盐红树植物白骨壤最重要的排盐机制之一,进入根系的盐分有80%被滞留于根系中,叶片盐腺泌盐只能排除进入叶片的盐分的40%或进入根系的盐分的8%;而Burchett等(1984)和Scholander(1968)的研究表明白骨壤的根系滞留盐分效率分别达90%和95%。拒盐红树植物如榄李属、红树属及海桑属等属的木质部液流中的含盐量还不到基质的1%(Scholander, 1968)。红海榄不同级别根中Na、Cl分布情况(图 2)也可证明,红海榄根系存在一拒盐机制。首先I级细根的Na、Cl含量均低于土壤,这是根内皮层作用的结果,进入Ⅰ级根的盐分马上被Ⅱ、Ⅲ级根滞留,其结果是Ⅱ、Ⅲ级根盐分含量很高,甚至超过叶片,Ⅳ级根的盐分含量已下降了很多。红树植物根系拒盐主要是通过根系内皮层中发达的凯氏带起作用的(林鹏,1984)。由此可见,就根系功能来说,拒盐红树植物和泌盐红树植物在排盐效率上有所差别,前者比后者高10倍左右, 但根系拒盐是所有红树植物最重要的排盐机制。在满足细胞渗透调节的前提下,保持地上部分较低的盐分浓度是所有红树植物的共同特点。
聚类分析结果表明,5种红树植物可分为3类,秋茄和海莲为一类,桐花树和白骨壤为一类,红海榄单独一类(图 3)。没有象预期的那样将拒盐红树植物和泌盐红树植物分开,红海榄与秋茄和海莲的距离要比其与桐花树和白骨壤的距离远。除盐腺泌盐和木质部液流中有较高的盐分含量外,其他方面拒盐红树植物和泌盐红树植物也不存在明显的差别。所以,我们认为将红树植物分成拒盐红树植物和泌盐红树植物从形态解剖角度来讲有其合理的成分,但从生理角度来讲值得进一步探讨。
波钦诺克X H.植物生物化学分析方法.荆家海, 丁钟荣译.北京: 科学出版社, 1981: 29-31
|
林鹏. 1984. 红树林. 北京: 海洋出版社.
|
林鹏. 1993. 红树林研究论文集第二集(1990—1992). 厦门: 厦门大学出版社, 1-52.
|
林鹏. 1990. 红树林研究论文集第一集(1980—1989). 厦门: 厦门大学出版社, 100-142.
|
林益民, 杨志伟, 李振基. 1994. 武夷山常绿林研究. 厦门: 厦门大学出版社, 50-58.
|
马斯纳H.高等植物的矿质营养.赵一平, 陆景陵等译.北京: 北京农业大学出版社, 1991: 42-104
|
任文伟, 罗岫泉, 郑师章. 1997. 不同种源羊草的SOD、POD的活性及丙二醛含量的比较. 植物生态学报, 21(1): 77-82. DOI:10.3321/j.issn:1005-264X.1997.01.011 |
王宝山, 赵可夫, 邹琦. 1997. 作物耐盐机理研究进展及提高作物抗盐性的对策. 植物学通报, 14(增刊): 25-30. |
王文卿, 林鹏. 1999. 盐度对红树植物木榄生长的影响. 厦门大学学报(自然科学版), 38(2): 273-279. DOI:10.3321/j.issn:0438-0479.1999.02.022 |
阳含熙, 卢泽愚. 1981. 植物生态学的数量分类方法. 北京: 科学出版社.
|
赵可夫, 冯立田, 卢元芳, 等. 1999. 九龙江口秋茄和白骨壤的渗透调节剂及其贡献. 海洋与湖沼, 30(1): 58-61. DOI:10.3321/j.issn:0029-814X.1999.01.010 |
中国科学院南京土壤研究所. 1978. 土壤理化分析. 上海: 上海科学技术出版社, 211-212.
|
Atkinson M R, Findlay G P, Hope A B, et al. 1967. Salt regulation in the mangroves Rhizophora mucronata Lam and Aegialitis annulata R. Australian Journal of Biological Science, 20: 589-599. DOI:10.1071/BI9670589 |
Ball M C, Farquhar G D. 1984. Photosynthetic and stomatal responses of mangrove species, Aegiceras corniculatum and Avicennia marina, to long-term salinity and humidity conditions. Plant Physiology, 74: 1-6. DOI:10.1104/pp.74.1.1 |
Burchett M D, Field C D, Pulkownik A. 1984. Salinity, growth and root respiration in the gray mangrove, Avicennia marina. Physiologia Plantarum, 60: 113-118. DOI:10.1111/j.1399-3054.1984.tb04549.x |
Clarke L D, Hannon N J. 1970. The mangrove swamp and salt marsh communities of the Sydney district Ⅲ. Plant growth in relation to salinity and waterlogging. Journal of ecology, 58: 351-369. |
Downton W J S. 1982. Growth and osmotic relations of the mangrove Avicennia marina as influenced by salinity. Australian Journal of Plant Physiology, 9: 519-528. |
Epstein E, Rains D W. 1987. Advances in salt tolerance. Plant and Soil, 99: 17-29. DOI:10.1007/BF02370150 |
Field C D. Ions in mangroves. In: Teas H J (eds). Physiology and management of mangroves. Dr W. Junk Publishers, The Hauge, 1984: 43-48
|
Flowers T J. Sodium versus potassium, substitution and compartmentation. In: Lauch et al eds. Inorganic Plant Nutrition. Encyclopedia of Plant Physiology, New Series, 1983, 15B: 651-681
|
Joshi G V, Jamale B B, Bhosale L J. Ion regulation in mangroves. In: Walsh G et al eds. Proceedings of International Symposium on Biology and Management of Mangroves. University of Florida, 1975: 597-607
|
Mallery C H, Teas HJ. 1984. The mineral ion relations of mangroves I. Root cell compartments in a salt excluder and a salt secreter species at low salinity. Plant & Cell Physiology, 25(7): 1123-1131. |
Omer L S, Horvath S M, Setaro F. 1983. Salt regulation and leaf senescence in aging leaves of Jaumea carnosa (Less.) gray (Asteraceae), a salt mash species exposed NaCl stress. American Journal of Botany, 70(3): 363-368. DOI:10.1002/j.1537-2197.1983.tb06403.x |
Scholander P F. 1968. How mangroves desalinate seawater. Physiologia Plantarum, 21: 258-268. |
Tomlinson P B. 1986. The Botany of Mangroves. Cambridge: Cambridge University Press, 127-129.
|
Waisel Y, Eshel A, Agami M. 1986. Salt balance of leaves of the mangrove Avicennia marina. Physiologia Plantarum, 67: 67-72. DOI:10.1111/j.1399-3054.1986.tb01264.x |
Wang W Q, Li nP. 1999. Retranslocation of salt and nutrients in Bruguiera gymnorrhiza leaves during development and senescence. Mangroves and Salt Marshes, 3: 1-7. DOI:10.1023/A:1009937628112 |
 2003, Vol. 39
2003, Vol. 39