文章信息
- 王敏杰, 韩玉珍, 刘卫平, 赵德刚, 傅永福.
- Wang Minjie, Han Yuzhen, Liu Weiping, Zhao Degang, Fu Yongfu.
- 杜仲橡胶颗粒结合蛋白的分离、纯化及抗体制备
- ISOLATION, PURIFICATION AND ANTIBODY RAISING OF RUBBER PARTICLE BINDING PROTEINS FROM EUCOMMIA ULMOIDES
- 林业科学, 2003, 39(4): 23-29.
- Scientia Silvae Sinicae, 2003, 39(4): 23-29.
-
文章历史
- 收稿日期:2001-10-10
-
作者相关文章
2. 贵州大学农业生物工程重点实验室 贵阳 550025
2. Agricultural Bioengineering Key Laboratory, Guizhou University Guiyang 550025
杜仲(Eucommia ulmoides)是我国传统的药用植物,也是最具开发前景的温带胶源植物。与巴西橡胶树(Hevea brasiliensis),银胶菊(Parthenium aryentatuim)等积累的顺式-聚-1, 4-异戊二烯天然橡胶不同,杜仲胶积累的是反式-聚-1, 4-异戊二烯,是天然橡胶的同分异构体。由于结构上的高度有序性,以往杜仲胶只能作为硬橡胶使用,而严瑞芳(1992)发明杜仲胶的硫化工艺后,极大地拓宽了杜仲胶的应用价值。
在大部分含胶植物中,如巴西橡胶树,主要在树皮韧皮部的具网络结构的乳汁管中合成橡胶,切割后可分泌出胶乳,胶乳中含有大量包裹有几个到上千个橡胶分子的橡胶颗粒(Dickinson, 1969)。银胶菊胶粒在树皮组织普通的薄壁细胞中积累(Cornish et al., 1990)。橡胶颗粒是一类不连续的亚细胞结构,橡胶分子形成疏水核心,外面由脂类和蛋白质组成的“半单位膜”包裹(Siler et al., 1997)。杜仲胶以橡胶颗粒的形式积累在含胶细胞中。杜仲的根、茎、叶、花、果实的韧皮部薄壁细胞中分布着特化的含胶细胞(卢敏等, 1990; 田兰馨等, 1990)。
对于巴西橡胶树、银胶菊等植物积累的天然橡胶的生物合成机制已有不少的研究(Archer et al., 1963; Madhavan et al., 1989; Benedict, 1991; Cornish et al., 1995; Tanaka et al., 1995; Tangpakdee et al., 1996; 1997a; 1997b),而对于杜仲等植物的反式聚异戊二烯橡胶的生物合成机理的研究尚寥寥无几(田兰馨等,1990;Tangpakdee et al., 1997a; 1997b)。在银胶菊橡胶颗粒结合的蛋白中含量最高的蛋白具有催化异戊二烯聚合的橡胶转移酶活性(Cornish et al., 1990; Benedict, 1991;Cornish,1993),而巴西橡胶树橡胶颗粒结合的蛋白中含量最高的蛋白被认为是橡胶合成的延伸因子(Light et al., 1989)。因而,本文试图从橡胶颗粒中丰度最高的蛋白的分离纯化和功能分析入手,以期获得杜仲胶生物合成相关的酶或因子,探讨杜仲胶生物合成的机理。
1 材料和方法 1.1 植物材料材料均取自中国农业大学校园成年杜仲树。
1.2 实验方法 1.2.1 橡胶颗粒的提取与纯化参照Pan等(1995)及赵德刚等(1999)的重复漂洗/离心法(略有改动)。分别采集杜仲叶片、树皮或果皮各70 g浸入冰冷的1%维生素C中,当天用于分离橡胶颗粒;然后在250 mL橡胶颗粒提取缓冲液(100 mmol·L-1 Tris-HCl, pH 7.5, 50 mmol·L-1 KF, 1%Vc, 5 mmol·L-1 MgSO4, 5 mmol·L-1 Mercaptoethanol, 0.1 mmol·L-1 PMSF, 20%PVP)中匀浆,振荡;匀浆经16层纱布过滤,滤液分装入50 mL离心管;4℃,4 000 g, 离心15min,沉淀用约30 mL冰冷的漂洗液(100 mmol·L-1 Tris-HCl, pH 7.5, 5 mmol·L-1 MgSO4, 10 mmol·L-1 DTT)充分悬浮;4℃,2 500 g, 离心8min,沉淀用约15 mL冰冷的漂洗液充分悬浮;4℃,2400g, 离心15min,沉淀用5 mL冰冷的漂洗液充分悬浮,即为3次漂洗后的杜仲橡胶颗粒悬浮液。
1.2.2 SDS-PAGE分析胶粒悬浮液上1.5 mm厚的10% (W/V)聚丙烯酰胺凝胶板,进行SDS-PAGE分析,电泳结束后用考马斯亮蓝R250染色。用于大规模分离的3 mm厚制备型SDS-PAGE方法相同,唯一不同的是电泳缓冲液中以25 mmol·L-1硼酸代替192 mmol· L-1甘氨酸。切下对照道, 经考马斯亮蓝R250染色确定相关蛋白的位置。切下相应的条带,待电洗脱。
1.2.3 电洗脱及蛋白纯度鉴定将从凝胶板上切下来的凝胶段加入到电洗脱仪,洗脱到缓冲液(10 mmol·L-1 Tris-19.2 mmol·L-1 Glycine, pH 8.3)中。洗脱液用PBS (137 mmol·L-1 NaCl, 2.7 mmol·L-1 KCl, 4.3 mmol·L-1 Na2HPO4, 1.4 mmol·L-1 KH2PO4, pH 7.2)充分透析。洗脱液经PEG20000浓缩,通过SDS-PAGE及Beckman P/ACE system 5500毛细管电泳仪鉴定蛋白纯度。
1.2.4 免疫将杜仲胶粒蛋白浓缩成1~2 mg·mL-1的溶液,过滤灭菌,选取3~4月龄健康雄性新西兰大白兔,按以下程序进行免疫:双后肢足垫趾窝各注射1.0 mL抗原乳化液(1.0 mL抗原+1.0 mL弗氏完全佐剂,充分混匀乳化);10 d后,两侧淋巴结各注射1.0 mL抗原乳化液(1.0 mL抗原+1.0 mL弗氏不完全佐剂,充分混匀乳化);14~20 d后,背部皮下注射1.0 mL抗原乳化液(1.0 mL抗原+1.0 mL弗氏完全佐剂,充分混匀乳化);14~20 d后再一次背部皮下注射加强免疫;7~10 d后验血;背部皮下注射加强免疫;一周后心脏穿刺取血。10 000 rpm离心15 min分离血清,分装保存。抗体的质量鉴定参考王国英(1997)的方法。
1.2.5 组织切片制作(1) 固定:取杜仲成熟叶片,用FAA固定液固定,组织材料切成2~3 mm2大小,固定24h。(2)脱水:材料经50%, 70%, 85%, 95%, 100%酒精脱水,4℃下进行,每级0.5 ~1.0 h。(3)透明:50%无水乙醇/50%二甲苯透明0.5~1 h,二甲苯透明0.5~1 h,2次。(4)浸蜡:用低溶点石蜡(52℃),浸透3次,每次30 min,然后使其凝固。蜡组织块在冰箱中保存。(5)切片:用手动转动切片机,切成8~10μm厚。
1.2.6 免疫组织化学定位(1) 用冷TBS冼净。用滤纸擦去切片周围的TBS。(2)滴加溴-碘-冰醋酸橡胶变性试剂,室温下染色24~48 h。用冷TBS冼净。用滤纸擦去切片周围的TBS。(3)用TBS将一抗稀释10~20倍,滴加到切片上,室温下湿盒中作用0.5~1 h。以正常兔血清作对照。冷TBS洗3~5次,每次10 min。(4)用冷TBS将FITC-Goat -Anti-Rabbit-IgG稀释500倍,滴加于切片上,室温,黑暗下作用30~60 min。用冷TBS洗净。(5)在材料周围滴1小滴90%甘油(TBS配制),盖上玻片。在盖玻片周围均匀涂上一层指甲油。将切片放入4℃或-20℃冰箱中30min。(6)荧光显微镜下观察,拍照记录结果。
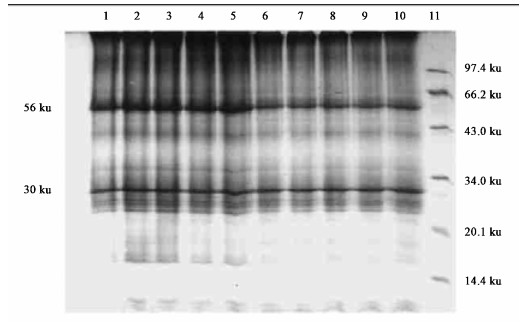
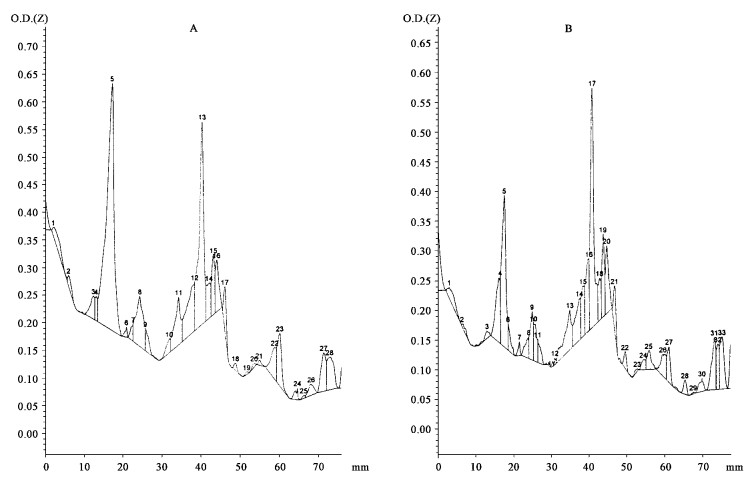
2 结果与分析 2.1 杜仲雌雄株叶片橡胶颗粒蛋白的SDS-PAGE比较分析分别提取杜仲雌雄株叶片的橡胶颗粒,然后进行SDS-PAGE比较发现,雌雄株叶片胶粒结合蛋白电泳图谱基本类似,图谱上可见有十几条蛋白条带,其中以56 ku和30 ku 2种蛋白丰度最高,我们分别称之为EuRPP56和EuRPP30。通过凝胶扫描发现,杜仲雌株叶片胶粒结合蛋白以EuRPP30含量最高,约占胶粒蛋白总量的17%, EuRPP56约占12%;而杜仲雄株叶片胶粒结合蛋白以EuRPP56含量最高,约占胶粒蛋白总量的3 1%, EuRPP30约占16%,如图 1, 图 2所示。
|
图 1 杜仲叶片橡胶颗粒结合蛋白的SDS-PAGE图谱 Fig. 1 SDS-PAGE profile of rubber particle binding proteins from female and male E. ulmoides leaves 1~5道:雄株叶片的胶粒结合蛋白;6~10道:雌株叶片的胶粒结合蛋白;11道:标准分子量蛋白。 Lane 1~5: EuRPPs from male E. ulmoides leaves; Lane 6~10:EuRPPs from female E. ulmoides leaves; Lane 11: Molecular weight marker. |
|
图 2 杜仲叶片胶粒结合蛋白的SDS-PAGE凝胶扫描图谱 Fig. 2 SDS-PAGE gel scanning of EuRPPs from E. ulmoides leaves A. 雄株叶片, 峰5: EuRPP56,峰13: EuRPP30; B. 雌株叶片, 峰5: EuRPP56,峰17: EuRPP30。 A. Male E. ulmoides leaves, Peak 5: EuRPP56, Peak 13: EuRPP30; B. Female E. ulmoides leaves, Peak 5: EuRPP56, Peak 17: EuRPP30. |
分别提取杜仲雌雄株树皮及果皮的橡胶颗粒,然后进行SDS-PAGE,发现树皮、果皮胶粒结合蛋白电泳图谱与叶片基本类似。通过凝胶扫描发现,杜仲雌株树皮胶粒结合蛋白以EuRP P30的含量最高,约占胶粒蛋白总量24%, EuRPP56约占10%;而杜仲雄株树皮Eu RPP56约占胶粒蛋白总量的13%, EuRPP30约占10%;杜仲果皮EuRPP30约占胶粒蛋白总量的11%,EuRPP56约占8%。
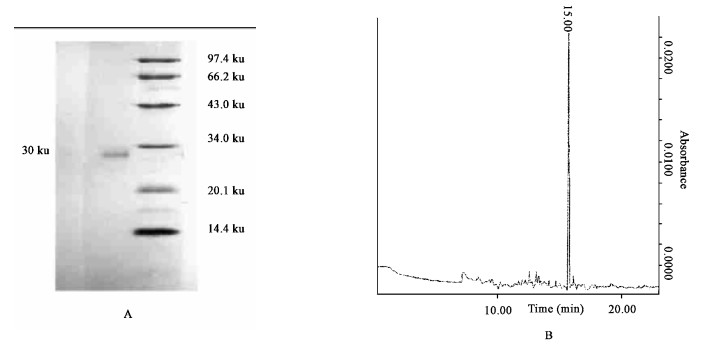
2.3 EuRPP30的纯度鉴定通过电洗脱将分子量为30 ku的蛋白从凝胶中洗脱下来,然后再进行SDS-聚丙烯酰胺凝胶电泳分析(图 3A),发现其纯度较高。用Beckman P/ACE system 5500毛细管电泳仪进一步鉴定EuRPP30,可见蛋白很纯,如图 3B所示。
|
图 3 杜仲EuRPP30的SDS-PAGE纯度鉴定 Fig. 3 Purity determination of EuRPP30 A. SDS-PAGE鉴定道1:EuRPP30,道2:分子量标记;B. 通过毛细管电泳纯度鉴定。 A. Purity determination by SDS-PAGE, Lane 1: EuRPP30, Lane 2: Molecular weight marker; B. Purity determination by capillary electrophoresis. |
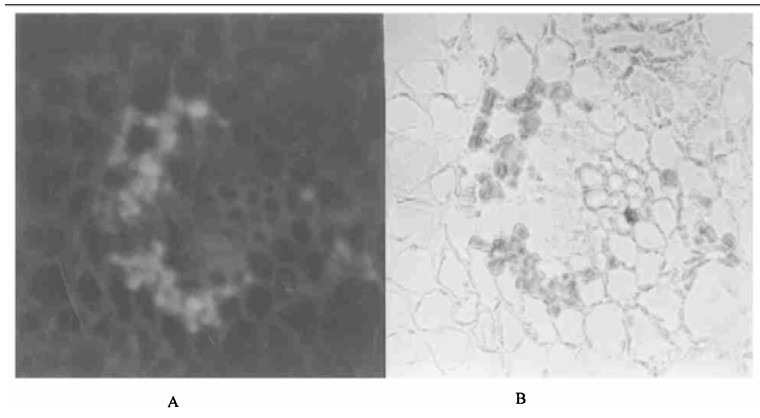
以纯化的EuRPP30为免疫抗原,成功制备了EuRPP30抗体。以小牛肠道碱性磷酸酶标记的羊抗兔免疫球蛋白为二抗,进行抗EuRPP30抗体的免疫印迹(western blott ing)鉴定。结果表明,所制备抗体具有高特异性,与其它蛋白无交叉反应。用此抗体对杜仲叶片进行了免疫组织化学分析。从图 4可以看到,在荧光显微镜下,叶片韧皮部薄壁细胞表现出黄绿色荧光反应(图 4A),而普通叶肉细胞无阳性反应。在光学显微镜下可看到,表现黄绿色荧光反应的部位恰好是胶粒所在部位(溴-碘染色,图 4B),以上结果说明EuRPP 30确为胶粒特异的蛋白。
|
图 4 杜仲叶片EuRPP30的免疫组化分析 Fig. 4 Immunohistochemistry analysis of E. ulmoides leaf section A: 荧光显微镜下成熟叶片的横切面, 示EuRPP30分布在韧皮部薄壁细胞中; B. 光镜下成熟叶片的横切面, 示韧皮部薄壁细胞中的胶粒(10×40)。 A: Transverse section of mature leaf under fluorescent micrography, showing EuRP P30 in phloem parenchyma; B: Transverse section of mature leaf under light microscope, showing that the rubber par ticles contained in phloem parenchyma cells (10×40). |
橡胶的生物合成是一个十分复杂而有序的过程,包括3个连续的步骤:(1)起始,需要一分子的烯丙基焦磷酸;(2)延伸,橡胶转移酶催化异戊烯基焦磷酸1, 4-聚合掺入到橡胶链上;(3)终止,多聚体从合成复合体上解离下来。橡胶转移酶活性的发挥除了异戊烯基焦磷酸及烯丙基焦磷酸底物外,还需要二价金属阳离子。一般认为橡胶转移酶是紧密地结合在胶粒的表面结构上。Cornish (1993)认为含顺式橡胶的植物体内含有顺式-异戊烯基转移酶,它紧密地结合在胶粒的膜嵌合体上,催化IPP顺-1, 4-聚合到延伸中的橡胶链上。Archer等(1963)指出体外研究橡胶生物合成必须要有橡胶颗粒的参与,即胶粒是橡胶体外合成的必要条件。Cornish等(1993)证明反复漂洗的银胶菊胶粒悬液中含有很高的橡胶转移酶活性,证实了橡胶转移酶确实结合在胶粒上。为此,Benedict等(1991)作了进一步的分析,指出橡胶转移酶能合成高分子量的橡胶分子,其酶动力学特性与橡胶树胶乳中分离的漂洗胶粒的橡胶转移酶相似。他们用Chaps处理胶粒,使其结合蛋白溶解出来,其中丰度最高为52 ku的蛋白,在合适的条件下能催化IPP掺入橡胶分子,且与时间成线性关系。因此,他们认为,52 ku的蛋白就是橡胶转移酶。橡胶树胶粒结合的丰度最高的蛋白分子量为14 ku,被认为是橡胶生物合成的延伸因子(Light et al., 1989; Attanyaka et al., 1991)。杜仲胶是天然的反式聚-1, 4-异戊二烯,是天然橡胶的同分异构体,因而可以推测其生物合成机理和过程与天然橡胶相似。为此,我们对杜仲橡胶颗粒结合进行了分离、鉴定和纯化。
对杜仲雌雄株叶片、树皮、果皮橡胶颗粒分别进行了SDS-PAGE分析,结果表明, 杜仲胶粒结合蛋白有十几种,其中以56 ku和30 ku 2种蛋白丰度最高,它们可能在杜仲胶合成过程中起到重要作用。通过凝胶扫描发现,在不同性别的植株中,胶粒蛋白表达模式不完全相同,在杜仲雌株叶片、树皮及果皮中橡胶颗粒蛋白均是EuRPP30 ku含量高于EuRPP56 ku,相反,杜仲的雄株叶片、树皮中橡胶颗粒蛋白均是EuRPP56 ku含量高于EuRPP30 ku。已知杜仲雌雄株的含胶量不同,一般雌株胶含量要大于雄株(王丙武等,1999),可能在不同性别植物中胶合成机制存在某些差异。近期Oh等(1999)在巴西橡胶树中已经发现有2种类型的橡胶颗粒,直径较小的橡胶颗粒所包含的橡胶分子长,其橡胶延长因子为23 ku的胶粒结合蛋白,而直径较大的颗粒包含的橡胶分子短,其胶粒结合蛋白为14 ku。在杜仲胶合成过程中是否也有类似情况,有待于进一步阐明。杜仲叶片、树皮和果皮的含胶量也有较大差异,但SDS- PAGE分析显示树皮、果皮和叶片胶粒结合蛋白组成没有明显区别。可能存在其它调节杜仲胶生物合成的因子。
纯化了EuRPP30 ku,并以此为抗原成功制备了高特异性的抗体。为分离克隆该蛋白的编码基因提供了有效探针,同时该抗体也可以在杜仲胶体外生物合成分析中作为免疫探针,了解该蛋白在杜仲胶合成中的功能。以上工作为探索杜仲胶生物合成机理奠定了基础。
在生产实践中,杜仲胶主要从落叶中提取。但是,杜仲叶片中橡胶的含量很低,大约占叶片干重的2%~3%左右,而树皮中含8%~10%,果皮中则高达12%~18%,其中必然有某种机制控制着杜仲胶的积累方向。目前杜仲胶的需求量不断增加。所以,提高杜仲胶生物合成产量已成为杜仲综合开发利用中一个亟待解决的问题。如果能阐明杜仲胶生物合成的机理,可以通过调节关键酶及基因工程等方法从根本上提高杜仲胶的产量。
卢敏, 田兰馨. 1990. 杜仲茎韧皮部超微结构的初步观察. 浙江林学院学报, 7(4): 316-321. |
田兰馨, 卢敏, 胡正海. 1990. 杜仲含胶细胞发生和发育的研究. 植物学报, 32(1): 1-6. DOI:10.3321/j.issn:1000-4025.1990.01.001 |
王丙武, 王雅清, 莫华, 等. 1999. 杜仲雌雄株细胞学、顶芽及含胶量的比较. 植物学报, 41(1): 11-15. DOI:10.3321/j.issn:1672-9072.1999.01.003 |
王国英. 1997. 基因工程实验技术. 北京: 中国农业出版社, 98-104.
|
严瑞芳.论杜仲胶的研究开发.见: 张康健.中国杜仲研究.西安: 陕西科学技术出版社, 1992: 19-23
|
赵德刚, 韩玉珍, 傅永福, 等. 1999. 杜仲胶生物合成相关蛋白的研究(简报). 中国农业大学学报, 4(1): 114. DOI:10.3321/j.issn:1007-4333.1999.01.032 |
Archer B L, Audley B J, Cockbain E G, et al. 1963. The biosynthesis of rubber: incorporation of mevalonate and isopentenyl pyrophosphate into rubber by Hevea brasiliensis latex fractions. Biochem J, 89: 565-574. DOI:10.1042/bj0890565 |
Attanyka D P T G, Kekwick R G O, Franklin F C H. 1991. Molecular cloning and nucleotide sequencing of the rubber elongation factor gene from Hevea brasiliensis. Plant Mol Biol, 16: 1079-1081. DOI:10.1007/BF00016080 |
Benedict C R. 1991. The enzymatic synthesis of rubber polymer in Parthenuim argertatum Gray. Plant Physiol, 92: 816-821. |
Cornish K, Backhaus R A. 1990. Rubber transferase activity in rubber particles of guayule. Phytochem, 129: 3809-3813. |
Cornish K. 1993. The separate roles of plant cis and trans prenyl transferase in cis-1, 4- polyisoprene biosynthesis. Eur J Biochem, 218: 267-271. DOI:10.1111/j.1432-1033.1993.tb18374.x |
Cornish K, Sisler D J. 1995. Effect of different allylic diphoshpate on the initiation of new rubber molecules and on cis-1, 4-polyisoprene biosynthesis in guayule (Parthenuim argertatum). Plant Physiol, 147: 301-305. DOI:10.1016/S0176-1617(11)82157-7 |
Dickinson P B. 1969. Electron microscopical studies of the vessel system of Hevea brasiliensis. J Rubb Res Inst Malaya, 21: 543-559. |
Light D R, Dennis M. 1989. Purification of a prenyl transferase that elongates cis-polyisoprene rubber from the latex of Hevea brasiliensis. J Bio Chem, 264: 18589-18597. |
Madhavan S, Greenblatt G A, Foster M A, et al. 1989. Stimulation of isopentenyl pyrophosphate incorporation into polyisoprene in extract from guayule plants (Parthenuim argertatum Gray) by low temperature and 2-(3, 4- dichlorophenoxy)-Triethylamine. Plant Physiol, 89: 506-511. DOI:10.1104/pp.89.2.506 |
Oh S K, Kang H, Shin D H, et al. 1999. Isolation, characterization, and functional analysis of a novel cDNA clone encoding a small rubber particle protein from Hevea brasiliensis. J Biol Chem, 274: 17132-17138. DOI:10.1074/jbc.274.24.17132 |
Pan Z Q, Durst F, Gardner H W, et al. 1995. The major protein of guayule rubber particles is a cytochrome P450. J Biol Chem, 270: 8487-8494. DOI:10.1074/jbc.270.15.8487 |
Siler DJ, Goodrich-Tanrikulu M, Konish K, et al. 1997. Composition of rubber particles of Hevea brasiliensis, Parthenuim argertatum, Ficus elastica and Euphorbia lactiflua indicates unconventional surface structure. Plant Physiol biochem, 35: 881-889. |
Tanaka Y, Kawahara S, Aik-Hwee E, et al. 1995. Initiation of biosynthesis in cis-polyisoprene. Phytochem, 39: 779-784. DOI:10.1016/0031-9422(95)00981-C |
Tangpakdee J, Tananka Y, Wititsuwannakul R, et al. 1996. Possible mechanisms controlling molecular weight of rubbers in Hevea brasiliensis. Phytochem, 42: 353-355. DOI:10.1016/0031-9422(95)00963-9 |
Tangpakdee J, Tanaka Y, Shiba K, et al. 1997a. Structure and biosynthesis of trans-polyisoprene from Eucommia ulmoides. Phytochem, 45: 75-80. DOI:10.1016/S0031-9422(96)00806-0 |
Tangpakdee J, Tanaka Y, Oguoa K, et al. 1997b. Rubber formation by fresh bottom fraction of Hevea brasiliensis. Phytochem, 45: 269-274. DOI:10.1016/S0031-9422(96)00838-2 |
 2003, Vol. 39
2003, Vol. 39

