文章信息
- 张惠君, 罗凤霞.
- Zhang Huijun, Luo Fengxia.
- 水曲柳未成熟胚的离体培养研究
- STUDY ON IN VITRO CULTURE OF IMMATURE EMBRYO OF FRAXINUS MANDSHURICA
- 林业科学, 2003, 39(3): 63-69.
- Scientia Silvae Sinicae, 2003, 39(3): 63-69.
-
文章历史
- 收稿日期:2001-07-31
-
作者相关文章
水曲柳(Fraxinus mandshurica Rupr.)为木犀科白蜡树属的落叶乔木。是东北林区珍贵的3大硬阔叶树种之一,也是红松混交林主要树种。水曲柳材质优良,纹理秀美,是建筑、家具、室内装修、造船、制造军工器械及胶合板等的优良用材。用种子播种繁殖是水曲柳传统的繁殖方法,但因种子有长期休眠的习性,需要经过较长时间(240~270 d)的层积处理,才能打破种子休眠(赵玉慧等,1989;Tabrett, 1992; Tylkouski, 1991a; 1991b)。Finch-Savage等(1995)认为抑制欧洲白蜡(F. excelsior)胚萌发的是胚周围组织:胚乳和种皮。进行白蜡属树种离体胚的培养,能够获得萌生的小植株。Arrillaga等(1992)证明用各种方法处理未经层积处理的花白蜡(F.ornus)完整种子,都不能明显提高种子的发芽率,但将种子浸泡24 h后,取出胚进行离体的胚培养,胚萌发率高达90%以上。因此他们认为离体胚培养可以解除种子休眠。Brearley等(1995)将成熟的合子胚经过简单的脱水处理,当胚的含水量降为12%~14%后,在液氮中进行快速冷冻处理,然后再进行胚培养,其萌发率为63%。
到目前为止国内未曾见到水曲柳及其同属树种胚培养的研究报道,且国外也未曾见到有关水曲柳胚培养研究的报道。本文试以水曲柳未成熟胚为外植体进行胚培养研究。
1 材料和方法 1.1 材料本试验取材于沈阳农业大学植物园30 a生水曲柳树。
诱导培养的外植体:分别于7月和8月采集水曲柳不同发育时期的幼果(胚处于原胚状态的幼果,胚已分化成胚根和子叶的幼果)500枚、3 000枚,在无菌条件下剥取未成熟种子的幼胚作为诱导培养的外植体。
继代培养的外植体:用幼胚培养80 d获得的实生苗,在无菌条件下切去苗根作为继代培养的外植体。
生根培养的外植体:用经过2轮继代培养的无根苗作为生根培养的外植体。
1.2 方法 1.2.1 外植体的灭菌在超净工作台上用0.1%的HgCl2对外植体进行表面消毒,消毒时间根据外植体和试验方法而定,然后用无菌水冲洗外植体5次,每次浸泡1 min。
1.2.2 未成熟胚的诱导培养原胚(未发育成形的幼胚)的诱导培养:对胚处于原胚状态的幼果表面消毒5 min,然后将幼果放入无菌培养皿内,用无菌解剖针剥出原胚,接种在玻璃三角瓶内的培养基上。以上操作均在无菌条件下进行。本试验以WPM,QL和DKW为基本培养基,附加BA 0.5 mg·L-1,NAA 0.05 mg·L-1,苹果汁150 g·L-1。
已发育成形的幼胚的诱导培养:对胚已分化成胚根和子叶的幼果表面消毒8 min,然后将幼果放入无菌培养皿内,用无菌解剖针剥出幼胚,接种在分装于玻璃三角瓶内的下列培养基上。
试验1:接种在MS,WPM,DKW,SH,QL和R等6种基本培养基上。这6种培养基都附加BA(0,0.5,1 mg·L-1),NAA (0,0.05,1 mg·L-1)。
试验2:接种在MS,WPM和DKW基本培养基上,培养基中不加任何激素,分别加入果糖、蔗糖、食用白糖,浓度均为3%。
试验3:接种在MS,WPM和DKW基本培养基上,培养基中不加任何激素,以食用白糖为碳源,浓度分别为2%,3%,5%。
以上操作均在无菌条件下进行。培养40 d后转接到相同的培养基上继续培养。
1.2.3 继代培养将外植体(胚培养80 d的去根苗)接种在玻璃三角瓶内的下列培养基上。
试验1:接种在DKW,WPM,B5,SH,QL和R等6种基本培养基上,这6种培养基都附加BA(0,0.05,0.1,0.5,1,2 mg·L-1),NAA(0,0.005,0.01,0.05,0.1,0.2 mg·L-1)。
试验2:接种在WPM,B5和R基本培养基上,培养基中分别加入BA(0,0.05,0.1,0.5,1,2 mg·L-1),KT(0,0.1,0.5,1,3,5 mg·L-1),ZT(0,0.05,0.1,0.5,1,2 mg·L-1)。
试验3:接种在WPM基本培养基上,在培养基中分别按BA:NAA=10:1、20:1、50:1、100:1的比例加入激素,即BA(0.05,0.1,0.5,1,2 mg·L-1),NAA(0.005,0.01,0.05,0.1,0.2 mg·L-1);BA(0.05,0.1,0.5,1,2 mg·L-1),NAA(0.002 5,0.005,0.025,0.05,0.1 mg·L-1);BA(0.05,0.1,0.5,1,2 mg·L-1),NAA(0.001,0.002,0.01,0.02,0.04 mg·L-1);BA(0.05,0.1,0.5,1,2 mg·L-1),NAA(0.000 5,0.001,0.005,0.01,0.02 mg·L-1)。
1.2.4 生根培养将外植体(经过2轮继代培养的无根苗)接种在玻璃三角瓶内的下列培养基上。
试验1:接种在DKW,WPM,B5,SH,QL和R等6种基本培养基上。这6种培养基都附加BA(0,0.05,0.1,0.5,1,2 mg·L-1),NAA(0,0.005,0.01,0.05,0.1,0.2 mg·L-1)。
试验2:接种在WPM和R诱导培养基这2种基本培养基上,培养基中不加细胞分裂素,分别加入NAA(0.1,0.5,1,2 mg·L-1)和IBA(0.1,0.5,1,2 mg·L-1)。
1.3 培养条件在组培室中进行光照培养,温度(23±3)℃,每天用日光灯光照14 h,光强1 000~2 000 lx。
2 结果与分析 2.1 未成熟胚的诱导培养 2.1.1 原胚的诱导培养原胚接种在WPM,QL和DKW等3种基本培养基上培养,20 d后观察培养结果:原胚全部死亡,3种培养基对原胚的诱导效果间没有差异,都不能使原胚成活继续发育或形成愈伤组织。说明水曲柳胚发育初期的胚培养成功与否与所采用的基本培养基无关。
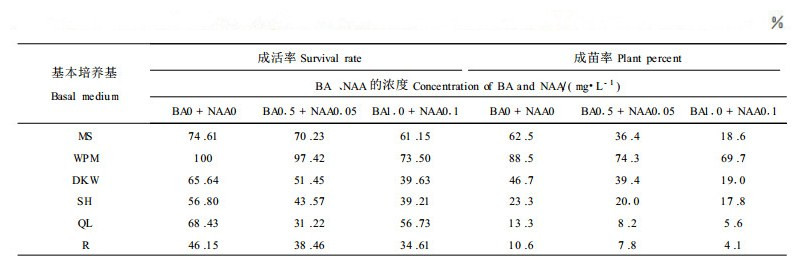
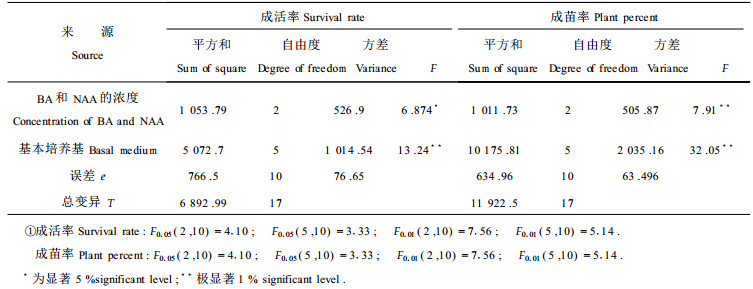
2.1.2 已分化成形的幼胚的诱导培养将幼胚(已分化成子叶和胚根的未成熟胚)接种在含有不同浓度的BA和NAA的MS,WPM,DKW,SH,QL和R等6种琼脂固体培养基中,40 d后,观察并记录幼胚的成活率(图版Ⅰ-1~4),结果列入表 1。对表 1中胚的成活率进行方差分析,结果表明(表 2),不同基本培养基之间对幼胚的培养效果达到极显著差异水平,BA和NAA的不同浓度间对幼胚的培养效果达到显著差异水平。说明幼胚培养的成活率主要取决于所用的基本培养基,并且培养基中BA和NAA的浓度对幼胚的成活也有很大影响。幼胚在这6种基本培养基上的成活率为WPM>MS>QL>DKW>SH>R。其中前4种培养基上胚的成活率都超过了60%,说明这4种培养基都可以作为水曲柳的胚培养的培养基。而且从表 1还可以看出幼胚在不含激素的培养基上的成活率明显高于含有激素的培养基,因此幼胚培养的培养基中不需加任何激素。幼胚培养40 d后,将胚苗转接到相同培养基上进行壮苗培养。壮苗培养40 d后记录不同培养基上的胚苗的最终成苗率,结果也列入表 1。对表 1中胚的成苗率进行方差分析,结果表明(表 2),不同基本培养基之间和BA、NAA的不同浓度间对幼胚成苗的影响均达到了极显著水平。说明幼胚培养的成苗率的高低取决于所用的基本培养基以及培养基中BA和NAA的浓度。

|
图版Ⅰ Plate Ⅰ 1.胚在WPM培养基上的成活情况;2.胚在MS培养基上的成活情况;3.胚在DKW培养基上的成活情况;4.胚在SH培养基上的成活情况;5.WPM培养基上培养的组培苗;6.外植体在WPM培养基上的分生情况(丛生苗分割前);7.外植体在WPM培养基上的分生情况(丛生苗分割后);8, 9.外植体在WPM培养基上的生根情况;10.外植体在DKW培养基上的生根情况。 1. Survival seedlings of embryos cultivated on WPM medium; 2. Survival seedlings of embryos cultivated on MS medium; 3. Survival seedlings of embryos cultivated on DKW medium; 4. Survival seedlings of embryos cultivated on SH medium; 5. Seedlings cultivated on WPM medium; 6. Clustered seedlings cultivated on WPM medium (before cutting); 7. Clustered seedlings cultivated on WPM medium (after cutting); 8, 9. Rooting seedlings cultivated on WPM medium; 10. Rooting seedlings cultivated on DKW medium. |
|
|
|
|
另外,在进行壮苗培养时,胚苗在不同培养基上的生长状况差异较大(如表 3所示),在WPM培养基上培养的胚苗(图版Ⅰ-5)生长健壮、节间长、平均苗较高;而MS培养基上的胚苗长势一般、节间短、平均苗高较矮,并且部分胚苗出现烂根和根枯现象,致使部分胚苗死亡。胚苗之所以在MS培养基上出现这种情况,可能是因为MS培养基中大量元素含量过高,而产生的烧苗现象;其余培养基上的胚苗黄弱,胚苗大量死亡,成苗率低。由此可知,WPM基本培养基中各种营养成分最适宜水曲柳幼胚的生长发育,而且培养基中也无需加任何激素。
|
|
分别以果糖、葡萄糖或食用白糖作为水曲柳未成熟胚的诱导培养基的碳源,培养结果表明不同碳源对水曲柳未成熟胚的成活率及成苗率没有影响。因此为了降低成本可以选用食用白糖作为水曲柳未成熟胚培养基的碳源。
未成熟胚在不同糖浓度的培养基上培养结果如表 4所示,从表中的结果可以看出,培养基中糖含量的多少对未成熟胚的成活率和成苗率没有显著影响。说明水曲柳的胚培养对培养基的渗透压要求不严,因此培养基中糖浓度按常规的3%即可。
|
|
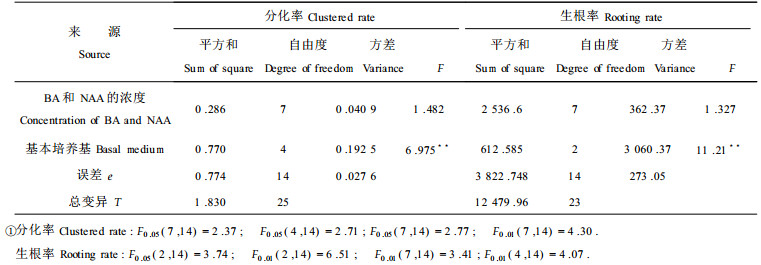
继代培养40 d后,观察外植体在不同培养基上的分化率如表 5所示。方差分析结果(表 6)表明,培养基中BA和NAA的不同浓度诱导外植体分化的效果间差异不显著,而不同基本培养基间的差异达到极显著水平。说明了外植体的分化率的高低主要取决于所用的基本培养基,而培养基中BA和NAA的浓度对外植体分化作用不大。WPM基本培养基上外植体的分化率明显高于其它基本培养基,WPM+BA 1 mg·L-1+NAA 0.1 mg·L-1培养基上外植体分化率最高(图版Ⅰ-6),达到2.125苗·月-1。其中有一株苗培养一个月后形成了6株丛生苗。
|
|
|
|
本研究还将外植体继代培养于含有细胞分裂素BA或KT或ZT的培养基上,30 d后观察分化情况,并对观察结果进行方差分析,结果表明,这3种细胞分裂素诱导外植体分化的效果差异不显著。
为了进一步探索BA和NAA的不同浓度比例对外植体分化率的影响效果,本研究还用BA和NAA的浓度比例为10:1、20:1、50:1、100:1的培养基对外植体进行了继代培养,结果表明,BA和NAA的不同浓度比例对外植体的分化率没有显著影响。说明提高培养基中细胞分裂素的浓度比例并不能提高外植体的分化率。
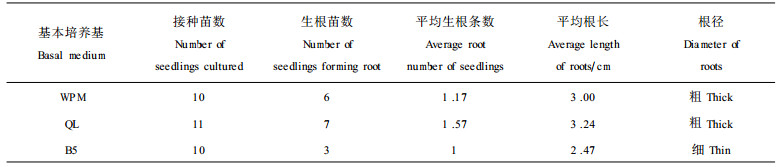
2.3 外植体的生根培养外植体在WPM、B5和QL培养20 d后陆续开始长根。而接种在DKW和R培养基上的外植体不能生根。不同培养基上外植体的生根率调查结果列入表 5,方差分析结果表明(表 6),不同基本培养基诱导外植体生根的效果差异极显著,而BA和NAA的不同浓度间的差异不显著。说明了外植体的生根率主要受基本培养基的影响,QL和WPM培养基上的外植体的生根率明显高于其它基本培养基。并且从苗在不同基本培养基上的生根情况(表 7,图版Ⅰ-8~10)可以看出,这2种基本培养基上苗生根条数多,而且苗根粗壮。因此这2种基本培养基都可作为水曲柳的生根培养基。
|
|
在生根培养基中加入NAA或IBA对外植体生根的影响不大。而且培养基中只加入生长素与按10:1的比例加入细胞分裂素和生长素在诱导外植体生根的效果方面没有显著差异。说明激素对水曲柳组培苗的生根培养的效果没有显著影响。
3 结论与讨论在水曲柳胚的发育初期,当胚处于原胚状态时进行胚培养不易成功,但当胚已经分化成子叶和胚根时,进行胚培养,胚的成活率和成苗率均高。胚培养的胚成活率与成苗率主要取决于基本培养基和培养基中激素的含量。不加任何激素的WPM、MS、DKW、SH培养基都可以作为未成熟胚培养的培养基,而不加任何激素的WPM培养基是壮苗期的最佳培养基,苗木在WPM培养基生长良好,成苗率高,可达到88.6%。
水曲柳组培苗继代培养的外植体分化率低,最高只能达到2.125苗·月-1,没有达到组织培养快速繁殖苗木的要求(4苗·月-1)。外植体分化率的高低主要取决于所采用的基本培养基。外植体在WPM培养基上的分化率高于其它基本培养基,其中WPM+BA 1 mg·L-1+NAA 0.1 mg·L-1上外植体分化率最高。
水曲柳组培苗的生根较容易。外植体生根率的高低主要取决于基本培养基,而与培养基中的激素类型和浓度没有太大的关系。用不含任何激素的WPM和QL基本培养基作为其生根培养基效果较好,生根率分别为60%和66%。
本研究采用从水曲柳未成熟的种子中剥取的未成熟胚作为水曲柳胚培养的外植体获得成功。采用这种方法无需对种子和胚进行特殊处理,可以随时采集水曲柳的幼果,经过表面消毒,剥取未成熟胚直接接种在培养基上培养即可。水曲柳的未成熟胚的培养因无需对种子和胚进行特殊处理,既省时又省力,因此成本相对较低,并且胚的成活率和成苗率都很高,可分别达100%和88.5%(在WPM培养基上培养)。水曲柳未成熟胚培养的成功为白蜡属其它树种的胚培养提供了一种新的可以借鉴的方法。
水曲柳继代培养中苗的分化率低,最高分化率只有2.125苗·月-1,没有达到组培快繁所要求的分化率(4苗·月-1)。这可能与水曲柳的乔木主干性有关。正常情况下,水曲柳一般不易形成分蘖。在组织培养条件下表现为很难形成丛生苗,因此造成苗的分化率较低。即使将水曲柳组培苗的顶芽截去,也只能诱导一个腋芽萌发,而不能使其隐芽萌发,形成众多的丛生苗。而且无论是提高培养基中激素浓度,还是增加细胞分裂素的比例都不能提高苗的分化率。因此在今后的研究中必须找出打破其主干性的方法,从而提高组培苗的分化率。才能达到利用组织培养快速繁殖水曲柳苗木的目的。
另外水曲柳的休眠习性在组织培养条件下也有表现。Nougarede等(1996)在研究欧洲白蜡组织培养时也发现了类似的现象。他们研究证明在细胞周期的间期,取外植体进行组织培养,萌生枝易形成类似于正常休眠芽的芽。当冬季到来时,尽管组培室内人为地为水曲柳的组培苗提供适宜的光照和温度,也不能阻止其进入休眠状态。并且当水曲柳组培苗形成休眠芽后,无论是提高培养基中的激素浓度,还是提高细胞分裂素的比例,或者在培养基中加入赤霉素都不能使其休眠芽萌发,因此打破其休眠习性是水曲柳组织培养的一大难题。
赵玉慧, 李森. 1989. 解除水曲柳种子休眠的方法的研究. 林业科技, (2): 320. |
Arrillaga I, Lerman V, Segura J. 1992. Micropropagation of juvenile and adult flowering ash. Journal of the American Society for Horticultural Science, 117(2): 346-350. DOI:10.21273/JASHS.117.2.346 |
Arrillaga I, Marzo T, Segura J. 1992. Embryo culture of Fraxinus ornus and Sorbus domestica removes seed dormancy. HortScience, 27(4): 371. DOI:10.21273/HORTSCI.27.4.371 |
Brearley J, Henshaw G G, Daver C, et al. 1995. Cryopresenation of Fraxinus excelsior L. zygotic embryos. Cryo-letter, 16(4): 215-218. |
Finch-Savage W E, Clay H A et al. Influence of embryo restraint during dormancy loss and germination of Fraxinus excelsior seeds. In: Ellis R H, Black M et al. Basic and applied aspects of seed biology. Proceedings of the Fifth International Workshop on Seeds, held at Reading, UK on 10-15 December 1995, 1997: 245-253
|
Nougarede A, Silveira C E, Rondet P. 1996. In nature dormant buds and in vitro dormant-like buds of Fraxinus excelsior L. Protoplasma, 190(1/2): 16-24. |
Tabrett A M, Hammatt N. 1992. Regeneration of shoots from embryo hypocotyls of common ash (Fraxinus excelsior). Plant CellReport, 11(10): 514-518. |
Tylkouski T. Storage of stratified seeds of European ash (Fraxinus excelsior L. ). Arboretum Kórnickie, (1988 publ 1991a), 33: 259-266
|
Tylkouski T. Mediumless stratification and dry storage of after-ripened seed of Fraxinus excelsior. Arboretum Kórnickie(1990 publ 1991b), 35: 143-152
|
 2003, Vol. 39
2003, Vol. 39