文章信息
- 郭志华, 臧润国, 奇文清, 余让才.
- Guo Zhihua, Zang Runguo, Qi Wenqing, Yu Rangcai.
- 中亚热带2种原始兰科植物对变化光环境的响应与适应
- THE RESPONSE AND ADAPTATION OF TWO PRIMITIVE ORCHIDS TO A VARIABLE LIGHT ENVIRONMENT IN SUBTROPICAL FORESTS
- 林业科学, 2003, 39(3): 23-29.
- Scientia Silvae Sinicae, 2003, 39(3): 23-29.
-
文章历史
- 收稿日期:2001-05-15
-
作者相关文章
2. 华南农业大学生物系 广州 510632
2. Department of Biology, South China Agriculture University Guangzhou 510632
金佛山兰(Tangtsinia nanchuanica S.C.Chen.)以其近辐射对称的花被、顶生柱头及5枚退化雄蕊等特征,显现出比兰亚科(Orchidoideae)中最原始的头蕊兰属(Cephalanthera)更原始的特征,它的发现对研究兰亚科的系统发育具有十分重要的意义(陈心启,1965)。金佛山兰是单属单种,属国家二级保护植物,分布区十分狭小,仅散生于重庆南川的金佛山及其附近地区。从近期的野外调查来看,金佛山兰的种群数量极小,在南川观测到的数量小于50株。在其分布区内,金佛山兰多单株散生、且与其亲缘种金兰(Cephalanthera falcata)生长在一起;二者加在一起,至多20~30株,散生。但金兰却分布很广,从我国西南、华中至日本均有分布(陈心启,1965)。
金佛山兰分布的海拔高度为800~1 300 m,但主要分布在800~900 m的范围内。据记载,金佛山兰可见于马尾松(Pinus massoniana)林、稀疏灌丛边缘、林窗和草坡(陈心启,1965); 现在,金佛山兰仅见于灌木及草本不发达、林中透光良好的马尾松林下。在金佛山兰的分布区内,土壤为山地黄壤,腐殖质层薄(多<2 cm)。气候为典型的亚热带山地气候,夏季短、气温不高,冬季漫长、冷,霜期较长。
中亚热带马尾松林下草本层环境以光照因子的时空变化剧烈为显著特征。在南川金佛山山地,金佛山兰和金兰的光照环境的时空变化剧烈和复杂。因此,模拟研究金佛山兰和金兰对变化光照条件的响应与适应,有利于加深对马尾松林下植物对变化环境响应与适应性的认识与理解。另一方面,不同大小的林窗,其小生境也是以迅速变化的光环境为最显著特征之一(Schulze et al., 1995;Van Pelt et al., 1999;臧润国等,1999),不同森林林下的光组成也不尽相同(Lowman et al., 1995)。耐荫树种对林窗内光变化的响应差异对于模拟森林动态具有重要意义(Canham, 1989)。因此,研究马尾松林下草本植物对变化光照的响应与适应性,还有利于深入认识林窗内植物对其特殊生境的响应与适应,从而有利于深入认识群落的动态与演替。此外,由于对金佛山兰的许多属性和功用,至今还知之不多或根本不知,甚至还没有人工栽培的成功例子,因此,模拟研究金佛山兰及其亲缘种金兰对变化光照环境的响应和适应,有利于加强对金佛山兰的认识,为其保护与利用提供依据。
在国外,关于植物对变化光环境的响应与适应性的研究指标,主要集中在光合速率、气孔导度和水分利用率(Seemann et al., 1987;Knapp et al., 1987; 1989;1990;Schulz et al., 1995; Fay et al., 1993; 1996),少数涉及叶水势和蒸腾(Fay et al., 1993;Schulz et al., 1995),研究的对象主要是草本,包括亚高山林、温带林、澳洲雨林等林下草本植物,美国大草原各类草本,种植草本以及喜光草本等(Seemann et al., 1987;Knapp et al., 1987; 1989;1990;Schulz et al., 1995;Fay et al., 1993; 1996;Turner et al., 1996; Philip et al., 1998), 少数涉及乔木和灌木(Seemann et al., 1987;Holmes,1995)。国内研究多集中在不同强度的遮荫对各项生态指标的影响,对变化光环境的研究还不多(范燕萍等,1998;郭志华等,1998; 1999)。
1 材料与方法金佛山兰种群数量稀少,难以在野外自然条件下测定其生理生态特征,因此将其与金兰一起移植至温室,同时定期和不定期观测其生长、光合等指标及其受精过程。方法是,在2000-04-16,将生长在金佛山地区、刚发芽的金佛山兰和金兰一起移植,在4月19日移栽到北京植物园兰花温室。
在花期,同时测定长势良好的金佛山兰和金兰(各3株)的光合等生理生态指标。每株选第2~4位叶进行光合测定,每次测定均重复3~6次。时间:2000-05-07~05-11。
用LI-COR6400便携式光合作用测定仪主要测定:光合有效辐射(PAR, μmol photons·m-2 s-1), 净光合速度(Pn, μmol CO2·m-2 s-1), 蒸腾速率(E, mmol·m-2 s-1), 气温(Ta, ℃),叶温(Tleaf, ℃),空气相对湿度(RH,%),水分亏缺(Vpdl, kPa), 大气CO2浓度(Ca, μmol·mol-1), 胞间CO2浓度(Ci, μmol·mol-1)和气孔导度(Con, mol·m-2s-1)。
中亚热带山地马尾松林林缘、林下和林窗内等的光照变化在晴天光合高峰期大约有以下几种情况:①由全光照逐渐地部分遮荫;②低强度的间断遮荫,由全光照间断部分遮荫至光饱和点以下;③高强度的间断遮荫,光照变化更强烈,由全光照直接遮荫至比②更低的水平。在本研究中,在温室内,模拟了这3种变化光照条件,据此研究2种兰花对变化光照的响应与适应。逐渐遮荫的方法是:利用LI-COR6400的光控系统准确控制光合有效辐射强度,逐渐地由高到低,直到PAR为0。间断遮荫的方法是:在温室内晴天条件下,在花期,在1 d中金佛山兰和金兰光合作用的高峰期,先测定二者在PAR800μmol photons·m-2 s-1条件下的光合等指标3~5 min;之后用白色纱布均匀地瞬间遮荫至光饱和点以下,持续约5 min, 继续观测;然后瞬间恢复至PAR 800 μmol photons·m-2 s-1, 持续几分钟,观测光合等的恢复过程。间断遮荫的强度分为2种,一是低强度间断遮荫,遮荫至PAR为150~160 μmol photons·m-2s-1,接近光饱和点的80%;一是高强度间断遮荫,遮荫至PAR为100~110 μmol photons·m-2s-1,约相当于光饱和点的50%。
2 结果与讨论 2.1 遮荫等对叶室内微环境的影响利用开放系统进行的不离体测定植物叶光合速率,均是将待测定植物叶放入一叶室内进行。
大量的观测数据表明,无论是在温室还是在野外,多数情况下,当气体流速为0.5 μmol·s-1,若不利用其温控系统,则叶室内的气温和叶温均会发生不同程度的升高,特别是在晴天强光下,这种现象更明显(图 1)。在温室内PAR为800 μmol photons·m-2s-1的条件下,2 min后,叶室内的叶温和气温约增加0.3℃;5 min后,温度约升高0.5℃(图 1B、C)。

|
图 1 叶室内叶温、气温随遮荫的变化 Fig. 1 The changes of leaf temperature and air temperature in the chamber of LI-COR6400 during shade |
在温室内强光下,20 min的短暂逐渐遮荫(即使遮荫至PAR为0)不会导致叶室内温度的较大变化(图 1A,从800至200 μmol photons·m-2s-1的时间约为20 min);但进一步的长时间遮荫却会导致温度的较大变化,若再遮荫20 min,则气温和叶温将分别升高约2.5℃和3.5℃。从相同的研究得知,若不考虑其他因子的变化,在14~22℃范围内,气温升高3℃可导致Pn增加约1.0 μmol CO2·m-2s-1,即增加约25%以上(郭志华等,2003)。
在温室内,间断遮荫对叶室内叶温的影响比对气温的影响大得多(图 1B、C)。即使在遮荫条件下,叶室内气温依然缓慢上升,然而叶温却随遮荫而迅速下降。当PAR从650下降至100 μmol photons·m-2s-2左右时,叶温在20 s的时间内迅速下降约1.3℃(图 1B)。当PAR从约800下降至120 μmol photons·m-2s-1左右,叶温也可在20 s之内下降约1℃(图 1C)。在低光照条件下,叶温无显著变化。当光照恢复后,叶室内气温依然缓慢上升,而叶温却可以在20 s之内迅速回升至更高水平,恢复光照后的10 s内叶温升高1℃左右。可见,叶温受直接光照的影响很大。
因此,在观测过程中,应尽量缩短观测(无论是否遮荫)时间,并尽量使用温控系统。在野外测量,叶室在强光下暴露时间越长,叶室温度的升高值也越大。这样,要获得更准确的观测值,在强光下应使用温控系统。
2.2 净光合速率等对逐渐遮荫的响应与适应性金佛山兰和金兰的净光合速率、蒸腾速率、气孔导度、胞间CO2浓度和水分利用率等对逐渐遮荫的响应趋势相同,这在一定程度上反映了在中亚热带山地马尾松林下草本植物对变化光环境响应与适应性的本质(图 2)。
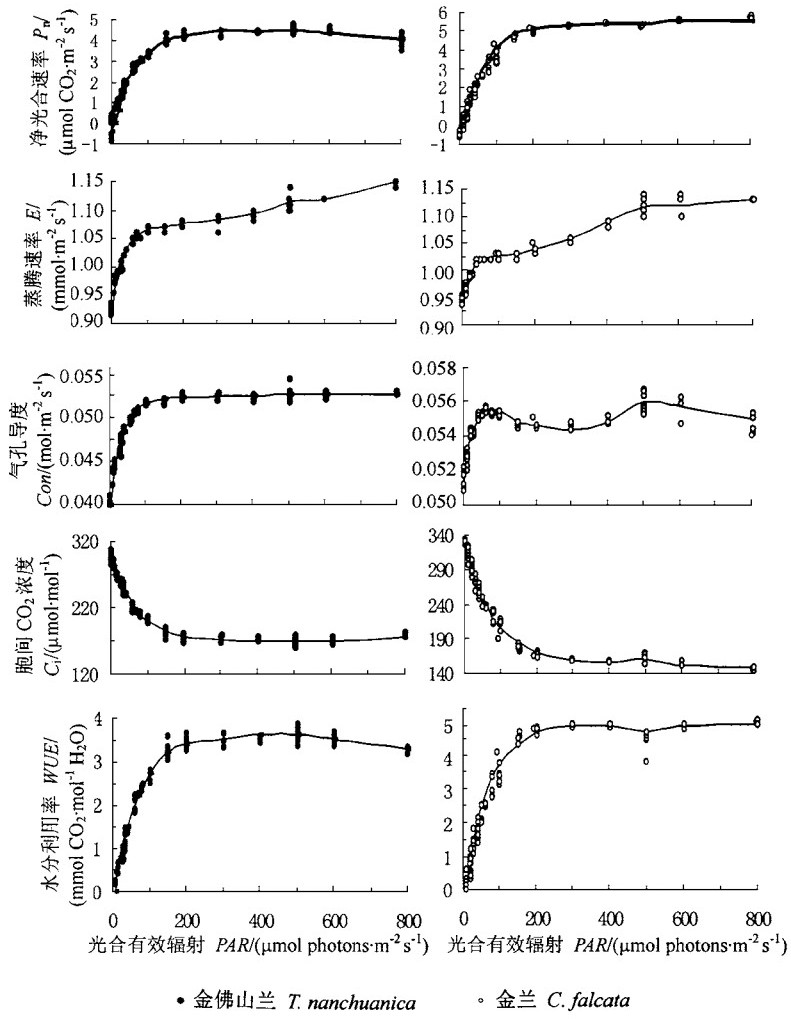
|
图 2 金佛山兰和金兰的净光合速率、蒸腾速率、气孔导度、胞间CO2浓度和水分利用率等对逐渐遮荫的响应 Fig. 2 Responses of Pn, E, Con, Ci and WUE of Tangtsinia nanchuanica and Cephalanthera falcata to gradual shade |
从图 2可知,在当PAR从800逐渐遮荫至200 μmol photons·m-2s-1左右的10~20 min时间内,2种原始兰科植物的净光合速率、胞间CO2浓度、气孔导度和水分利用率等几乎保持不变,仅蒸腾速率略有下降。金佛山兰和金兰的蒸腾速率从1.15和1.13 mmol·m-2s-1下降至1.08和1.03 mmol·m-2s-1,分别下降了约6%和9%,下降幅度并不大。这表明,上述强度的变化光环境对金佛山兰和金兰的光合、蒸腾等几乎没有影响,即金佛山兰和金兰完全适应这种强度的光照因子的逐渐变化和波动。
进一步遮荫至PAR为100 μmol photons·m-2s-1左右时,金佛山兰和金兰的净光合速率、胞间CO2浓度、水分利用率等迅速变化(图 2)。此2种兰科植物的净光合速率和水分利用率均下降了约20%,胞间CO2浓度上升了约15%~20%;然而,二者的蒸腾速率和气孔导度仅下降了约1%~3%,几乎保持不变。蒸腾速率、气孔导度保持不变,以及胞间CO2浓度的升高,为光照恢复后净光合速率的快速恢复提供了条件。可见金佛山兰和金兰对这样的变化光环境也是很适应的。设想,植物对于时间不长的逐渐变化的光环境的适应,可能分为2种类型:一是蒸腾速率、气孔导度等随净光合速率的降低而迅速或同时降低,但在恢复光照后,净光合速率因气孔的部分关闭而恢复较慢,这样以降低光能利用率来保持较高的水分利用率;另一种类型是蒸腾速率和气孔导度并不随净光合速率的降低而变化,保持较高的蒸腾速率和开放的气孔,为恢复光照后净光合速率的快速恢复提供条件,以降低水分利用率来提高对光能的利用。第一种类型的植物或许应在干旱的生境中存在;而后一种类型的植物或许是湿润地区植物的适应特征,金佛山兰和金兰正是该类植物。在我国中亚热带湿润季风气候区,在多数情况下,马尾松林下植物不缺少水分,而在林下,光照往往是植物生长的限制性因子。这样,金佛山兰和金兰对此种程度的光变化的适应是以降低水分利用率、提高光能利用率来保证其对变化光因子的充分利用,从而为其在林下的长期生存提供基础。可以认为,这是它们对林下生态因子适应的一种巧妙的生态对策。
进一步遮荫,使PAR逐渐降至0。此时,金佛山兰和金兰的净光合速率、气孔导度和水分利用率呈线形降低,胞间CO2呈线形增加。即使蒸腾速率和气孔导度的降低幅度较大,但其绝对值仍然较高。由于时间不长,恢复光照后,净光合速率可以快速增加。
2.3 净光合速率等对间断遮荫的响应金佛山兰和金兰是能耐一定程度强光的耐荫植物(郭志华等,2003)。由上述可知,二者在约200 μmol hotons·m-2s-1以上强度的变化光照条件下,其净光合速率、蒸腾速率、水分利用率等的变化很小,表现出对该强度变化光照的良好适应性。本文进一步研究了这2种兰科植物在更低程度下、对不同强度间断遮荫的响应与适应性。
2.3.1 低强度的间断遮荫低强度的间断遮荫是指在温室内,从PAR 700~800 μmol photons·m-2s-1瞬间遮荫至PAR为150~160 μmol photons·m-2s-1(图 3),持续约5 min后,瞬间恢复光照。

|
图 3 金佛山兰净光合速率、蒸腾速率、气孔导度和胞间CO2浓度对间断遮荫(弱)的响应 Fig. 3 Responses of Pn, E, Con and Ci of Tangtsinia nanchuanica to discontinuous shade(weak) |
从图 3、图 4可知,在约2 min的PAR 800 μmol photons·m-2s-1期间,金佛山兰Pn、E, Con和Ci等的值很稳定。当光照从约700瞬间降至160 μmol photons·m-2s-1时,净光合速率在约20 s的时间内迅速下降到最低值,即约为遮荫前Pn值(最高值)的74%。随遮荫的持续,净光合速率缓慢增加,约5 min后,Pn约增加至最高值的88%(图 3),其中原因有待进一步研究。恢复光照后,Pn在10 s之内迅速恢复至遮荫前的水平。所有这些均表明金佛山兰对如此强度间断遮荫的良好适应性。

|
图 4 金佛山兰(左)和金兰(右)的净光合速率、蒸腾速率、气孔导度和胞间CO2浓度等对间断遮荫(强)的响应 Fig. 4 Responses of Pn, E, Con and Ci of Tangtsinia nanchuanica (left) and Cephalanthera falcata(right) to discontinuous shade (strong) |
在遮荫过程中,蒸腾速率和气孔导度缓慢下降,5 min内下降至遮荫前的90%左右。恢复光照后,蒸腾速率迅速恢复至遮荫前水平,而气孔导度并未明显回升,依然在略低的水平上波动。
在遮荫过程中,金佛山兰叶片的胞间CO2浓度迅速增加20%以上; 恢复光照后,胞间CO2浓度迅速下降至遮荫前的水平,随后缓慢波动。
金兰对此强度间断遮荫的响应与适应性同金佛山兰。
2.3.2 高强度的间断遮荫高强度的遮荫是指在温室内,从PAR 800 μmol photons·m-2s-1瞬间遮荫至PAR为100~110 μmol photons·m-2s-1左右(图 4),持续约5 min后,瞬间恢复光照。
与低强度间断遮荫相比,金佛山兰和金兰除了其净光合速率、蒸腾速率、胞间CO2浓度和气孔导度等在高强度遮荫下的变化幅度更大外,其响应和适应性策略也略有不同。
2种兰花的净光合速率对高强度遮荫的响应大致相同,但金兰比金佛山兰在恢复光照后能更迅速地恢复光合作用。遮荫之初,二者的Pn在20 s左右的时间内迅速降低至遮荫前的56%左右。随遮荫的持续,Pn逐渐缓慢回升。约5 min后,Pn回升至遮荫前的70%左右,同样表现出对高强度遮荫的很好适应。恢复光照后,金佛山兰在约40 s的时间内Pn恢复至遮荫前的水平,而金兰却在20 s左右的时间内Pn迅速恢复至遮荫前水平。所有这些与一林下亚高山草本Arnica cordifoliar明显不同,与另一个大叶的亚高山草本Frasera speciosa相似(Knapp et al., 1987)。Arnica cordifolia在从全光照(>1 800 μmol photons·m-2s-1)遮荫至400~450 μmol photons·m-2s-1并持续(8±1) min后,需要2~3 min的时间Pn才能恢复至全光照的水平,而Frasera speciosa的Pn恢复要快得多(Knapp et al., 1987)。Helianthus annus在5 min的间断遮荫后,Pn的恢复需3 min以上的时间,而Baptisia bracteata var.glabrescens的Pn却恢复很快(Fay et al., 1996)。
在蒸腾速率方面,金佛山兰的E值在遮荫后20 s之内迅速降低至遮荫前的86%左右,之后在90%附近波动;恢复光照后,E在20 s之内迅速恢复至PAR 800 μmol photons·m-2s-1的水平。而金兰的蒸腾速率在遮荫后10 s之内更迅速地降低至最高值的76%左右,之后在80%左右的范围内波动; 恢复光照后,金兰的蒸腾速率在约5 min的时间内也未见恢复,仅在微升之后,降至80%以下水平波动。其中原因有待进一步研究。一些物种的蒸腾速率受间断遮荫的影响大,如Helianthus annus(Fay et al., 1996),另一些受间断遮荫的影响小,如Baptisia bracteata var.glabrescens(Fay et al., 1996)。
在遮荫过程中,遮荫对金佛山兰气孔导度的影响不大,而金兰的气孔导度却明显降低。相同的是,在恢复光照后,二者的气孔导度均明显低于遮荫前的水平。间断遮荫对气孔导度的影响因物种而异,如:亚高山灌木Artemisia tridentata和草本Arnica cordifolia在遮荫(8±1)min后,气孔导度分别下降至遮荫前的60%和50%以下(Knapp et al., 1987),而Frasera speciosa(Knapp et al., 1987)、Baptisia bracteata var.glabrescens(Fay et al., 1996)、Populus tremuloides、Pinus flexilis和Abies lasiocarpa(Knapp et al., 1989)等的气孔导度受间断遮荫的影响较小。
高强度遮荫导致金佛山兰和金兰胞间CO2浓度显著升高20%左右。恢复光照后,金佛山兰的Ci迅速恢复至遮荫前水平,而金兰的Ci却降低至更低的水平上波动(图 4)。
3 结论利用便携式光合作用测定系统在自然、半自然状态下进行植物光合作用等的研究时,强光将导致探头温度大大高于气温,从而影响叶室内的气温、叶温等微环境,并且长时间的不间断测量也会引起叶室内温度的明显升高,而温度对植物叶的光合速率等影响很大,因此,要获得更准确的结果,应在观测时尽量使用温控系统。
光照在800~200 μmol photons·m-2s-1之间的连续或间断变化,对金佛山兰和金兰的净光合速率、蒸腾速率、胞间CO2浓度、气孔导度和水分利用率等的影响甚微,从而反映了金佛山兰和金兰对该光照强度变化的良好适应性;对于到200 μmol photons·m-2s-1以下的逐渐遮荫,金佛山兰和金兰对此的适应是以降低水分利用率、提高光能利用率、从而保证其对变化光因子的充分利用来实现的,进而为其在林下的长期生存提供基础。
不同强度的间断遮荫(从PAR 800 μmol photons·m-2s-1分别遮荫至PAR为160和110 μmol photons·m-2s-1)对金佛山兰和金兰的光合等的影响不同。在约5 min的间断遮荫期间,金佛山兰和金兰的净光合速率均先迅速降至最低,然后逐渐回升,恢复光照后,金兰比金佛山兰能更快地恢复至最大光合速率; 蒸腾速率随不同程度的间断遮荫,迅速降低至不同程度的低值,恢复光照后,多数情况下能迅速恢复至遮荫前水平;5 min不同强度的间断遮荫,可能导致这2种原始兰花在恢复光照后,其气孔导度不同程度的降低,其中原因还有待进一步研究;而不同程度的间断遮荫均能导致这2种草本植物胞间CO2浓度升高约20%以上,恢复光照后,胞间CO2浓度大多能迅速恢复至遮荫前的水平。所有这些,都表明金佛山兰和金兰对所在地区的变化光环境具有良好适应性。或许,这些也是亚热带马尾松林下能忍受强光的耐荫植物的普遍属性。
陈心启. 1965. 一个原始的兰科新属进兰属(Tangtsinia)及其在系统发育上的意义. 植物分类学报, 10(3): 193-206. |
范燕萍, 余让才. 1998. 不同遮荫水平对Spathiphyllum palls生长和光合特征的影响. 园艺学报, 25(3): 270-274. DOI:10.3321/j.issn:0513-353X.1998.03.012 |
郭志华, 王伯荪, 张宏达. 1998. 银杏的蒸腾特性及其对遮荫的响应. 植物学报, 60(6): 567-572. DOI:10.3321/j.issn:1672-9072.1998.06.014 |
郭志华, 张宏达, 李志安, 等. 1999. 鹅掌楸(Liriodendron chinense)苗期光合特性的研究. 生态学报, 19(2): 164-169. DOI:10.3321/j.issn:1000-0933.1999.02.004 |
郭志华, 臧润国, 奇文清, 等. 2003. 两种原始兰科植物生理生态特征的比较. 林业科学, 39(1): 50-55. |
刘贤赵, 康绍忠, 邵明安, 等. 2000. 土壤水分和遮荫水平对棉花叶光合特征的影响. 应用生态学报, 11(3): 377-381. DOI:10.3321/j.issn:1001-9332.2000.03.013 |
臧润国, 刘静艳, 辛国荣. 1999. 南亚热带常绿阔叶林林隙小气候初步分析. 植物生态学报, 23(增刊): 123-129. |
Canham C D. 1989. Different responses to gaps among shade-tolerant tree species. Ecology, 70(3): 548-550. DOI:10.2307/1940200 |
Fay P A, Knapp A K. 1993. photosynthetic and stomatal responses of Avena sativa(Poaceae) to a variable light environment. Am J Bot, 80(12): 1369-1373. DOI:10.1002/j.1537-2197.1993.tb15380.x |
Fay P A, Knapp A K. 1996. Photosynthetic and stomatal responses to variable light in a cool-season and a warm-season prairie forb. Int J Plant Sci, 157: 303-308. DOI:10.1086/297349 |
Holmes T H. 1995. Woodland canopy structure and the light response of juvenile Quercus lobata(Fagaceae). Am J Bot, 82(1): 1431-1442. |
Knapp A K, Smith W K. 1990. Contrasting stomatal responses to variable sunlight in two subalpine herbs. Am J Bot, 77(2): 226-231. DOI:10.1002/j.1537-2197.1990.tb13548.x |
Knapp A K, Smith W K. 1989. Influence of growth form on ecophysiological responses to variable sunlight in subalpine plants. Ecology, 70(4): 1069-1082. DOI:10.2307/1941376 |
Knapp A K, Smith W K. 1987. Stomatal and photosynthetic responses during sun/shade transitions in subalpine plants: influence on water use efficiency. Oeologia, 74: 62-67. |
Lowman M D, Nadkarni N M. 1995. Forest canopies. London: Academic Press, 786-789.
|
Philip A, Knapp A K. 1998. Response to short-term reductions in light in soybean leaves. Int J Plant Sci, 159(5): 805-810. DOI:10.1086/297600 |
Schulz K E, Adams M S. 1995. Effect of canopy gap light environment on evaporative load and stomatal conductance in the temperate forest understory herb Aster macrophyllus(Asteraceae). Am J Bot, 82(5): 630-637. DOI:10.1002/j.1537-2197.1995.tb11507.x |
Seemann J R, Sharkey T d, Wang J L, et al. 1987. Environmental effects on photosynthesis, nitrogen-use efficiency, and metabolite pools in leaves of sun and shade plants. Plant Physiol, 84: 796-802. DOI:10.1104/pp.84.3.796 |
Turner C L, Knapp A K. 1996. Responses of a C4 grass and three C3 forbs to variation in nitrogen and light in tallgrass prairie. Ecology, 77(6): 1738-1749. DOI:10.2307/2265779 |
Van Pelt R, Franklin J F. 1999. Response of understory trees to experimental gaps in old-growth douglas-fir forests. Ecol Appl, 9(2): 504-512. |
 2003, Vol. 39
2003, Vol. 39
