文章信息
- 白根本, 沈昕, 王沙生.
- Bai Genben, Shen Xin, Wang Shashen.
- 胡杨盐诱导基因与盐抑制基因的差减杂交显示研究
- DIFFERENTIAL EXPRESSION OF SALT-INDUCED/REPRESSED GENES IN POPULUS EUPHRATICA USING SUBTRACTIVE HYBRIDIZATION TECHNIQUE
- 林业科学, 2003, 39(2): 168-170.
- Scientia Silvae Sinicae, 2003, 39(2): 168-170.
-
文章历史
- 收稿日期:2000-05-04
-
作者相关文章
2. 北京林业大学 北京 100083
2. Beijing Forestry University Beijing 100083
基因筛选是基因克隆与遗传转化的基础工作, 其目的是估测在环境刺激或诱导条件下基因表达水平上的变化。即估测直接或间接表达基因的数目, 并进一步作为分子标记进行基因分离与克隆。
胡杨在盐诱导条件下蛋白质电泳结果显示, 与对照(0%)相比, 既有增加的条带, 也有减少的条带, 客观上证明了盐胁迫关闭了一些基因(抑制基因)的转录, 也开启了一些基因(诱导基因)的转录。本研究旨在将这些盐诱导及盐抑制基因筛选出来, 以便进一步进行抗盐基因的筛选与克隆。
1 材料与方法胡杨2 a生盆栽实生苗, 分别用0%, 0.5%, 1%和2%的NaCl溶液处理。按24 h, 48 h和72 h采取嫩根备用。
1.1 制备RNA和cDNA混合取不同盐浓度及不同时间处理的嫩根5 g作为试验对象(Tester/+), 不同时间清水处理的5 g嫩根作为试验探针(Driver/-), 液氮研磨, 加50 μL提取缓冲液(4 mol异硫氰酸胍; 25 mmol柠檬酸钠; pH7.0; 0.5%SDS; 0.1 mol β-巯基乙醇)振荡30 s, 加1/10体积预冷的2 mol NaAc(pH4.0)振荡30 s, 加等体积水饱和酚振荡30 s, 加1/5体积的氯仿异戊醇抽提(24: 1), 振荡30 s, 冰浴15 min, 4 ℃ 5 000 g离心10 min, 水相用等体积异丙醇沉淀, 75%预冷乙醇漂洗, 干澡, 将RNA沉淀溶于500 μL DEPC处理的去离子无菌水中。用oligo(dT)纤维素分离mRNA。cDNA合成用Promega公司生产的cDNA合成试剂盒。
1.2 限制性内切酶酶切, 加连接子及PCR扩增(Wang et al., 1991; Wieland et al., 1990)用限制性内切酶AluI将双链cDNA酶切, 使其长度适合PCR扩增。在酶切的双链cDNA片段上加磷酸化的寡核苷酸连接子, 连接子设计为一端是平末端, 另一端为4碱基3′突出末端(CTCTTGCTTGAATTCGGACTA和TAGTCCGAATTCAA GCAAGAGCACA), 并含有一个EcoR I酶切位点。200 pmol磷酸化的连接子13 μL与10 μL cDNA在T4连接酶作用下连接, 用DEAE法从1.4%的琼脂糖电泳凝胶上收集带有连接子的383 bp以上的cDNA片段, 经洗脱(1 mol NaCl; 10 mmol Tris·Cl, pH8.0; 10 mmol EDTA), 酚, 氯仿异戊醇(24: 1)抽提, 异丙醇沉淀, 溶解到40 μL无菌水。用收集的加连接子的cDNA片段作模板, 以连接子中的21 bp DNA序列为引物进行PCR扩增, 扩增体积100 μL, +/-cDNA各10管, 扩增产物约160 μg。用氯仿异戊醇(24: 1)抽提1~2次, 异丙醇沉淀, 用无菌水稀释为1 μg.μL-1备用。
1.3 差减杂交(Ariazi et al., 1996; Wieland et al., 1990; Duguid et al., 1989)分别取50 μg PCR扩增的+/-cDNA, 用200 U的EcoR I内切酶37 ℃酶切2 h, 酚, 氯仿, 异戊醇抽提2~3次, 异丙醇沉淀, 用50 μL无菌水分别溶解+/-cDNA沉淀。(1)光敏生物素标记:在50 μL +/- cDNA分别加入1.5倍体积的光敏生物素(中国军事医学科学院放射研究所生产)用LYQ12- 100溴钨灯光照30 min, 标记产物呈暗红色反应液, 用等体积仲丁醇萃取2次, 3 000 r·min-1离心1 min, 弃上清醇相, 保留水相。(2)长杂交, 短杂交和PCR扩增:取非生物素标记的+/- cDNA各2.5 μg分别加入生物素标记的50 μg -/+cDNA溶液, 加3 mol NaAc摇匀, 2.5倍体积的冷无水乙醇共沉淀20 min, 12 000 r·min-1离心15 min, 弃上清, 将沉淀溶解到10 μL TE缓冲液(10 mmol Tris, 1 mmol EDTA, pH8.0) 100 ℃水煮3 min变性, 低速离心收集液体, 与2 ×10 μL杂交缓冲液(1.5 mol NaCI, 50 mmol Hepes, 10 mmol EDTA, 2%SDS, pH7.5)混合, 液体石蜡覆盖杂交液面, 沸水煮3 min, 68 ℃水浴20 h(长杂交)。
长杂交结束后, 在杂交反应管中加入55 ℃预热的HE缓冲液(10 mmol Hepes, 1 mmol EDTA, pH 7.6), 使NaCl浓度由0.75 mol降到0.1 mol, 55 ℃水浴5 min, 取水相, 加入10 μL链亲合素(链亲素15 mol NaCl, 10 mmol Hepes, 1mmol EDTA, pH7.6缓冲液, 2 μg μL), 室温放置20min, 酚、氯仿/异戊醇抽提, 乙醇沉淀, 稀释到25 μL无菌水中, 将第一次长杂交的试验对象(+1cDNA)和试验探针(-1cDNA)分别与25 μg生物素标记的-/+cDNA混合进行2 h短杂交(杂交方法同长杂交), 短杂交后的cDNA片段(+ 2/-2cDNA)用酚、氯仿异戊醇抽提2.5倍体积无水乙醇沉淀, 用无菌水稀释到50 μL。取2 μL+2/-2cDNA作模板, 用连接子中21 bp单链DNA序列作引物, 进行PCR扩增(反应体积100 μL, 94 ℃1 min, 50 ℃1 min, 72 ℃2 min, 45次循环。), 获得50 μg以上扩增产物, 以备下一轮差减杂交(图 1)。取5 μL扩增产物在5%聚丙烯酰胺测序凝胶上电泳, 银染色法观察显带结果(图 2), 并根据显带结果决定是否做下轮长杂交, 短杂交和PCR扩增循环。

|
图 1 差减杂交流程图 Fig. 1 The flow chart of subtractive hybridization for inducing gene LH, 长杂交; SH, 短杂交; BD, 生物素标记探针。 L H: long hybridization, SH: short hybridization, BD: probe biotinlabel. |
|
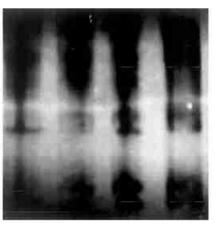
图 2 PCR扩增显示差减杂交特异基因片段 Fig. 2 PCR product display during subtractive hybridization process |
图 2结果显示, 经若干轮杂交后, 差异DNA片段逐渐富集。当差减杂交进行到+4/-4时, 已有明显的条带显示, 到+6/-6以后的杂交, 一些稀有的差异条带逐步显示出来。我们已从+6/-6至+8/-8中收集到大约40个条带, 并将作为分子探针分别盐处理和对照做Northern杂交, 进一步检测cDNA片段的特异性和进行基因克隆。
2.2 mRNA的差异表达胡杨在盐诱导下, 开启了一些与抗盐有关的基因表达, 同时也关闭了一些盐敏感基因的表达(图 2)。这与胡杨盐胁迫条件下的蛋白质分析结果相吻合, 为抗盐机理的研究提供了直接证据。
3 讨论差减杂交显示法(subtractive hybridization)筛选胡杨盐诱导基因和盐抑制基因, 可以用总mRNA的逆转录产物cDNA直接杂交显示, 不必分组可以减少工作量, 并可直接区分盐诱导基因与抑制基因片段, 与差式显示(differential display-PCR)或差式分析(representational difference analysis)相比, 能有效地显示一些低丰度的差异基因, 出现的假带少。
杂交、扩增是试验成败的关键, 杂交探针应尽量多, 一般达到20~50倍, 以便进行竞争性杂交, 防止模板自身复性, 长杂交对较低丰度基因片段的杂交比较有效, 而对高丰度基因片段的扣除短杂交更有效, 扩增是差异显示的必要手段, 对双向PCR扩增来讲, 扩增效率为2n, 使一些本底表达很微弱的基因通过扩增显示出来, 因此, 杂交前连接子的酶切处理必需充分, 适当过量的内切酶处理是必要的, 即使微弱的残留也会影响试验结果, 电泳采用灵敏度高的聚丙烯酰胺测序凝胶、银染色法效果较好。从胡杨盐诱导基因的条带数来看, 与盐诱导相关的表达基因相对癌诱导表达基因的数目(约3 000个条带)要少, 但这并不说明胡杨的抗盐基因表达及调控机理简单。
Ariazi E A, Michael N. 1996. Gould. Identifying differential gene expression in monoterpenetreated mammary carcinomaras using subtractive display. Journal of Biological Chemistry, 271(46): 29 286-29 294. DOI:10.1074/jbc.271.46.29286 |
Duguid John R, Mary C. 1989. Dinauer. Library subtraction of in Vitro cDNA library to identify differentially expressed gene inscrapie infection. Nucleic Acids Research, 18(9): 2 789-2 792. |
Wang Z, Donald D, Brown. 1991. A gene expression screen. Proc Natl Acad Sci USA, 88: 11 505-11 509. DOI:10.1073/pnas.88.24.11505 |
Wieland I, Graeme B, GiGi A, et al. 1990. Method for difference cloning: gene amplification following sutractive hybridization. Proc Natl Acad Sci USA, 87: 2 720-2 724. DOI:10.1073/pnas.87.7.2720 |
 2003, Vol. 39
2003, Vol. 39
