文章信息
- 范国强, 李有, 郑建伟, 翟晓巧.
- Fan Guoqiang, Li You, Zheng Jianwei, Zhai Xiaoqiao.
- 泡桐丛枝病发生相关蛋白质的电泳分析
- SDS-PAGE OF PROTEINS RELATED TO PAULOWNIA WITCHE' S BROOM
- 林业科学, 2003, 39(2): 119-122.
- Scientia Silvae Sinicae, 2003, 39(2): 119-122.
-
文章历史
- 收稿日期:2002-04-15
-
作者相关文章
丛枝病是泡桐(Paulownia)生产中长期没有根本解决的问题之一。自土居养二等发现泡桐丛枝病的病原菌———植物菌原体以来, 国内外科技工作者作了大量的研究工作, 初步明确了病原的传播方式、发生规律和发病过程中的生理生化变化(范国强等, 1997a; 金开璇, 1989; 巨关升等, 1996;宋晓斌等, 1997;田国忠等, 1999; 王蕤等, 1981; 袁巧平等, 1994; 张春立等, 1996; 朱澄等, 1991), 但泡桐丛枝病的发生机理研究没有出现人们初期预料那样大的进展。近年来, 虽然有人研究了菌原的一些分子生物学特征(林木兰等, 1993; 张春立等, 1994), 但对寄主泡桐的研究较少。众所周知, 蛋白质是基因表达的最终产物, 其在植物生长发育过程中起着重要的作用。然而, 至目前与泡桐丛枝病发生相关特异蛋白质的电泳结果在国内外未见报道。本文以毛泡桐和白花泡桐为材料, 研究了其病株和健株叶片蛋白质的变化情况, 为进一步揭示泡桐丛枝病的发生机理提供参考。
1 材料与方法 1.1 实验材料实验材料为1999年取自河南农业大学郑州林业试验站的毛泡桐(Paulownia tomentosa)和白花泡桐(P.Fortunei)。分别采集其同龄、同品种、树冠中部且朝南方向的病株病叶、病株健叶和健株健叶, 并依次用自来水、蒸馏水洗净, 用纱布包好置于液态氮中保存备用。
1.2 实验方法 1.2.1 叶片蛋白质干粉的制备参见范国强等(1997b)方法。
1.2.2 蛋白质样品制备分别称取上述制备的干粉30 mg, 置于1.5 mL离心管内, 加400 μL样品处理液(单向电泳)(2%SDS, 0.01 mol·L-1Tris, 5%β-巯基乙醇, pH 6.8)或样品裂解液(双向电泳)(9.0 mol·L-1尿素, 2%NP-40, 1.6%两性载体电解质pH 5~7, 0.4%两性载体电解质pH 3.5~10)震荡混匀, 于35 ℃水浴锅中温浴30 min, 然后, 室温下10 000 ×g离心30 min, 上清液即分别为单向电泳和双向电泳的上样蛋白质样品。
1.2.3 蛋白质单向电泳(SDS-PAGE)参见Laemmli(1970)的方法蛋白质上样量为200 μg·泳道-1, 电流强度为20 mA·版-1, 当溴酚蓝指示带接近胶板下沿1 cm时停止电泳(时间约为8 h)。凝胶用染色液[ 0.25 g·L-1考玛斯亮蓝R250, 45%甲醇, 10%乙酸]染色过夜, 第2天用脱色液(10%甲醇, 7%乙酸)脱色, 脱色好的凝胶用于照相。
1.2.4 凝胶扫描用CS-9000日本岛津双波沸点扫描仪扫描。扫描波长为575 nm, 以600 nm作参考波长。
1.2.5 蛋白质双向电泳(2-D-PAGE)参照O' Farrell方法(1975)。第一向等电聚焦电泳用柱状凝胶法。凝胶柱长15 cm, 内径1.5 mm, 凝胶浓度为4%。上、下极电泳液分别为0.02 mol·L-1NaOH、0.01 mol·L-1 H3PO4溶液。上样量为1.5 mg总蛋白质。先用400 V电压电泳1 h, 再调压至1 200 V电泳15 h。电泳结束后, 用10%TCA(用丙酮配制, 内含0.07%的巯基乙醇)固定凝胶30 min, 然后用蒸馏水冲洗两遍, 再在平衡液(10%甘油, 5%β-巯基乙醇, 2.3%SDS, 0.625 mol·L-1Tris, pH 6.8)中平衡30 min, 用溶解在平衡液中1%的琼脂固定于第二向电泳的上样端, 当溴酚蓝指示带接近凝胶下沿1 cm时结束电泳。用1.2.3中方法将凝胶染色脱色后进行拍照和分析。
2 结果与分析 2.1 不同种泡桐叶片的蛋白质单向电泳(SDS-PAGE)由毛泡桐和白花泡桐病株病叶、病株健叶和健株健叶蛋白质的单向聚丙烯酰胺凝胶电泳图(图 1)及扫描图(图 2)可以看出, 这两种泡桐叶片蛋白质的种类和含量都存在着差异。毛泡桐和白花泡桐的病株健叶、病株病叶和健株健叶的蛋白质明显谱带分别为22、20及17以及27、21和22条。毛泡桐健株健叶、病株健叶内分子量为66、47、21.2、12KD的蛋白质含量比病株病叶内的含量高; 健株健叶、病株健叶内分子量为40KD的蛋白质含量比病株病叶内的低, 而健株健叶内分子量为36.5、25.5、18KD的蛋白质比病株健叶和病株病叶内的低。对白花泡桐, 分子量为50.5、36.5、25.5、21.2、12KD的蛋白质在其健株健叶和病株健叶内的含量比其病株病叶内的含量高, 分子量为39、33、27、14KD的蛋白质在健株健叶内的含量比其病株健叶和病株病叶内的含量低。此外, 白花泡桐的健株健叶和病株健叶内比其病株病叶多一种分子量为43.5KD的蛋白多肽。以上结果表明, 毛泡桐和白花泡桐病株病叶、病株健叶和健株健叶内蛋白质在种类上各有其特异的蛋白质谱带出现、含量上也存在一定的差异, 但其3种叶片蛋白质变化没有相同的规律。
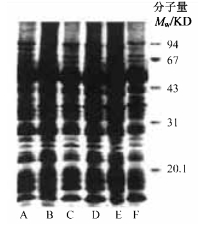
|
图 1 毛泡桐和白花泡桐叶片蛋白质SDS-PAGE图 Fig. 1 SDS-PAGE of proteins in different Paulownia tree leaves A:毛泡桐健株健叶Healthy leaves of P.tomentosa B:毛泡桐病株健叶Infected-healthy leaves of P. tomentosa; C:毛泡桐病株病叶Diseased leaves of P.tomentosa; D:白花泡桐健株健叶Healthy leaves of P.fortunei; E:白花泡桐病株健叶Infectedhealthy leaves of P.fortunei; F:白花泡桐病株病叶Diseased leaves of P.fortunei.下同The same below. |
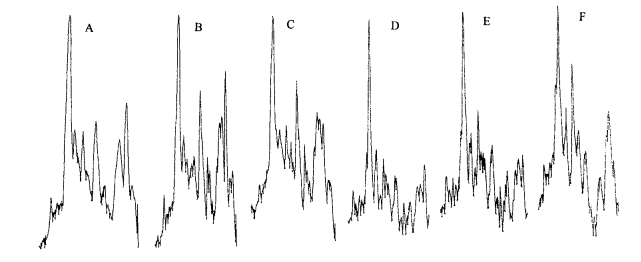
|
图 2 毛泡桐和白花泡桐叶片蛋白质SDS-PAGE扫描图 Fig. 2 Scanning of SDS-PAGE of proteins in leaves of different Paulownia trees |
比较毛泡桐健株健叶和病株健叶的蛋白质图谱(图 3-A和图 3-B)可以发现, 等电点和分子量分别为6.9、30KD; 6.0、20KD和6.7、29KD的蛋白质含量在病株健叶都比健株健叶中的含量低; pI 6.8、MW30KD的蛋白质在病株健叶中的含量比其健株健叶中的高。图 3-B和图 3-C的比较结果表明, 毛泡桐病株病叶中的蛋白质含量与其病株健叶中的相比发生了较大变化, 即pI 7.0~pI 7.1、MW46KD的一组蛋白质在其病株病叶中的含量明显高于其病株健叶中的含量。此外, 存在于图 3-B中的pI为6.8、MW为24KD的蛋白质多肽在图 3-C中观察不到。将图 3-C和图 3-A比较后也发现存在于毛泡桐健株健叶内的一种pI 6.8、MW24KD的蛋白多肽在病株病叶内消失了。

|
图 3 毛泡桐和白花泡桐叶片蛋白质聚丙烯酰胺凝胶双向电泳 Fig. 3 Two dimensional SDS-PAGE of proteins in different Paulownia tree leaves |
白花泡桐健株健叶的蛋白质凝胶图谱(图 3-D)与其病株健叶图谱(图 3-E)比较发现, 蛋白质的种类和含量有较大的差异。pI 6.4、MW46KD的蛋白质在健株健叶中的含量高于其在病株健叶中的含量。在图 3-E和图 3-F中, pI 6.5~7.0、MW24KD~30KD的蛋白多肽的种类和数量变化很大, 在病株健叶中存在的一种pI 6.8、MW24KD的蛋白多肽在其病株病叶中观察不到, 而其它四种蛋白质的含量在病株病叶中明显降低了。此外, 一种pI 6.5、MW45KD的蛋白多肽在白花泡桐病株病叶中的含量明显高于其病株健叶。比较白花泡桐病株病叶(图 3-F)和健株健叶(图 3-D)中的蛋白质可以发现, 虽说叶片内蛋白质的种类和含量有一定的差别, 但是最大的变化是在健株健叶和病株健叶中出现的pI 6.8、MW24KD蛋白多肽在病株病叶中消失了。
3 讨论植物的任何性状皆为基因所控制。基因首先转录为mRNA, mRNA再翻译为其对应的蛋白质, 反过来, 蛋白质又参与基因的表达和植物性状的调控(贺福初, 1999; 王志珍等, 1998)。即蛋白质与植物的性状表现密切相关。但是, mRNA由于自身存在贮存、转运、降解、翻译调控及产物的翻译后加工, 难以准确反映基因的最终产物、基因功能的真正执行体———蛋白质的质与量。基因与其编码产物蛋白的线性对应关系只存在于其新生肽链而不是其最终的功能蛋白中。近年的研究发现, 蛋白质间也存在类似于mRNA分子内的剪切、拼接, 并证明其基本元件“intein”广泛存在于多种蛋白质中(张文伟等, 2000)。此类过程的存在无疑进一步扩大了基因编码的蛋白质与其最终的功能蛋白间所存在的序列差距。而大量蛋白尤其是重要调控蛋白的化学修饰(如糖基化、磷酸化)、剪切加工(如酶原降解、结构域拼接)不但可以改变其空间结构, 而且是实施其功能与调节的重要结构基础。这些均不能从其基因编码序列中预测, 而只能通过对其最终的功能蛋白进行分析(万晶宏等, 1999)。也就是说, 基因虽然是遗传信息的源头, 但功能性蛋白才是基因功能的执行体。研究基因的功能固然为解释生命现象发生机理奠定坚实的基础, 但是它并不能提供认识各种生命活动直接的分子基础。因此, 要了解生物体的某一性状发生规律、生理生化过程的发生机理就必须研究生命活动的执行体—蛋白质。即研究与生物某一性状或过程特异相关蛋白质的位置、结构和功能对于揭示其发生机理及其人工调控具有重要的理论意义和经济意义。在本实验中, 毛泡桐和白花泡桐病株健叶和健株健叶中存在的分子量为24KD、pI 6.8的蛋白质(多肽)在其病叶中消失了, 这可能是导致丛枝病症状发生的原因之一。至于该种蛋白质结构、功能的阐明及其亚细胞位置的确定, 有待于进一步研究。
贺福初. 1999. 蛋白质组(proteome)研究———后基因组时代的生力军. 科学通报, 44(2): 113-123. DOI:10.3321/j.issn:0023-074X.1999.02.001 |
范国强, 蒋建平. 1997a. 泡桐丛枝病的发生与叶片蛋白质氨基酸变化关系的研究. 林业科学研究, 10(6): 570-573. |
范国强, 蒋建平. 1997b. 泡桐叶片蛋白质提取方法的研究. 植物学通报, 14(3): 61-64. |
金开璇, 田国忠. 1989. 组织化学技术快速检测泡桐丛枝病研究. 植物学报, 19(30): 185-189. |
巨关升, 王蕤. 1997. 泡桐丛枝病的抗性与维生素C关系的研究. 林业科学研究, 9: 431-434. |
林木兰, 杨继红. 1993. 泡桐丛枝病菌原体单克隆抗体的研制及初步应用. 植物学报, 35(9): 710-715. |
宋晓斌, 郑文锋. 1997. 类菌原体的侵入对泡桐组织和细胞的影响. 林业科学研究, 10(4): 429-434. DOI:10.3321/j.issn:1001-1498.1997.04.016 |
田国忠, 张锡津. 1999. 抗病和感病泡桐无性系组培苗对嫁接传染植原体的不同反应. 林业科学, 17(1): 47-45. |
万晶宏, 贺福初. 1999. 蛋白质组技术的研究进展. 科学通报, 44(9): 904-912. DOI:10.3321/j.issn:0023-074X.1999.09.002 |
王蕤, 孙秀琴, 王守宗, 等. 1981. 激素对泡桐丛枝病发生的影响. 林业科学, (3): 281-286. |
王志珍, 邹承鲁. 1998. 后基因组—蛋白质组研究. 生物化学与生物物理学报, 30(6): 533-539. |
袁巧平, 田国忠. 1994. 泡桐丛枝病MLO在寄主离体组织中的保存与增殖. 植物学报, 36(4): 115-120. |
张春立, 林木兰. 1996. 利用PCR方法检测泡桐丛枝病发生的MLO. 生物多样性, 2(增): 55-60. |
张春立, 林木兰, 胡学勤. 1994. 泡桐丛枝病类菌原体DNA的分子克隆与序列分析. 植物学报, 36(4): 278-282. DOI:10.3321/j.issn:1000-4025.1994.04.008 |
张文伟, 曹少先, 张文彪. 2000. 蛋白质的自剪接. 生命的化学, 20(1): 26-29. DOI:10.3969/j.issn.1000-1336.2000.01.009 |
朱澄, 金开璇. 1991. 用DAPI荧光显微术测泡桐丛枝病. 植物学报, 33(7): 495-498. |
Laemmli U K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227: 680-685. DOI:10.1038/227680a0 |
O'Farell H. 1975. Higher solution of two dimensional electrophoresis of proteins. J Biochem, 250: 4007-4021. |
 2003, Vol. 39
2003, Vol. 39
