文章信息
- 严东辉, 陈昌洁, Martin Shapiro.
- Yan Donghui, Chen Changjie, Martin Shapiro.
- 提高昆虫病毒杀虫效果的荧光增白剂的研究
- IMPROVING EFFICACY OF INSECT VIRUS TO CONTROL PEST BY OPTICAL BRIGHTENERS
- 林业科学, 2003, 39(1): 153-159.
- Scientia Silvae Sinicae, 2003, 39(1): 153-159.
-
文章历史
- 收稿日期:2001-08-29
-
作者相关文章
2. 美国农业部农业研究中心昆虫生物防治实验室 马里兰州 20705
2. Insect Biocontrol Laboratory, Beltsville Agriculture Research Center, USDA-ARS Beltsville MD 20705
昆虫病毒是持续控制农林害虫的有效生物作用物之一,但因其本身的宿主专一、毒力弱、致死速度慢、易受紫外光破坏以及必须活体增殖等不利特性,昆虫病毒的应用和发展受到制约。病毒制剂及应用技术方面的研究利用能改善昆虫病毒的这些特性,从而促进昆虫病毒的应用。目前已有近30种昆虫病毒制剂化后,在不同程度和规模上发挥着作用。荧光增白剂是主要用于涂料、纺织、洗涤、造纸和塑料等化工产品的助剂,它能吸收紫外光并转化为蓝色的可见光使产品显白(马得强,1998;Goulson et al., 2000; Shapiro, 1992),生物研究中,可用于细菌细胞壁染色(Darken, 1961)、昆虫病原病毒、线虫、真菌等紫外光保护剂(Inglis et al., 1995; Martignoni et al., 1985; Shapro, 1992; Nickle et al., 1992)。20世纪90年代初Shapiro等(1992)发现了荧光增白剂还具有显著增强昆虫病毒毒力的特性。后续研究表明,荧光增白剂能作为光保护剂和增强剂应用于昆虫病毒制剂中,显示出能较综合和有效地改善昆虫病毒的上述不利特性,是提高昆虫病毒防治害虫效果的有效助剂(Martines et al., 2000),明了其高度的增强机理可能为害虫防治提供新的理论。目前,这方面的研究集中在北美,国外其它区域和国内(彭建新等,2000)已开始关注这方面的研究。本文就国外对荧光增白剂的研究进展,结合我们的一些研究工作作一综述。
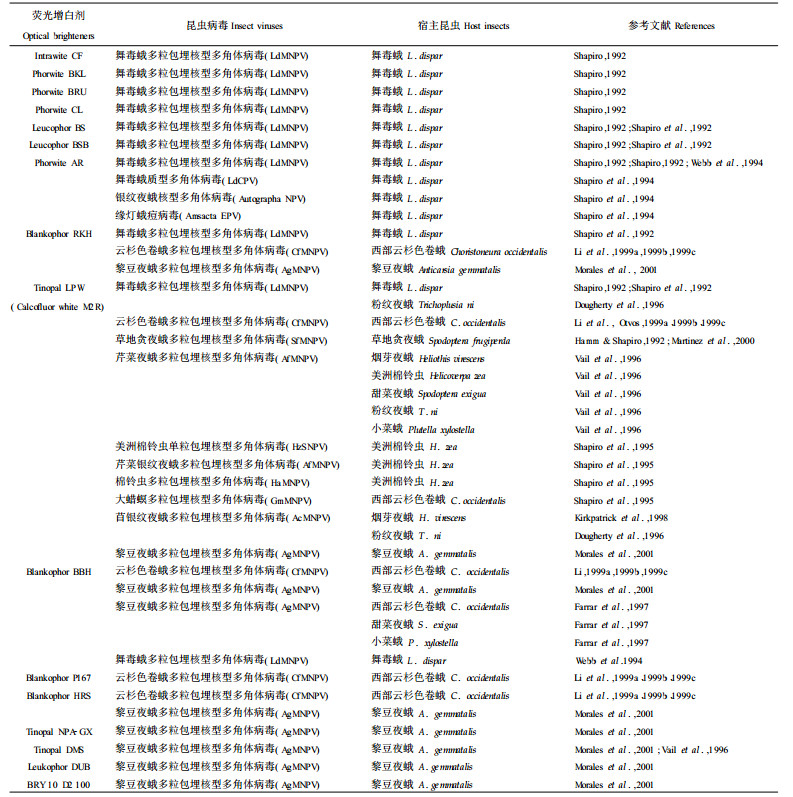
1 荧光增白剂的增强作用和机理 1.1 荧光增白剂增强表现1992年Shapiro等在研究应用荧光增白剂作为舞毒蛾(Lymantrii dispar)LdNPV紫外光保护剂时,发现加入荧光增白剂的处理能迅速致死宿主,推测荧光增白剂可能对舞毒蛾NPV有增强作用。用五种荧光增白剂Leucophor BS、Leucophor BSB、Phorwite AR、Phorwite RKH和Tinopal LPW进行验证(Shapiro et al., 1992),发现这些荧光增白剂能将LdNPV的LC50从8375 PIB·mL-1降到10~44 PIB·mL-1之间,约降低400~1 800倍;LT50在LdNPV各浓度上也均有明显的缩短。Tinopal LPW的加入使LdNPV LC90从89962 PIB·mL-1降至170 PIB·mL-1,约降低500多倍。此后的研究表明荧光增白剂对其它多种重要经济害虫的昆虫病毒有增强作用。Shapiro等对此项发现已申请了专利(U.S.patent No.5, 124, 149)。荧光增白剂对昆虫病毒的增强现象可能有一定的普遍性。现已知有不少荧光增白剂分别对一些昆虫病毒有增强作用(表 1)。研究集中在荧光增白剂Tinopal LPW对昆虫病毒的增强作用。Tinopal LPW是目前能增强昆虫病毒种类最多的荧光增白剂。被增强的病毒及其宿主,也主要集中在有重要经济意义的害虫病毒及其宿主上,如舞毒蛾NPV对美国的重要森林害虫舞毒蛾的感染。
|
|
不是所有的荧光增白剂都能增强昆虫病毒的毒力。比较起来有增强性能的荧光增白剂,更多的是没有增强作用的二苯乙烯类以外的荧光增白剂。Shapior等(1992)供试的23种荧光增白剂在对LdNPV试验中,仅8种表现有增强作用,其余15种增强作用弱或没有增强作用;Li等(1999a)供试的9种荧光增白剂中,有5种对云杉色卷蛾(C. fumiferana)NPV有增强作用。中国产的13种荧光增白剂仅有2种对LdNPV、棉铃虫NPV有增强作用(严东辉等,1999);巴西市场的11种荧光增白剂有4种对黎豆夜蛾(A. gemmatalis)AgMNPV有增强作用(Morales et al., 2001)。同一种荧光增白剂对不同的昆虫病毒的增强作用强度是不一致的,有的甚至对另一种昆虫病毒不表现增强作用。更进一步的荧光增白剂与增强作用关系见机理节。
不同荧光增白剂的浓度有不同的增强作用。1%浓度的荧光增白剂能发挥最佳的增强作用(Li et al., 1999b; Shapiro et al., 1992; Farrar et al., 1997),1%以下,增强作用随浓度递减而递减;大多数荧光增白剂在0.1%以下的浓度时增强作用消失。但个别荧光增白剂例外,如Tinopal LPW(Li et al., 1999b; Shapiro et al., 1992)在0.01%时仍有较强的增强效果。1%浓度以上时,荧光增白剂的增强作用也随之减弱以至消失(Li et al., 1999b),并逐渐表现出对昆虫的明显的取食抑制作用。但Morales等(2001)报道了4种荧光增白剂BlankophorRKH, Tinopal LPW, Blankophor BBH, Blankophor HRS在0.05%浓度下,对黎豆夜蛾AgMNPV感染黎豆夜蛾仍有明显的增强作用。
1.1.2 昆虫病毒和宿主互作与荧光增白剂的增强作用昆虫病毒和宿主互作体现在同源、异源病毒对宿主的感染死亡,以及不同种类昆虫病毒即NPV、CPV、GV等对宿主的作用。荧光增白剂能增强异源病毒感染宿主的毒力(Farrar et al., 1997; Kirkpatrick et al., 1998; Li et al., 1999a, 1999b, 1999c; Shapiro et al., 1994; Shapiro et al., 1995; Vail et al., 1996; Washburn et al., 1998),增强效果能达到同源病毒自然感染宿主的水平(Shapiro et al., 1995), HzSNPV感染美洲棉铃虫(H. zea)的LC50是130多角体(PIB)·杯-1饲料(杯容量为30 mL,饲料表面积1 338 mm2,每杯加处理液0.1 mL),异源病毒AcMNPV、HaMNPV、AfMNPV在Tinopal LPW的增强下感染美洲棉铃虫的LC50分别是150PIB·杯-1、190PIB·杯-1、160PIB·杯-1。但荧光增白剂的增强作用通常在同源病毒感染其宿主昆虫时表现最强1)。荧光增白剂对异源病毒的这种增强作用体现为扩大昆虫病毒的宿主域。正常情况下,AcNPV和缘灯蛾EPV不感染舞毒蛾,但在Phorwit AR增强下,它们能感染舞毒蛾并分别得到1.1×106 PIB·mL-1、6.9×105 PIB·mL-1的LC50(Shapiro et al., 1994)。另外,有些昆虫病在荧光增白剂的作用下能改变感染途径。舞毒蛾LdNPV的细胞外类型病毒口服不感染舞毒蛾,但在M2R的增强下,口服能发生感染,LC50为467PFU,而单独口服至107PFU仍无感染发生(Dougherty et al., 1994);目前只有荧光增白剂Tinopal LPW几乎对所有供试的昆虫NPV有增强作用,并在LdCPV、GV2)、松毛虫CPV病毒上也体现出良好的增强作用。
1),2) Shapiro, 美国马里兰州农业部农业研究中心昆虫生物防治实验室,2000
另外,林间单独使用荧光增白剂能诱发自然感染病毒的昆虫种群出现高死亡率(Webb et al., 1994)1),认为荧光增白剂可能能诱发昆虫病毒潜伏侵染。
病毒浓度愈低,荧光增白剂的增强作用表现愈强烈(Farrar et al., 1997)。病毒单独处理一些不出现LC50值的情况下,加入荧光增白剂可出现LC50(Shapiro et al., 1992; Li et al., 1999b)。荧光增白剂的增强作用在低龄幼虫上和有抗性的宿主中,表现也突出。0.1%的Tinopal LPW能将SfMNPV感染3日龄草地贪夜蛾(S. frugiperda)的LC50降低164~303 000倍;LC90也能下降64.9~7 630倍(Hamm et al., 1992)。TinopalUNPA-GX, Leucophor DUB(Morales et al., 2001)在抗性黎大豆夜蛾上,LC50分别降低62 000,10 000倍,而在普通黎大豆夜蛾系上,LC50降低分别为90,11.2倍。林间试验表明BBH能使Ld MNPV防治舞毒蛾的虫龄扩大到4龄(Webb et al., 1994; Thorpe et al., 1999)。
1.2 增强机理还不清楚荧光增白剂的增强昆虫病毒毒力的作用机理。目前从荧光增白剂化学结构和性能、与昆虫病毒的作用和宿主病生理角度进行了一些探索。
1.2.1 荧光增白剂结构性能和增强机理从化学结构上讲,荧光增白剂可分为萘酰亚胺类,吡唑啉类,香豆素类,杂环类以及二苯乙烯类等(马得强,1998;Argauer et al., 1997)。目前发现的对昆虫病毒有增强作用的荧光增白剂主要集中于二苯乙烯类中(Argauer et al., 1992; Goulson et al., 2000; Shapiro et al., 1997)。这一类荧光增白剂都是水溶性的,其中又多为双三嗪氨基二苯乙烯类,但这并不表明增强作用是以二苯乙烯结构为基础(Shapiro et al., 1997)的,因为供试的二苯乙烯类荧光增白剂中同样存在无增强效应的种类。Tinopal LPW又名荧光增白剂28或Calcofluor white M2R为Sigma公司产品,可用于细胞培养染色。因其纯度高并对多种昆虫病毒与昆虫作用体系表现有极其显著和稳定的增强作用,被视为研究荧光增白剂(二苯乙烯类)对昆虫病毒增强作用的标准样品2)。对Tinopal LPW的各组成基团成分如1,3,5-三嗪、二苯乙烯、磺酸及其各自的衍生物的增强作用生物测定表明,只有完整结构的荧光增白剂才有增强作用(Shapiro et al., 1997)。增强作用与荧光增白剂的荧光度有一定的联系(Argauer et al., 1997; Shapiro et al., 1997),显著的增强作用常与高荧光度的荧光增白剂相关,无增强作用的荧光增白剂一般都具有较低的荧光度。荧光增白剂本身的pH对增强作用没有影响(Argauer et al., 1997; Shapiro et al., 1995)。目前还很难从荧光增白剂本身的结构特点来探索增强机理。
1),2) Shapiro, 美国马里兰州农业部农业研究中心昆虫生物防治实验室,2000
1.2.2 与昆虫病毒的作用同样,从荧光增白剂与昆虫病毒二者之间的关系中也未得到增强机理的明确结论。研究认为荧光增白剂对昆虫病毒不发生直接作用(Dougherty et al., 1995; Adams et al., 1994),至少在体外是如此(Dougherty et al., 1995)。昆虫病毒的包涵体和病毒粒子的理化性质体外培养时都不会因荧光增白剂的存在而发生变化(Dougherty et al., 1995)。多角体从宿主释放时携带的碱性蛋白酶与荧光增白剂的增强作用无关(Dougherty et al., 1995)。增强作用的发生以昆虫病毒与荧光增白剂进入昆虫中肠为前提(Sheppard et al., 1994; Dougherty et al., 1995),并且感染较单独病毒感染的发生时间提前;感染一旦发生,幼虫的发育生长就受到阻碍(Sheppard et al., 1994)。其原因被认为是由于荧光增白剂可干扰纤维素和原纤维性几丁质的代谢,而昆虫中肠的围食膜由原纤维性几丁质组成,因而改变了围食膜结构,使病毒能迅速进入并通过围食膜,进入血腔感染敏感组织,加快感染发生进程(Sheppard et al., 1994)。试验结果表明:细胞培养体系中的研究结果与在自然宿主中的结果基本一致,同时认为增强作用不是昆虫病毒吸收的增加引起的。而从加快宿主死亡速度来推断,荧光增白剂能快速增加昆虫病毒的数量(Washburn et al., 1998)。
1.2.3 宿主pH生理从生理上看,增强作用与昆虫中肠异常pH生理相关。LdMNPV和Tinopal LPW进入中肠后,昆虫中肠pH从正常的碱性降到近中性,这一生理干扰是不可逆的(Sheppard et al., 1994a, 1994b)。中肠的pH生理的这种变化在LdCPV和Tinopal LPW的组合(Sheppard et al., 1994a)中也同样得到反映。荧光增白剂和昆虫病毒的作用可能破坏中肠杯状细胞与柱状细胞之间的电耦合作用(Sheppard et al., 1994a),影响K+离子在两种细胞中的流通。杯状细胞中的K+离子泵在维持和调节中肠pH上是起着关键性作用的(Sheppard et al., 1994a)。但并不清楚中肠pH的这种异常变化与增强作用的因果关系(Sheppard et al., 1994a;1994b),而pH的变化肯定是幼虫受到病毒和荧光增白剂的作用后,生长发育受到阻碍的原因(Sheppard et al., 1994b)。
荧光增白剂可能干涉或改变昆虫中肠的其它生理或生化合成过程。因为Tinopal LPW能降低烟芽夜蛾(H. virescens)5龄幼虫对AcMNPV的发育抗体(Kirkpatrick et al., 1998),使老龄幼虫也能被昆虫病毒大量感染致病死亡。
2 紫外光保护作用荧光增白剂能吸收紫外光发射出可见光。这种特性提供了昆虫病毒的紫外光保护作用。首次将荧光增白剂Tinopal DCS应用于NPV的紫外光保护作用研究的是Martignoni等(1985),并在5%浓度时获得满意的效果。1992年Shapiro集中研究了23种荧光增白剂对NPV的紫外光保护作用,有17种荧光增白剂提供昆虫病毒大于70%原始活力保护。其中8种荧光增白剂可提供100%的光保护。荧光增白剂的光保护效果随浓度不同而有变化。从目前来看,一般1%浓度下能达到最大的保护效应。浓度下降,保护作用也相应减弱。但Tinopal LPW和Phorwite AR在1/105的浓度下仍能有14%的活力保护。
有报道荧光增白剂还可作为昆虫病原线虫(Nickle et al., 1992)和真菌(Inglis et al., 1995)辐射保护剂。
由于荧光增白剂的高效紫外光保护作用,使人们容易将荧光增白剂对昆虫病毒毒力的增强作用与之混淆。Dougherty等(1996)则明确了二者是荧光增白剂提供的两种不同特性,1%的荧光增白剂28对LdMNPV的增强作用是其紫外光保护作用的15倍。
3 荧光增白剂的应用及存在问题荧光增白剂既起到高效光保护作用,又能显著提高昆虫病毒毒力,林间试验效果也稳定,可以作为研制高效昆虫病毒制剂的良好助剂(Martinez et al., 2000), 现在美国已有几家生物农药公司考虑将荧光增白剂应用到昆虫病毒制剂中。
林间地面防治试验时,1%Phorwite AR替代原光保护剂Orzan后,将舞毒蛾幼虫死亡率提高9%~13%,林间幼虫死亡率达97%~98%,致死中时间缩短至3.5 d,林间防治效果提高10倍(Webb et al., 1994)。试验Blankophor BBH飞防和地面增强LdNPV防治舞毒蛾,也显示了同样的增强结果(Cunningham et al., 1997; Webb et al., 1994)。单独使用荧光增白剂能使自然感染病毒的昆虫种群增加(Webb et al., 1994)1)。也许当自然条件下存在高浓度病毒时,单独使用荧光增白剂能将害虫种群控制在灾害水平之下。荧光增白剂本身结构、性能稳定。研究表明Tinopal LPW在pH 3.0到10.4;温度121℃,7 h;254℃,3 h;360 nmUV照射下,其增强作用和光保护作用不被破坏(Shapiro et al., 1995)。林间,Blankophoe BBH荧光度5个月(5月至10月)后才开始下降,荧光增白剂还能将林间害虫的防治期延长(Webb et al., 1994)。这些特点使荧光增白剂应用时的增强作用能保持稳定。另外,荧光增白剂能提高病毒的产量和对高龄害虫的感染(Shapiro et al., 1992),因此,可以在病毒生产和林间高虫龄害虫上应用。
1) Shapiro, 美国马里兰州农业部农业研究中心昆虫生物防治实验室,2000
荧光增白剂对人、畜无毒、安全,可被生物和自然降解(马得强,1998),可以作为环保性的昆虫病毒助剂。但是,在荧光增白剂用作病毒制剂的常用助剂被推广应用之前,还有很多的研究工作和问题需要考虑。荧光增白剂对生态系统中生物多样性及生物互作之间的影响是必须考虑的。Goulson等(2000)认为,荧光增白剂在生物农药中的利用可能影响花对传粉昆虫的吸引和传粉昆虫对方向的定位。另外,实际应用时建议考虑施用对象。蔬菜、果树上慎用。提倡在花卉、园林、尤其是森林害虫的病毒制剂上推广应用。再者必须考虑制剂成本问题。这在荧光增白剂种类和浓度上可有所选择。目前1%的浓度在价格和使用上都存在一定的问题。1%荧光增白剂的应用浓度可能使防治成本上升。但随着低容量和超低容量喷洒技术的应用,荧光增白剂实际用量可大幅度地减少。另外荧光增白剂的种类之间的价格差异很大,其增强效益各异。因此,针对不同的昆虫病毒和防治对象应选用最有效和经济的荧光增白剂作助剂。
马得强.荧光增白剂.见: 化工百科全书编委会.化工百科全书.第18卷.第1版.北京: 化学工业出版社, 1998: 1 047~1 062
|
严东辉, 王玉珠, 赵同海等.OB类物质对昆虫病毒增效的初步研究.见: 陈昌洁等.中国主要森林病虫害防治研究进展.第1版.北京: 中国林业出版社, 1999: 134~139
|
彭建新, 杨红, 洪华珠. 2000. 促进杆状病毒感染的增效因子. 中国生物防治, 16(2): 87-91. |
Adams J K, Sheppard C A, Shapiro M, et al. 1994. Light and electron microscopic investigation on the histopathology of the midgut of gypsy moth larvae infected with LdMNPV plus a fluorescent brightener. Journal of Invertebrate Pathology, 64: 156-159. DOI:10.1006/jipa.1994.1089 |
Argauer R, Shapiro M. 1997. Fluorescence and relative activities of stilbene optical brighteners as enhancers for the gypsy moth(Lepidoptera:Lymantriidae)Baculovirus. J Econ Entomol, 90(2): 416-420. DOI:10.1093/jee/90.2.416 |
Cunningham J C, Brown K W, Payne N J, et al. 1997. Aerial Spray Trials in 1992 and 1993 against gypsy moth Lymantria dispar(Lepidopera:Lymantriidae), using nuclear polyhedrosis. Crop Protection, 16(1): 15-33. DOI:10.1016/S0261-2194(96)00057-9 |
Darken M A. 1961. Application of fluorescent brighteners in biological techniques. Science, 133: 1 704-1 705. DOI:10.1126/science.133.3465.1704 |
Dougherty E M, Guthrie K, Shapiro M. 1995. In vitro effects of fluoresecent brightener on the efficacy of occlusion body dissolution and polyhedral-derived virions. Biological Control, 5: 383-388. DOI:10.1006/bcon.1995.1045 |
Dougherty E M, Guthrie K P, Shapiro M. 1996. Optical brighteners provide baculovirus activity enhancement and UV radiation protection. Biological Control, 7: 71-74. DOI:10.1006/bcon.1996.0067 |
Farrar Jr., Robert R, Ridgway R L. 1997. The celery looper (Lepidoptera:Noctuidae)baculovirus:potency and enhancement by blankophor BBH against 3 lepidopteran species. Envion Entomol, 26(6): 1 461-1 469. DOI:10.1093/ee/26.6.1461 |
Goulson D, Martinez A M, Hughes W O H, et al. 2000. Effects of optical brighteners used in biopesticide formulations on the behavior of pollinators. Biological Control, 19: 232-236. DOI:10.1006/bcon.2000.0861 |
Hamm J J, Shapiro M. 1992. Infectivity of fall armyworm (Lepidopera:Noctuidae)nuclear polyhedrosis virus enhanced by a fluorescent brightener. J Econ Ectomol, 85(6): 2 149-2 152. DOI:10.1093/jee/85.6.2149 |
Kirkpatrick B A, Washburn J O, Volkman L E. 1998. AcMNPV pathogenesis and developmental resistance in fifth instar heliothis virescens. Journal of Invertebrate Pathology, 72: 63-72. DOI:10.1006/jipa.1997.4752 |
Inglis G D, Goettel M S, Johnson D L. 1995. Influence of ultraviolet light protectants on persistence of the entomopathogenic fungus, Beauveria bassiana. Biological Control, 5(4): 581-590. DOI:10.1006/bcon.1995.1069 |
Li Sy, Otvos I S. 1999a. Optical brighteners enhance activity of a nuclear polyhedrosis virus against western spruce budworm(Lepidoptera:Tortricidae). J Econ Entomol, 92(2): 335-339. DOI:10.1093/jee/92.2.335 |
Li Sy, Otvos I S. 1999b. Comparison of the activity enhancement of a Baculovirus by optical brighteners against laboratory and field strains of Choristoneura occidentalis(Lepidoptera:Tortricidae). J Econ Entomol, 92(3): 534-538. DOI:10.1093/jee/92.3.534 |
Li Sy, Otvos I S. 1999b. Differential mortality between male and female Choristoneura occidentalis(Lepidoptera:Tortricidae)larvae exposed to a baculovirus with or without optical brighteners. The Canadian Entomologist, 131: 65-70. DOI:10.4039/Ent13165-1 |
Martignoni M E, Iwai P.J. 1985. Laboratory evaluation of new ultraviolet absorbers for protection of douglas-far tussock moth(Lepidoptera:Lymantriidae)baculovirus. J Econ Entomol, 78: 982-987. DOI:10.1093/jee/78.4.982 |
Martinez A M, Goulson D, Chapman J W, et al. 2000. Is it feasible to use optical brightener technology with a baculovirus bioinsecticide for resource-poor maixe farmers in mesoamerica?. Biological Control, 17: 174-181. DOI:10.1006/bcon.1999.0786 |
Morales L, Moscardi F, Sosa-Gomez D R, et al. 2001. Fluorescent brighteners improve anticarsia gemmatalis(Lepidoptera:Noctuidae)nucleopolyhedrovirus(AgMNPV)Activity on AgMNPV-Susceptible and resistant strains of the Insect. Biological Control, 20: 247-253. DOI:10.1006/bcon.2000.0904 |
Nickle W R, Shapiro M. 1992. Use of a stilbene brightener, tinopal LPW, as a radiation protectant for Steinernema carpocapsae. Journal of Nematology, 24(3): 371-373. |
Shapiro M. 1992. Use of optical brighteners as radiation protectants for gypsy moth(Lepidoptera:Lymantriidae)nuclear polyhedrosis virus. J Econ Entomol, 85(5): 1 682-1 686. DOI:10.1093/jee/85.5.1682 |
Shapiro M, Argauer R. 1995. Effects of pH, temperature, and ultraviolet radiation on the activity of an optical brightener as a Viral enhancer for the gypsy moth (Lepidoptera:Lymantriidae)baculovirus. J Econ Entomol, 88(6): 1 602-1 606. DOI:10.1093/jee/88.6.1602 |
Shapiro M, Argauer R. 1997. Components of the stilbene optical brightener tinopal LPW as enhancers for the gypsy moth(Lepidoptera:Lymantriidae)baculovirus. J Econ Entomol, 90(4): 899-904. DOI:10.1093/jee/90.4.899 |
Shapiro M, Dougherty E M. 1994. Enhancement in activity of homologous and heterologous viruses against the gypsy moth(Lepidoptera:Lymantriidae)by an optical brightener. J Econ Entomol, 87(2): 361-365. DOI:10.1093/jee/87.2.361 |
Shapiro M, Robertson J L. 1992. Enhancement of gypsy moth(Lepidotera:Lymantriidae)baculovirus activity by optical brightener. J Econ Entomol, 85(4): 1 120-1 124. DOI:10.1093/jee/85.4.1120 |
Shapiro M, Vaughn J L. 1995. Enhancement in activity of homologous and heterologous baculovirus infectious to cotton bollworm(Lepidoptera:Noctuidae)by an optical brightener. J Econ Entomol, 88(2): 215-269. |
Sheppard C A, Shapiro M. 1994a. Physiological and nutritional effects of a fluorescent brightener nuclear polyhedrosis virus-infected Lymantria dispar(L.)larvae (Lepidoptera:Lymantriidae). Biological Control, 4: 404-411. DOI:10.1006/bcon.1994.1051 |
Sheppard C A, Shapiro M, Vaughn J L. 1994b. Reduction of midgut luminal pH in gypsy moth larvae(Lymantria dispar L.)following ingestion of nuclear or cytoplasmic polyhedrosis virus/fluorescent brightener on natural and artificial Diets. Biological Control, 4: 412-420. DOI:10.1006/bcon.1994.1052 |
Thorpe K W, Cook S P, Webb R E, et al. 1999. Aerial application of the viral enhancer Blankophor BBH with reduced rates of gypsy moth(Lepidoptera:Lymantriidae)nucleopolyhedrovirus. Biological Control, 16(2): 209-216. DOI:10.1006/bcon.1999.0758 |
Vail P V, Hoffmann D F, Tebbets J S. 1996. Effects of a fluorescent brightener on the activity of anagrapha falcifera(Lepidoptera:Noctuidae)nuclear polyhedrosis virus to four Noctuid pests. Biological Control, 7: 121-125. DOI:10.1006/bcon.1996.0074 |
Washburn J O, Kirkpatrick B A, Stapleton E H. Evidence that the Stilbene~derived optical brightener M2R enhances Autographa californica M, et al.nucleopolyhedrovirus infection of Trichoplusia ni and Heliothis virescens by preventing sloughing of infected midgut epithelial cells.Biological Control, 1998, 11(1): 58~69
|
Webb R E, Shapiro M, Podgwaite J D, et al. 1994. Effect of optical brighteners on the efficacy of gypsy moth(Lepidoptera:Lymantriidae)nuclear polyhedrosis virus in forest plots with high or low levels of natural virus. J Econ Entomol, 87(1): 134-143. DOI:10.1093/jee/87.1.134 |
 2003, Vol. 39
2003, Vol. 39