文章信息
- 傅大立, 李芳东, 赵天榜, 靳三恒, 高俊红.
- Fu Dali, Li Fangdong, Zhao Tianbang, Jin Sanheng, Gao Junhong.
- 玉兰属5树种生理指标的对比研究
- COMPARISON ON THE PHYSIOLOGICAL PARAMETERS OF FIVE YULANIA SPECIES
- 林业科学, 2003, 39(1): 44-49.
- Scientia Silvae Sinicae, 2003, 39(1): 44-49.
-
文章历史
- 收稿日期:2001-09-24
-
作者相关文章
2. 河南农业大学 郑州 450002;
3. 河南省南召县林业局 南召 474650;
4. 郑州市二七区农业经济委员会 郑州 450000
2. Henan Agricultural University Zhengzhou 450002;
3. Nanzhan Forest Bureau, Henan Province Nanzhao 474650;
4. Zhengzhou Erqi Agricultural Economic Council Zhengzhou 450000
木兰科(Magnoliaceae)玉兰属(Yulania Spach)植物是重要的绿化、园林美化、传统中药材、香精原料树种,在速生用材林、经济林、城乡风景林、水土保持林的栽培中占有重要地位。玉兰属植物花蕾入药,统称辛夷,是我国传统的中药材与出口物质,因此,玉兰属植物又统称为辛夷植物。我国是玉兰属植物的分布、起源与多样性中心,已有2 000多a的栽培与药用历史。玉兰属树种光合与水分生理是辛夷高产栽培的生理基础,在对辛夷植物的资源分类与新品种选育研究基础上(傅大立, 1999a; 1999b; 2000a; 2000b; 2001),本文对玉兰属5树种的光合作用、水分生理作了初步研究,以便为辛夷高产优质栽培模式提供理论依据。
1 材料与方法 1.1 试验材料与试验地概况参试玉兰属5树种,分别是:望春玉兰[Y. biondii (Pamp.) D. L. Fu]、紫玉兰[ Y. liliiflora (Desr.) D. L. Fu]、玉兰[Y. denudata(Desr.) D. L. Fu]、腋花玉兰[Y. axilliflora (T. B. Zhao et al.) D. L. Fu]和舞钢玉兰[Y. wu gangensis (T. B. Zhao et al.) D. L. Fu]。试验地设在河南鲁山县林场,地理坐标N33°44′, E112°46′,海拔高120 m,年平均气温14.8℃,年平均降水量950 mm。沿岸滩地,土壤肥力、保水力差,灌溉条件好。造林密度3 m×4 m,树龄12 a。
1.2 试验研究与分析方法采用美国Li-Cor公司生产的Li-6400光合作用分析系统测定。具体方法是:在田间条件下,每日8:30~11:30,在气温15~28℃,空气相对湿度40%~85%条件下,对玉兰属5树种的单叶光合速率(Pn)、蒸腾速率(TR)、胞内CO2浓度(Ci)等进行活体测定,同时记录光合有效辐射(PAR)、空气温度(Ta)、叶面温度(Tl)、空气CO2浓度(Ca)、空气相对湿度(RH)、叶面相对湿度(Hs)、Ball-Berry指数(BB)等生理或生态因子指标。
光合作用强弱通常用叶面净光合速率(Pn)来表示,光合速率与其所吸收的光量子通量的关系可以用以下公式表达(李芳东等, 1998;Thornley, 1976):
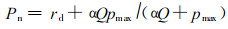
|
(1) |
式中,Pn为叶面净光合速率(μmol·m-2s-1),rd为叶片白天的呼吸速率(μmol·m-2s-1),α为光量子效率(mol CO2·mol-1 quanta),Q为叶面吸收的光合有效辐射(μmol quanta·m-2s-1),pmax 为叶片的最大光合速率(μmol·m-2s-1)。
光量子效率随空气中CO2的浓度与叶片温度的变化而变化(Ehleringer, 1981),从光合作用的生物化学模拟可以导出(Von Caemmerer, 1981; McMurtrie, 1993):

|
(2) |
式中,αe为电子传递的光量需求量,是一个常数,为0.385 (McMurtrie, 1993),Ca为空气中CO2浓度(μmol·mol-1),Γ*为白天呼吸速率为零时光合速率的CO2补偿点(μmol·mol-1),Γ*与叶温(Tl)的关系可以用公式计算(Brooks, 1985):
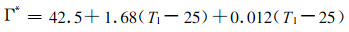
|
(3) |
式中,Tl的单位是℃。当叶温为15~25℃时,α值可用0.06近似计算(李芳东等,1998)。
水分蒸腾对植物表面能量平衡的调节有很重要的作用(Monteith, 1965)。由于水分是植物体内化学反应、物质转换与输送的媒体,水分过度的丧失会导致植物生长发育受到阻碍(Slatyer, 1967; Kozlowski, 1974)。但伴随植物的气孔张开与二氧化碳向植物叶片内的扩散,水分蒸腾也是不可避免,即水分蒸腾与光合作用紧密相关(Wong, 1979)。国内外近20 a的研究结果,证明了蒸腾速率与光合速率的紧密相关性,且光合速率与蒸腾速率的比值(或水分利用效率)在1 d内的变化可用气孔控制最优化理论进行描述(Bierhuizen, 1965; Cowan, 1977a; Tanner, 1981)。水分利用效率是植物物质生产和水分消耗之间关系的重要综合指标,这一指标在部分植物上有了比较深入的研究,从群体、植株和单叶等不同层次上进行了表达(周国逸, 1997; Tyree, 1982; Meidner, 1976; Meyer, 1981; Whitehead, 1981; Wang, 1977)。在整个生长期内,作物的水分利用效率都比较稳定(Cowan, 1977b)。本文玉兰属树种的水分利用效率(WUE)也采用光合速率(Pn)与蒸腾速率(TR)的比值来计算。
2 结果与分析 2.1 不同树种叶片光量子光合反应曲线的差异叶片光量子光合反应曲线,是植物光合能力与模型的重要基础,对玉兰属5树种的光量子光合反应曲线进行测定,并用公式(1)进行拟合,其结果如图 1。

|
图 1 玉兰属5树种单叶光量子光合反应曲线 Fig. 1 Photosynthetic PAR response of the leaves of five Yulania species ①舞钢玉兰Y. wugangensis; ②玉兰Y. denudata; ③腋花玉兰Y. axilliflora; ④望春玉兰Y. biondii; ⑤紫玉兰Y. liliiflora. |
图 1为玉兰属5种树种在气温、空气相对湿度、CO2等条件相对稳定的情况下的单叶光量子光合反应曲线,即不同光照条件下单叶的净光合速率。从图 1中可以看出,5种树种的光量子光合反应曲线较为相似,均可用方程(1)拟合。光通量是影响叶片光合作用的最主要因子,随着光通量的增加,光合速率逐渐增加,但当光通量增加到一定程度时,光合速率不再显著增加。玉兰属5树种的饱和光合有效辐射(PAR)约为1 000 μmol·m-2s-1,当PAR大于该值时,光合速率随PAR的变化不显著,光饱和现象较为明显。5树种的光补偿点也较为相似,为7.0~12.5 μmol·m-2s-1,平均为10.0 μm ol·m-2s-1。5树种的光呼吸(rd)的变化也较小,平均为2.1 μmol·m -2s-1。
叶片光量子光合反应曲线决定于3个参数:α、pmax以及rd,其中α为常数(0.06)或变化极小,rd占叶片净光合速率较小,且变化不明显,不同时期光量子光合反应曲线的变化主要起因于 pmax的变化。图 1也反映5树种光量子光合曲线的差异主要体现在最大光合速率pmax的差异上。
图 2为玉兰属5树种光合反应曲线参数(pmax),从图 2可以看出,望春玉兰、紫玉兰的光合参数pmax的值较小,分别为8.2和8.0 μmol·m-2s-1,腋花玉兰为11.0 μmol·m-2s-1,玉兰为14.4 μmol·m-2s-1,舞钢玉兰的光合参数pmax的值最大,为15.3 μmol·m-2s-1,这主要是由不同树种叶片中光合酶(RuBP)活性的差异而决定的。

|
图 2 玉兰属5树种叶片光合反应曲线参数 Fig. 2 Maximum leaf photosynthetic rates of five Yulania species |
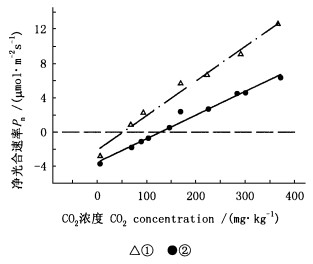
据测定,望春玉兰、腋花玉兰、紫玉兰、玉兰、舞钢玉兰5种树种在光照、气温和空气相对湿度等条件相对稳定的情况下,不同CO2浓度单叶的光合反应曲线为直线。图 3显示了望春玉兰和舞钢玉兰2树种的CO2光合反应曲线。二氧化碳供应速度对光合速率的快慢有着重要的影响,二氧化碳浓度与其供应速度呈正相关。二氧化碳供应速度的快慢还取决于气孔传导率(Jones, 1973; Farquar, 1982)。气孔传导率又受许多因子的影响(Jarvis, 1976; Leuning, 1990),目前尚未有一个比较完整的气孔传导率的基本模型。自然条件下,玉兰属5树种二氧化碳浓度与光合速率呈正比,因此,辛夷植物栽培时,适宜密度,保持林内的通风条件,对辛夷的高产有重要作用。
|
图 3 望春玉兰和舞钢玉兰单叶CO2光合反应曲线 Fig. 3 Leaf photosynthetic CO2 response of Y. biondii and Y. wugangensis. ①舞钢玉兰Y. wugangensis; ②望春玉兰Y. biondii. |
5树种单叶光合的CO2补偿点为50~130 μmol·mol-1,其中,望春玉兰、腋花玉兰、紫玉兰、玉兰、舞钢玉兰分别为127、106、62、52、51μmol ·mol-1。从CO2补偿点上来看,紫玉兰与玉兰、舞钢玉兰相似,这可能与树种特性有关。
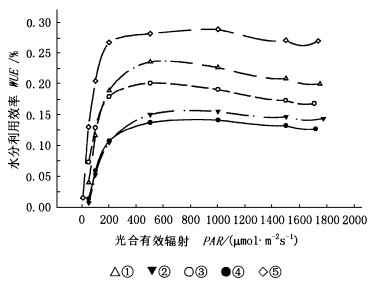
2.3 不同树种叶片光量子水分利用效率反应曲线植物的蒸腾速率除受土壤水分的影响(李芳东等, 1998b; Cowan, 1965; Federer, 1982; Ritchie, 1973)外,还受光合有效辐射强弱的影响,通常随光照的增强而增强(Tanner, 1976; Javis, 1985)。图 4为望春玉兰、腋花玉兰、紫玉兰、玉兰、舞钢玉兰5种树种在气温、空气相对湿度、CO2浓度等条件相对稳定的情况下,不同光照条件下单叶的水分利用效率的变化。从图 4可以看出,5种树种的光量子水分利用效率反应曲线与光量子光合反应曲线的变化趋势较为相似,因为水分利用效率与光合速率直接相关,由于增加了水分蒸腾这一因素,使种间的差异更为明显。当光通量大于光补偿点后,随着光通量的增加,WUE也快速增加,当PAR达到光饱和点(约1 000 μmol·m-2s-1)或近光饱和点时,WUE达到最大值,随着光照的继续增强,WUE反而有所下降或基本呈一较稳定的状态,说明玉兰属5树种的蒸腾作用与光合作用对光的反应有所差异。
|
图 4 玉兰属5树种单叶水分利用效率 Fig. 4 Leaf WUE of five Yulania species ①舞钢玉兰Y. wugangensis; ②玉兰Y. denudata; ③腋花玉兰Y. axilliflora; ④望春玉兰Y. biondii; ⑤紫玉兰Y. liliiflora. |
图 4还表明,玉兰属5树种叶片水分利用效率的种间差异较大,主要表现在紫玉兰的WUE最大,为其它种的1.2~2.0倍。单叶最大水分利用效率紫玉兰为0.29% (mol CO2·mol-1H2O),舞钢玉兰为0.24%,腋花玉兰为0.20%,玉兰为0.16%,望春玉兰为0.1 4%。
紫玉兰与望春玉兰的最大光合速率相近,但WUE却差别最大,相差达2.0倍,这从另一方面反映出两树种间的差异。望春玉兰是辛夷的主要原植物,其最大光合速率和水分利用效率均较小,而CO2补偿点又最高,因此,望春玉兰栽培时,要选择水分条件或灌溉条件较好的地方,以提供充足的水分供应,同时,要注意密度不能过大,保持林内通风透光,这样有利于望春玉兰叶片的光合作用,提高辛夷产量。
2.4 树冠部位、叶龄对舞钢玉兰生理指标的影响图 5为在气温、空气相对湿度、光照(1 000 μmol·m-2s-1)等相对稳定条件下,舞钢玉兰树冠不同部位、枝条上不同叶片(叶龄不同)的光合速率与水分利用效率,顶叶(叶1)因尚未完全展开,未作测定。可以看出,光合速率随采叶树冠部位、叶龄的变化较为明显,最大值为16.3 μmol·m-2s-1,最小值为8.6 μmol·m-2s-1,最大值与最小值相差近1倍,近冠顶叶片的光合速率通常大于近冠基的叶片;叶龄对叶片光合速率也有较大的影响,当叶片完全展开后,即可达较大的光合速率,并能保持一段时间,随着叶龄的继续增加,其光合能力有逐渐下降的趋势。
舞钢玉兰叶片水分利用效率随着树冠部位、叶龄的变化相对较小,其水分利用效率最大值为0.159%,而最小值为0.131%,相差仅20%,这说明,水分利用效率是一个较为稳定的指标,其受叶龄、枝条部位、树冠部位等的影响不大。
从图 5还可以算出,树冠顶部的枝端叶片与树冠基部的枝端叶片,因叶龄较小,冠顶与冠基的光合速率差异较大(叶2、3、4),但随着叶龄的增大,树冠顶部与基部的叶片光合速率趋于一致(叶5、6、7、8、9)。
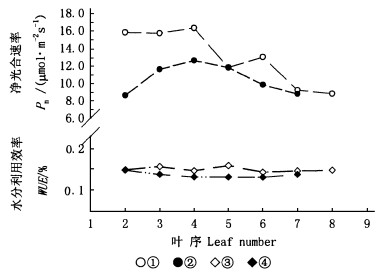
|
图 5 舞钢玉兰树冠顶部与基部单叶光合速率及水分利用效率 Fig. 5 Leaf photosynthetic rate and WUE of the leaves near the top or the base of Y. wugangensis tree crown ①冠顶叶片光合速率Pn of leaves of crown top; ②冠基叶片光合速率Pn of leaves of crown base; ③冠顶叶片水分利用效率WUE of leaves of crown top; ④冠基叶片水分利用效率WUE of leaves of crown base. |
玉兰属5树种的光量子光合反应曲线较为相似,光补偿点约为10.0 μmol·m-2s-1,饱和光合有效辐射约为1 000 μmol·m-2s-1,光呼吸的变化也较小,平均为2.1 μmol·m-2s-1。5树种光量子光合曲线的差异主要体现在最大光合速率pmax的差异上。望春玉兰、紫玉兰的pmax的值较小,分别为8.2和8.0 μmol·m-2s-1,腋花玉兰为11.0 μmol·m-2s-1,玉兰为14.4 μmol·m-2s-1,舞钢玉兰pmax的值最大,为15.3 μmol ·m-2s-1,这主要是由不同树种叶片中光合酶活性(RuBP)的差异而决定的。
在自然条件下,5树种的二氧化碳光合反应曲线为直线。5树种的CO2补偿点在50~ 130 μmol·mol-1间,望春玉兰和腋花玉兰的CO2补偿点较高,分别是127和106 μ mol·mol-1;紫玉兰、玉兰、舞钢玉兰的CO2补偿点较低,分别为62、52和51 μ mol·mol-1。这种差异可能与树种的光合特性有关。望春玉兰栽培时,适宜密度,保持林内的通风条件,对辛夷的高产有重要作用。
5树种叶片的光量子水分利用效率反应曲线变化趋势也较为相似,但5树种叶片最大水分利用效率的种间差异较大,主要表现在紫玉兰的WUE最大,为0.29% (mol CO2·mol-1H2O),是其它种的1.2~2.0倍,舞钢玉兰为0.24%,腋花玉兰为0.20%,玉兰为0.16%,望春玉兰为0.14%。紫玉兰与望春玉兰的最大光合速率相近,但WUE却差别最大,相差达2.0倍,这从另一方面反映出了两种间的差异。
光合速率则随叶片所处的树冠部位、叶龄的变化而明显变化,近冠顶叶片的光合速率通常大于近冠基的叶片;当叶片完全展开后,其光合速率通常即可达较大的光合速率,并能保持一段时间,随着叶龄的继续增加,其光合能力有逐渐下降的趋势。水分利用效率是一个较为稳定的指标,随叶龄、枝条部位、树冠部位等的变化不大,是一个较为稳定可靠的生理指标。
望春玉兰是辛夷植物中栽培最广、药用质量最好的树种,其花蕾也被作为辛夷正品之一。望春玉兰最大光合速率和水分利用效率均较小,而CO2补偿点又最高,因此,丰产栽培时,要选择水分条件或灌溉条件较好的地方,以提供充足的水分供应,同时,要注意适当疏植,保持林内通风透光,这样可有利于望春玉兰的光合作用,提高辛夷产量。
傅大立, 赵东方, 高超, 等. 1999a. 辛夷选择指标与选择指数的研究. 林业科学研究, 12(4): 350-356. |
傅大立, 赵天榜, 孙卫邦, 等. 1999b. 关于木兰属玉兰亚属分组问题的探讨. 中南林学院学报, 19(2): 6-11. |
傅大立. 2000a. 河南木兰属一新栽培变种. 经济林研究, 18(2): 46-47. |
傅大立. 2000b. 辛夷植物研究进展. 经济林研究, 18(3): 61-64. |
傅大立. 2001. 玉兰属的研究. 武汉植物学研究, 19(3): 191-198. DOI:10.3969/j.issn.2095-0837.2001.03.004 |
李芳东, 傅大立, 王保平. 1998a. 桐麦间作系统小麦群体光合量及其与产量的关系. 北京林业大学学报, 20(3): 108-115. |
李芳东, 王保平, 傅大立. 1998b. 桐麦间作系统小麦蒸腾速率和水分利用效率变化的研究. 北京林业大学学报, 20(3): 115-121. |
周国逸. 1997. 生态系统水热原理及其应用. 北京: 气象出版社.
|
Bierhuizen J F, Slatyer R O. 1965. Effect of atmospheric concentration of water vapour and CO2 in determining transpiration-photosynthesis relationships of cotton leaves. Agricultural Meteorology, 2: 259-270. DOI:10.1016/0002-1571(65)90012-9 |
Brooks A, Farquhar G D. 1985. Effects of temperature on the CO2/O2 specificity of ribulose -1, 5-bisphosphate carboxglase/ oxygenase and the rate of respiration in light. Planta, 165: 397-406. DOI:10.1007/BF00392238 |
Cowan I R. 1965. Transport of water in the soil-plant-atmosphere system. Journal of Applied Ecology, 2: 221-239. DOI:10.2307/2401706 |
Cowan I R, Farquhar G D. 1977a. Stomatal function in relation to leaf metabolism and environment. Symposium of the Society for Experimental Biology, 31: 471-505. |
Cowan I R. 1977b. Stomatal behavior and environment. Advances in Botanic Research, 4: 117-228. |
Ehleringer J, Bj rkman O. 1977. Quantum yields for CO2 uptake in C3 and C4 plants. Plant Physiology, 59: 86-90. DOI:10.1104/pp.59.1.86 |
Farquhar G D, Sharkey T D. 1982. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
Federer C A. 1982. Transpirational supply and demand: plant, soil, and atmospheric effects evaluated by simulation. Water Resources Research, 18: 355-362. DOI:10.1029/WR018i002p00355 |
Jarvis P G, McNaughton K G. 1985. Stomatal control of transpiration. Advances in Ecological Research, 15: 1-49. |
Jarvis P G. 1976. The interpretation of the variations in leaf water potential and stomatal conductance found in canopies in the field. Philosophsical Transactions of the Royal Society, London, 273B: 593-610. |
Jones H G. 1973. Limiting factors in photosynthesis. New Phytologist, 72: 1089-1094. DOI:10.1111/j.1469-8137.1973.tb02086.x |
Kozlowski T T. Water Deficits and Plant Growth. Volume IV. Academic Press, New York, 1974
|
Leuning R. 1990. Modelling stomatal behavior and photosynthesis of Eucalyptus grandis. Australian Journal of Plant Physiology, 17: 159-175. |
McMurtrie R E, Wang Y P. 1993. Mathematical models of the photosynthetic response of tree stands to rising CO2 concentrations and temperatures. Plant, Cell and Environment, 16: 1-13. DOI:10.1111/j.1365-3040.1993.tb00839.x |
Meidner H, Sheriff D W. Water and Plants. Blackie, Glasglow, 1976
|
Meyer W S, Dunin F X, Smith R G, et al. 1981. Characterizing water use by irrigated wheat at Griffith, New South Wales. Australian Journal of Soil Research, 25: 499-515. |
Monteith J L. 1965. Evaporation and environment. Symposium of the Society for Experimental Biology, 19: 205-234. |
Ritchie J T. 1973. Influence of soil water status and meteorological conditions on evaporation from a corn canopy. Agronomy Journal, 65: 893-897. DOI:10.2134/agronj1973.00021962006500060014x |
Slatyer R O. 1967. Plant Water Relationships. Academic Press, London. |
Tanner C B, Jury W A. 1976. Estimating evaporation and transpiration from a row crop during incomplete cover. Agronomy Journal, 68: 239-243. DOI:10.2134/agronj1976.00021962006800020007x |
Tanner C B. 1981. Transpiration efficiency of potato. Agronomy Journal, 73: 59-64. DOI:10.2134/agronj1981.00021962007300010014x |
Thornley J H M. 1976. Mathematical Models in Plant Physiology. London: Academic Press.
|
Tyree M T, Jarvis P G. Water in tissues and cells. In: Lange O L, Nbbel P S, Osmond C B et al. Encyclopedia of Plant Physiology, New Series Volume 12B.Springer-Verlag, Berline, 1982, 35~77
|
Von Caemmerer S, Farquhar G D. 1981. Some relationships between the biochemistry of photosynthesis and the gas exchange of leaves. Planta, 153: 376-387. DOI:10.1007/BF00384257 |
Wang Y P, Handoko Jr, Rimmington G M. 1992. Sensitivity of wheat growth to increased air temperature for different scenarios of ambient CO2 concentration and rainfall in Victoria, Australia-a simulation study. Climate Research, 2: 131-149. DOI:10.3354/cr002131 |
Whitehead D, Jarvis P G. Coniferous forests and plantations. In: Kozlowski T T(ed).Water Deficit and Plant Growth. VI. Academic Press, New York, 1981, 49~152
|
Wong C S, Cowan I R, Farquhar G D. 1979. Stomatal conductance correlates with photosynthetic capacity. Nature, 282: 424-426. DOI:10.1038/282424a0 |
 2003, Vol. 39
2003, Vol. 39
