文章信息
- 王满囷, 李周直.
- Wang Manqun, Li Zhouzhi.
- 鞭角华扁叶蜂保幼激素滴度的动态
- CHANGES OF JUVENILE HORMONE TITRES OF CHINOLYDA FLAGELLICORNIS
- 林业科学, 2002, 38(5): 83-86.
- Scientia Silvae Sinicae, 2002, 38(5): 83-86.
-
文章历史
- 收稿日期:2001-03-27
-
作者相关文章
保幼激素(juvenile hormone, JH)属于半倍萜类化合物, 它包括JH Ⅰ(十八碳)、JH Ⅱ(十七碳)和JH Ⅲ (十六碳), 此外尚有少量的JH0、JHB3与4-甲基JH Ⅰ等。它由昆虫的咽侧体分泌, 具有变态和调节生殖器官发育的作用。许多研究证实JH对昆虫的滞育特别是幼虫的滞育起着调节作用(Yin et al., 1978; Yagi et al., 1974; 赵章武等, 1995)。但由于JH在昆虫体内含量甚微(10-7 ~ 10-9mol), 且不易于脂类物质分离, 使得在生理水平上测定JH的滴度很困难。对昆虫体内JH的测定, 最早只能采用生物测定的方法, 其中使用最为广泛的是对大蜡螟(Galleria mellonella)或黄粉甲(Tenebrio moliter)蛹的“蜡伤测试法”。由于生物测定法的特异性和灵敏性较差, 20世纪70年代以后逐步发展了气相色谱-质谱分析法(GCMS法)、放射免疫法(RIA)以及高效液相色谱法(HPLC), 或通过放射化学法(RC)测定保幼激素酯酶(juvenile hormone esterase, JHE)来反映昆虫体内JH滴度(JH titre)的变化(王智翔, 1989; 王宗舜等, 1988; 杨亦桦等, 1997; 云自厚等, 1992; 龚国玑等, 1996; 戴华国等, 1997)。研究表明HPLC测定法无需制备衍生物, 最小检测量可达10 ng, 是一种较为简便易行的测定方法。为探讨JH对鞭角华扁叶蜂发育及滞育的调控作用, 利用HPLC技术测定了鞭角华扁叶蜂不同发育阶段JH的滴度。
1 材料与方法 1.1 供试昆虫鞭角华扁叶蜂幼虫在自然条件下, 以水培柏木当年生枝叶饲养。虫龄以幼虫脱皮次数来记数, 本试验确定5龄晚期幼虫头壳从前胸背板上脱落起计为6龄0 h。
1.2 血淋巴的收集6龄幼虫0 h开始, 每隔12 h收集1次血淋巴, 预蛹期以入土为起点, 每隔1个月收集1次血淋巴。每一样品用虫10头, 加苯基硫脲晶体数粒, 置-29 ℃下保存备用。
1.3 试剂甲醇为色谱醇; 正己烷、乙醚为国产分析纯试剂, 经室内重蒸后使用; 标准品JH Ⅲ为Sigma公司产品。
1.4 仪器美国Waters Model 510型液相色谱, M-490型可调波长可见-紫外检测器, LKB2210型记录仪。
1.5 样品制备将一定量的血淋巴加一定比例的提取液甲醇:乙醚(1:1 V:V)超声波振荡提取3 ~ 5 min, 加入2 mL正己烷, 再超声振荡10 min, 以4 000 r·min-1离心10 min取上清液。用己烷反复提取5次, 汇总上清液, 上机前用高纯N2吹干, 流动相定容。
1.6 仪器及色谱条件Lichrospher C18柱、ID45μm、4.6 mm ×150 mm, 流动相为甲醇:水(75:25 V:V), 流速为0.6 mL·min-1, 紫外检测λ=218 nm, 进样量为20 μL。以外标(峰面积)法定量。
2 结果与分析 2.1 JH标样和试虫血淋巴JH图谱
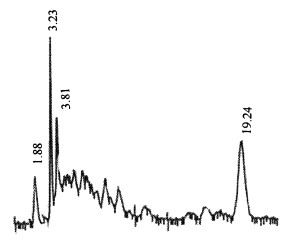
|
图 1 JH Ⅲ标准品HPLC色谱图 Fig. 1 HPLC figure of standard sample of JHⅢ |
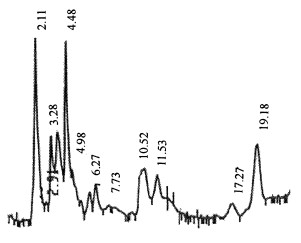
|
图 2 预蛹血淋巴提取物色谱图 Fig. 2 HPLC figure of extrators in heamology |
标样和样品上机检测的结果表明, 标样和血淋巴的提取物出峰稳定, JH Ⅲ的保留时间为19 min 20 s左右, 本实验的检测条件可用于JH Ⅲ滴度的测定。
2.2 末龄幼虫血淋巴中JH的滴度鞭角华扁叶峰末龄幼虫血淋巴中JH滴度变化如图 3。从图中可以看出, JH的滴度在末龄幼虫血淋巴中呈明显的下降趋势。在末龄幼虫初期JH滴度较高, 可达64 ng·mL-1左右, 24 h后便迅速降低为32 ng·mL-1左右, 之后虽也呈现出下降的趋势, 但血淋巴中JH滴度仍保持较高的水平, 可达17 ng·mL-1以上。
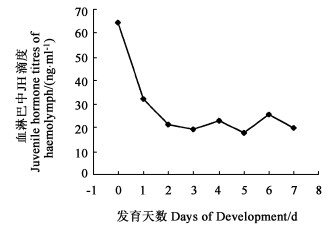
|
图 3 末龄幼虫血淋巴中JH滴度 Fig. 3 JH titres of haemolymph in last instar lavae |
鞭角华扁叶蜂预蛹血淋巴中JH滴度如图 4。从图中可以看出, 在鞭角华扁叶峰整个滞育期间, 血淋巴中JH的滴度较高, 同末龄幼虫血淋巴中JH的滴度差别不大, 雌雄预蛹分别可达18和17 ng·mL-1以上。在滞育期间, 无论雌雄预蛹, JH滴度保持较为平稳的状态, 只是在入土后135 d(10月22日)有一个较为明显的下降趋势, 雌雄预蛹JH滴度分别为18.96 ng·mL-1和17.46 ng·mL-1左右, 之后又呈现上升趋势, 到184 d(12月10日)达最高值, 雌雄预蛹分别为23.93 ng·mL-1和25.90 ng·mL-1, 这就表明在滞育期间, 鞭角华扁叶蜂的咽侧体仍保持较高的活性, 调控血淋巴中JH的滴度, 协调机体其它的生理生化变化, 以适应周围环境的变化。
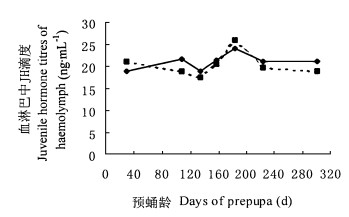
|
图 4 滞育预蛹血淋巴中JH滴度 Fig. 4 JH titres of haemolymph of prepupa  雌预蛹Female; 雌预蛹Female;  雄预蛹Male. 雄预蛹Male.
|
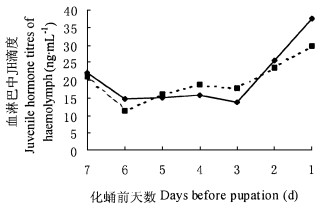
鞭角华扁叶蜂化蛹前1周血淋巴中JH滴度如图 5。从图中可以看出, 雌雄预蛹血淋巴中JH滴度在化蛹前的1周开始, 与滞育期间预蛹相比较, 血淋巴中JH滴度在一开始有一个较为明显的下降趋势, 雌雄预蛹分别从19.05 ng· mL-1和21.07 ng·mL-1降低为14.46 ng·mL-1和11.17 ng· mL-1左右, 之后的几天中一直保持较低的滴度。对MH滴度测定的结果表明, 此时MH滴度出现第一次高峰, 此时为预蛹皮层开始溶离, 出现蛹的皮细胞和相应的表皮1)。到化蛹前的第2 d时, JH滴度又有所升高, 到化蛹前1 d时, 雌雄预蛹可分别达37.42 ng·mL-1和29.53 ng·mL-1左右, 此时为MH滴度降至最低, 鞭角华扁叶蜂开始化蛹。
|
图 5 鞭角华扁叶蜂化蛹前一周血淋巴中JH滴度 Fig. 5 The JH titres of haemolymph in the prepupa before pupation of Chinolyda flagellicornis  雌预蛹Female; 雌预蛹Female;  雄预蛹Male. 雄预蛹Male.
|
1) 王满.鞭角华扁叶蜂滞育机理的研究.南京林业大学博士学位论文.2000
3 讨论从本质上看, 昆虫滞育受到内分泌系统的调控, 但激素对于滞育的起始、维持及终止的调控机制在不同的昆虫种类中有所不同。一般地, 促前胸腺激素(PTTH)和脱皮激素(MH)分泌受到抑制是导致大多数末龄幼虫滞育的关键(Nijhout, 1995)。对鞭角华扁叶蜂末龄幼虫血淋巴中JH滴度测定的结果表明, 在6龄幼虫初期, 血淋巴中JH滴度迅速下降, 但之后仍保持较高滴度的JH(血淋巴中JHⅢ的滴度可达17 ng·mL-1以上), 至使PTTH和MH的分泌活动受到抑制, 诱导鞭角华扁叶蜂滞育。这同大多数滞育幼虫末龄血淋巴中JH滴度研究的结果相一致(Yagi et al., 1974; Chippendale, 1977; Yin et al., 1974; 1976;1979)。
同时, 对鞭角华扁叶蜂滞育预蛹JH Ⅲ滴度测定的结果表明, 同多数滞育幼虫相似, 在滞育期间, 其预蛹血淋巴中JH Ⅲ的滴度达20 ng·mL-1左右, 这就表明, 在鞭角华扁叶蜂滞育期间, 预蛹咽侧体(CA)仍保持较高的活性, 通过分泌JH来调节PTTH和MH分泌活动, 维持鞭角华扁叶蜂的滞育; 对化蛹前1周血淋巴中JH Ⅲ滴度测定的结果表明, 推测从化蛹前1周左右开始, 预蛹咽侧体(CA)的活性受到抑制, JH的生物合成停止, 血淋巴及组织中残存的JH被激活的酯酶和环氧化物水解酶分解, 导致JH滴度降到预蛹脱皮化蛹的阈值, 分泌MH的前胸腺被激活, 机体开始蜕皮化蛹。(Chippendale, 1977; Yagi et al., 1974; Yin et al., 1974; 1976;1979;De Kort et al., 1981; Muszynska-Pytel et al., 1993; 王荫长, 2001)。这种变化同对鞭角华扁叶蜂的内分泌系统解剖观察的结果也相一致, 在滞育期间, 鞭角华扁叶蜂预蛹的各分泌器官未见任何萎缩的迹象(王满囷等, 2000)。
但对于JH如何同MH协调来调节鞭角华扁叶蜂滞育的确切机制, 还需要通过外源激素的处理以及机体的结扎等试验来加以进一步的证实。
戴华国, 程薇, 吴晓毅, 等. 1997. 稻褐飞虱保幼激素酯酶活性的测定. 南京农业大学学报, 20(4): 108-110. |
龚国玑, 杨春龙, 韩航如. 1996. HPLC检测粘虫保幼激素以及灭幼脲对保幼激素滴度的影响. 南京农业大学学报, 19(1): 105-107. |
王满囷, 李周直. 2000. 鞭角华扁叶蜂预蛹神经内分泌系统的解剖. 南京林业大学学报, 24(2): 21-24. DOI:10.3969/j.issn.1000-2006.2000.02.005 |
王荫长. 2001. 昆虫生物化学. 北京: 中国农业出版社.
|
王智翔. 1989. 昆虫保幼激素分析方法进展. 昆虫知识, (1): 57-59. |
王宗舜, 郑文惠, 郭郛. 1988. 蓖麻蚕蛹期血淋巴中保幼激素滴度的测定. 科学通报, 15: 1182-1186. |
杨亦桦, 戴国华, 韩航如, 等. 1997. 用HPLC测定稻褐飞虱体内的保幼激素. 华东昆虫学报, 6(2): 24-27. |
云自厚, 杨轶帆, 姜在阶, 等. 1992. 用HPLC测定长角血蜱中的保幼激素. 北京师范大学学报(自然科学学报), 28(2): 200-202. |
赵章武, 黄永平. 1995. 昆虫滞育及其调控机制. 山西大学学报(自然科学版), 18(1): 105-118. |
Chippendale G M. 1977. Hormonal regulation of larval diapause. Annu Rev Entomol, 22: 121-138. DOI:10.1146/annurev.en.22.010177.001005 |
De Kort C A D, Granger N A. 1981. Regulation of the Juvenile hormone Titer. Ann Rev Entomol, 25: 1-28. |
Muszynska-Pytell M, Trzcinska R, Aubry M, et al. 1993. Regulation of Prothoracic gland activity in diapausing larvae of the wax moth, Galleria mellonella L.(Lepidoptera). Insect Biochem Molec Biol, 23: 33-41. DOI:10.1016/0965-1748(93)90079-8 |
Nijhout F I, Wheeler D E. 1982. Juvenile Hormone and the physiological of insect polymorphism. Q Rev Biol, 57: 109-133. DOI:10.1086/412671 |
Nijhout H F. 1995. Insect Hormones. Princeton: Princeton University Press.
|
Yagi S, Fukaya M. 1974. Juvenile hormone as a key factor in regulating larval diapause of the rice stem borer Chilo suppressalis. Appl Entomol Zool, 9: 247-255. DOI:10.1303/aez.9.247 |
Yagi S, Fukaya M. 1974. Juvenile hormone as a key factor regulating larval diapause of the rice stem borer, Chilo suppressalis. Appl Ent Zool, 9: 247-255. DOI:10.1303/aez.9.247 |
Yin C M, Chippendale G M. 1979. Diapause of the southwestern corn borer Diatreaea grandiosella:further evidnce showing juvenile hormone to be the regulation. J Insect Physiol, 25: 513-523. DOI:10.1016/S0022-1910(79)80010-4 |
Yin C M, Chippendale G M. 1976. Hormonal control of larval dipause and metamorphosis in the southwestern corn borer Diatreaea grandiosella. J Exp Biol, 64: 303-310. |
Yin C M, Chippendale G M. 1974. Juvenline hormone and the induction of larval polymorphism and diapause of the southwestern corn borer Diatreaea grandiosella. J Insect Physiol, 20: 1833-1847. DOI:10.1016/0022-1910(74)90213-3 |
Yin C M, Chippendale G M. 1978. Larval diapause of the European corn borer, Ostrinia nubilalis:experiments examining its hormonal control. J Insect Physiol, 25: 53-58. |
Yin C M, Wang Z S, Chaw W D. 1985. Brain neurosecretory cell and ecdysiotropin activity of the non-diapausing and diapausing D.gradiosella. J Insect Physiol, 31: 659-667. DOI:10.1016/0022-1910(85)90066-6 |
 2002, Vol. 38
2002, Vol. 38
