文章信息
- 吴楚, 王政权.
- Wu Chu, Wang Zhengquan.
- 冰冻条件下外源SA对水曲柳幼苗叶片内抗氧化酶的影响
- EFFECTS OF EXOGENOUS SA ON ACTIVITIES OF ANTIOXIDANT ENZYMES IN THE LEAVES OF FRAXINUS MANDSHURICA SEEDLINGS UNDER FREEZING STRESS
- 林业科学, 2002, 38(5): 54-59.
- Scientia Silvae Sinicae, 2002, 38(5): 54-59.
-
文章历史
- 收稿日期:2000-07-28
-
作者相关文章
水曲柳(Fraxinus mandshurica)是我国东北林区重要的珍贵阔叶树种。它的幼苗幼树展叶时经常受到晚霜(-10 ~ -8 ℃)的危害, 其早期生长受到严重的影响(陈祥伟等, 1999)。在植物体内, 低温能导致活性氧的大量产生, 引起氧化胁迫(Parsad et al., 1994)。尽管抗氧化酶和抗氧化剂能清除一定数量的活性氧, 但低温条件产生的过多活性氧能引起膜脂的过氧化、蛋白质的变性和DNA的突变, 从而导致细胞伤害或死亡。
水杨酸(SA)是一种新型植物激素, 对植物抗性的形成具有重要的作用(Chen et al., 1993a; 1993b)。在冷胁迫条件下, SA能通过影响几种抗氧化酶的活性而降低植物的冷害(Janda et al., 1999)。以往的研究主要注重0 ℃以上的冷胁迫, 本文根据水曲柳的晚霜冻害特点, 研究冰冻胁迫条件下外源SA对水曲柳幼苗内几种抗氧化酶活性的影响, 探讨在冰冻胁迫下SA的生理作用, 为水曲柳幼苗的抗冻防御技术提供理论基础。
1 材料与方法 1.1 幼苗的培育选择健壮的1 a生水曲柳幼苗, 用园土栽在16 cm ×16 cm(直径×高度)的塑料盆中, 放于温室中培养。视盆中土壤的水分状况用自来水浇灌。待幼苗叶片完全展开后用于实验。
1.2 水杨酸处理和冰冻处理以李兆亮等(1998)的方法对材料进行SA处理, 2 h后放入-10 ℃冰箱中进行冰冻处理1 ~ 4 h。
1.3 实验方法超氧化物歧化酶(SOD)的活性分析按照陈光仪(1990)的方法; 过氧化氢酶(CAT)活性分析根据Rao等(1996); 过氧化物酶(POD)的活性分析根据华东师范大学生物系植物生理教研组(1980)的方法; 抗坏血酸过氧化物酶(APX)的活性分析根据沈文飚等(1996)的方法; 谷胱甘肽还原酶(GR)的活性分析根据Foyer等(1995)的方法; 丙二醛(MDA)的含量分析根据朱广廉等(1990)的方法; H2O2含量的测定根据Patter等(1984)的方法; 超氧自由基含量的测定根据王爱国等(1990)的方法进行。以上实验均重复3次。
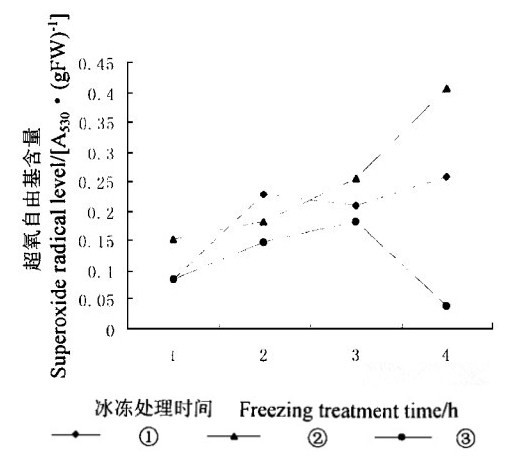
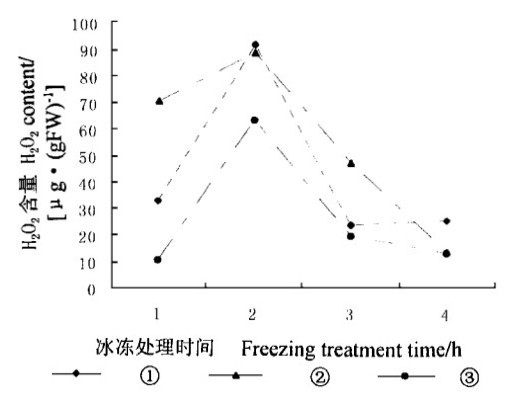
2 实验结果 2.1 SA对活性氧含量的影响在植物的有氧代谢中, 活性氧的产生是不可避免的, 然而在抗氧化酶和抗氧化剂的共同作用下, 活性氧对细胞并不造成危害。在冰冻胁迫下, 细胞会产生过多的活性氧, 其含量超出细胞清除它们的能力, 从而导致细胞受害或死亡。SA通过增加或降低抗氧化剂含量和抗氧化酶的活性而影响活性氧的清除。图 1显示经过外源SA处理的水曲柳叶片内超氧自由基含量高于对照, 表明外源SA增加了超氧自由基含量。经过5 mmol·L-1SA处理的叶片内超氧自由基含量, 除了在冰冻处理2 h时高于经过10 mmol·L-1SA处理的叶片外, 其余含量都较低, 这表明在冰冻胁迫条件下超氧自由基含量与外源SA浓度有密切关系。冰冻处理4 h, 2种浓度SA处理的叶片内超氧自由基含量分别比对照高出约7倍和10倍。在整个冰冻处理期间, 外源SA也导致H2O2含量增加(图 2)。经过外源SA处理的叶片内H2O2含量(约90μg·g-1)和对照内H2O2含量(63 μg·g-1)在冰冻处理2 h时同时达到最高, SA处理的叶片内H2O2含量比对照高43 %。H2O2含量的增加造成膜脂过氧化, 不利于细胞在冰冻胁迫下生存。
|
图 1 冰冻胁迫下SA对水曲柳叶片内超氧自由基含量的影响 Fig. 1 Effect of SA on levels of superoxide radicals under freezing stress ①5 mmol·L-1SA, ②10 mmol·L-1SA, ③Control.下同。The same in below. |
|
图 2 冰冻胁迫下SA对水曲柳叶片内H2O2含量的影响 Fig. 2 Effect of SA on H2O2 contents under freezing stress ①5 mmol·L-1SA, ②10 mmol·L-1SA, ③Control.下同。The same in below. |
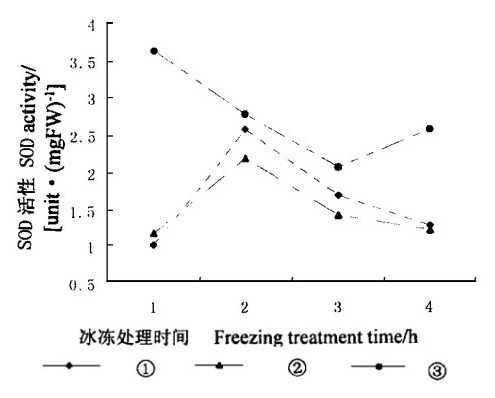
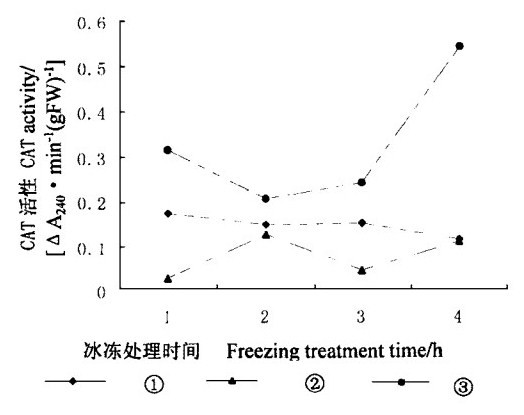
植物体内存在多种抗氧化酶, 其中SOD、CAT、APX、POD和GR是细胞中5种主要的抗氧化酶, 冰冻胁迫下外源SA对它们的生理功能有重要的影响。在细胞中, SOD把超氧自由基转化为H2O2。图 3表明, 在冰冻条件下, 经过外源SA处理的叶片内SOD活性低于对照, 并且随SA浓度增加而降低。在冰冻处理2 h以后, 经过SA处理的叶片内的SOD活性随处理时间延长而降低。这种外源SA对SOD活性的影响不利于细胞清除超氧自由基。与SOD变化相似, 外源SA降低了CAT活性(图 4), CAT活性也与SA浓度有关。但在冰冻处理4 h后, CAT活性只有对照的20 %。由此可以看出, 外源SA抑制了CAT活性, 这种抑制不利于细胞清除H2O2。
|
图 3 冰冻胁迫下SA对水曲柳叶片内SOD活性的影响 Fig. 3 Effect of SA on SOD activity under freezing stress |
|
图 4 冰冻胁迫下SA对水曲柳叶片内CAT活性的影响 Fig. 4 Effect of SA on CAT activity under freezing stress |
在细胞内, 尽管CAT能清除大量的H2O2, 但它与H2O2的亲和力较小, 不能使细胞内H2O2含量降低到无害水平。APX与H2O2的亲和力较大, 能清除较低含量的H2O2。APX在清除H2O2时, 需要抗坏血酸(AsA)作为辅助底物。图 5显示外源SA降低了APX活性。除了在冰冻处理2 h外, 经过5 mmol·L-1 SA处理的叶片内APX活性高于经过10 mmol·L-1SA处理的APX活性, 这表明APX活性有随外源SA浓度增加而降低的趋势。
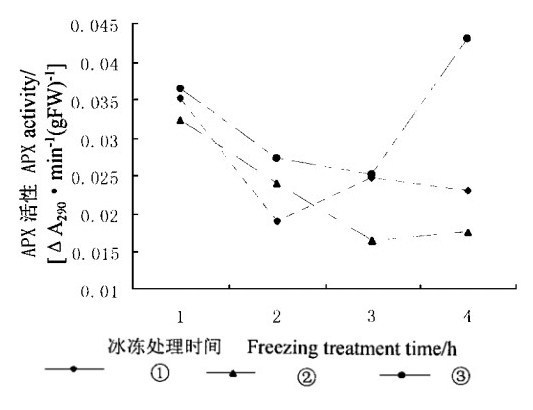
|
图 5 冰冻胁迫下SA对水曲柳叶片内APX活性的影响 Fig. 5 Effect of SA on APX activity under freezing stress |
POD清除H2O2的作用方式与APX一样, 但其辅助底物的种类较多。在冰冻胁迫下, 外源SA对POD活性的影响虽然随处理时间而呈现锯齿状变化, 但仍可以看出经过外源SA处理的叶片内POD活性明显地高于对照(图 6)。经过SA处理叶片内的POD活性在冰冻处理1 ~ 3 h随SA浓度增加而增加。在冰冻处理4 h, 经过2种浓度SA处理的叶片内POD活性分别比对照平均高2.4倍和2.7倍, 这表明在冰冻胁迫下外源SA能提高POD活性, 有利于细胞清除H2O2。
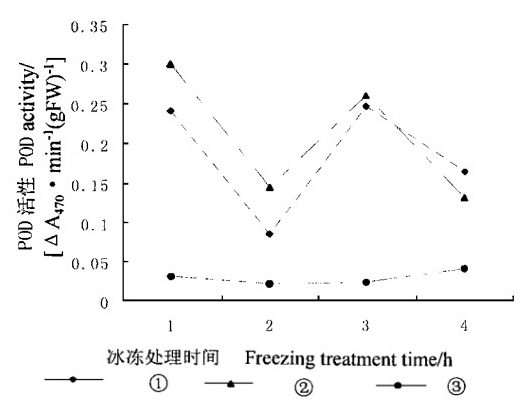
|
图 6 冰冻胁迫下SA对水曲柳叶片内POD活性的影响 Fig. 6 Effect of SA on POD activity under freezing stress |
在抗坏血酸-谷胱甘肽途径中, GR是一种非常重要的抗氧化酶。它所催化的GSSG向GSH转化的反应是该途径的限制步骤(Jablonshi et al., 1981)。外源SA对GR活性的影响也直接关系到GSSG向GSH的转化, 从而影响到DHA向AsA的转化。从图 7可以看出, 经过外源SA处理的叶片内GR活性比对照低。在冰冻处理4 h内, 对照GR活性分别比2种浓度SA处理平均高出116 %和141 %。除了在冰冻处理3 h外, 经过5mmol·L-1SA处理的叶片内GR活性比经过10 mmol·L-1SA处理的叶片内GR活性高, 平均高出11.76 %。这表明外源SA降低了GR活性, 同时GR活性与外源SA浓度有关。GR活性降低不利于GSSG向GSH转化, 从而间接地影响到DHA向AsA转化。因此, 外源SA对GR活性的影响不利于细胞清除活性氧。
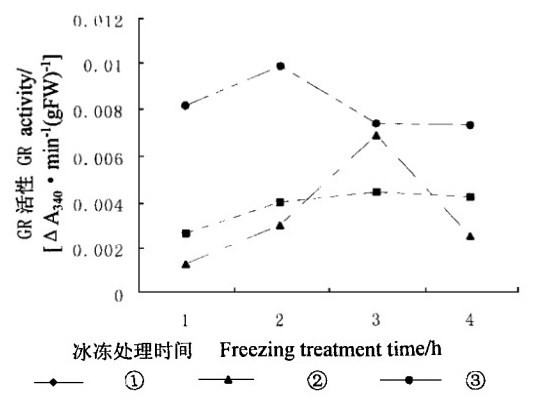
|
图 7 冰冻胁迫下SA对水曲柳叶片内GR活性的影响 Fig. 7 Effect of SA on GR activity under freezing stress |
当活性氧的产生超出抗氧化酶和抗氧化剂的清除能力时, 活性氧将引起膜脂过氧化。膜脂过氧化是一个非常复杂的过程, 其最终产物是一些小分子的醛、醇和酮等(孙存普等, 1999)。一般以丙二醛(MDA)的含量代表膜脂过氧化的程度(Deighton et al., 1999)。从图 8可以看出, 在冰冻处理整个过程中, 经过5 mmol·L-1SA处理叶片内的MDA含量都低于对照, 平均比对照低35.19 %。经过10 mmol·L-1SA处理的叶片内MDA含量在冰冻处理初期(2h)低于对照, 而在后期则高于对照, 平均比对照高16.84 %。由此可以看出, 较低浓度(5 mmol·L-1)SA处理降低MDA含量, 即减少膜脂的过氧化, 降低了细胞冰冻伤害。
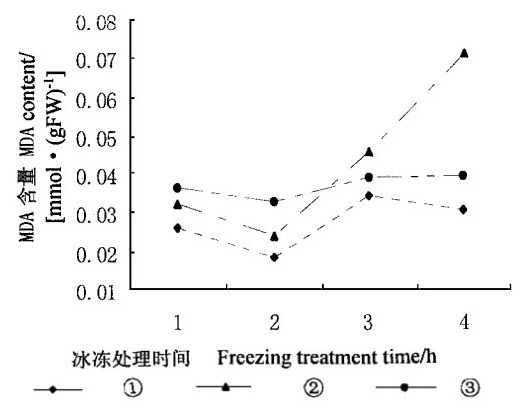
|
图 8 冰冻胁迫下SA对水曲柳叶片内MDA含量的影响 Fig. 8 Effect of SA on MDA contents under freezing stress |
冰冻条件下产生的过多活性氧超出植物细胞内抗氧化酶和抗氧化剂的清除能力时, 活性氧攻击细胞的许多组成成分, 尤其是膜脂、蛋白脂, 从而引起细胞伤害或死亡。因此, 在冰冻胁迫条件下迅速清除这些活性氧对细胞的生存具有重要意义。
SOD的活性与SA浓度有关。在正常温度下, 低浓度(0.8 mmol·L-1)能提高烟草内SOD活性(Fodor et al., 1997)。RNA印迹分析表明, 用1.0 mmol·L-1SA处理玉米叶片后第6天和第10天, SA增加Sod4的转录, 而Sod4A的转录保持不变。经过1.5 mmol·L-1和2.0 mmol·L-1SA处理后, 玉米叶片内的Sod4A的转录随SA的浓度升高而下降, 经过2.0 mmol·L-1SA处理的玉米叶片内的Sod4的转录也下降(Scandalios, 1997)。因此, 在本实验中SOD活性下降(图 3)是由外源SA浓度过高引起的。由于SOD是清除超氧自由基的主要酶, SOD活性下降导致水曲柳叶片内超氧自由基含量上升(图 1)。
在植物系统获得抗性中, SA起着非常重要的作用。在20世纪90年代, Chen等(1991; 1993a)发现并签定了一种SA结合蛋白CAT。SA与CAT中的铁络合而抑制CAT活性(Chen et al., 1993b)。图 4中经过SA处理的叶片内CAT的活性低于对照, 可能就是由于外源SA抑制了CAT活性而引起的。由于SA也能与APX结合而引起APX活性下降(Durner et al., 1995), 因此图 5中经过外源SA处理的水曲柳叶片内APX活性低于对照是由外源SA抑制作用引起的。
在正常温度条件下, 外源SA能增加黄瓜幼苗叶片内的POD活性(李兆亮等, 1998)。在系统获得抗性中, SA也能增加POD活性(Rasmussen et al., 1991)。因此, 在冰冻胁迫处理条件下, 外源SA能增加POD活性(图 6)是合理的。SA增加POD活性的生化机理目前尚不清楚。
CAT、APX和POD是细胞中清除H2O2的主要酶, 尤其是CAT和APX。细胞中大量的H2O2是由CAT清除的, 因此, CAT的活性对H2O2含量影响非常大。比较图 2和图 4可知, 经过SA处理的水曲柳叶片内H2O2含量高于对照, 因为SA抑制了CAT活性。APX与H2O2的亲和力大于CAT与H2O2的亲和力, 当细胞中H2O2浓度下降到一定程度后, CAT就不能使H2O2含量进一步下降。此时, APX就发挥重要的作用。比较图 2和图 5可知, 经过SA处理的叶片内H2O2含量增加与其中APX活性受到抑制有关。在细胞中, POD清除H2O2的方式与APX的作用方式相似, 它们在清除H2O2时都需要辅助底物。比较图 2和图 6可知, POD活性与H2O2含量增加无关, 这主要是因为POD在清除H2O2过程中所起的作用较小。
在GR催化作用下, GSSG转化成GSH。GSH在植物中具有多种功能。它作为电子供体参与DHA向AsA的转化。AsA又是非常重要的抗氧化剂, 能直接清除超氧化物和H2O2, 还原氧化态α-生育酚(Padh, 1990)。AsA含量多少与植物的抗低温能力有关(Alvarez et al., 1986)。α-生育酚能阻断膜脂的过氧化(Cadenas, 1989)。因此, GR是植物中非常重要的酶。GR活性大小关系到上述物质的转化。在冰冻处理期间, 外源SA降低了GR活性(图 7)。低GR活性不利于GSSG、DHA和氧化态α-生育酚向着它们的还原态转化, 因此也不利于活性氧的清除。这种低GR活性是由APX活性受到SA抑制所引起的, 因为APX与GR是相互联系的(Rao et al., 1997)。
抗氧化酶和抗氧化剂的共同作用降低了细胞内的活性氧的含量, 也影响到MDA的形成。在正常温度下, 低浓度SA处理降低MDA的产生(李兆亮等, 1998), 表明低浓度SA处理可减少膜脂的过氧化。图 8显示, 在冰冻胁迫下SA浓度与MDA含量也具有这种特点。
上述表明, 在冰冻胁迫条件下, 外源SA对水曲柳幼苗叶片内抗氧化酶的活性具有重要的影响。和对照相比, 外源SA能降低SOD、CAT、APX和GR活性, 提高POD活性, 而且这些酶的活性与SA的浓度有关。通过影响以上几种酶的活性, 外源SA增加超氧自由基和H2O2的含量, 不利于冰冻胁迫下细胞的生存。但SA浓度越低, 对SOD、CAT、APX和GR活性的抑制作用也越弱, 有利于超氧自由基和H2O2清除, 使细胞在冰冻条件下得到保护。对于水曲柳而言, 如果外源SA的浓度更低, 能象在其它植物体内那样增加SOD、POD和GR活性, 对CAT和APX的活性抑制减少, 则SA对保护水曲柳免遭低温伤害就更有利。
陈光仪. 超氧化物酶(SOD)活性测定. 见: 黄学林, 陈润政主编. 种子生理实验手册. 北京: 农业出版社, 1990, 122~ 124
|
陈祥伟, 张琛, 刘华, 等. 1999. 水曲柳人工林霜冻危害的研究. 东北林业大学学报, 27(2): 10-14. DOI:10.3969/j.issn.1000-5382.1999.02.003 |
华东师范大学生物系植物生理教研组编. 植物生理学实验指导. 北京: 人民出版社, 1980, 143 ~ 144
|
李兆亮, 原永兵, 刘成连, 等. 1998. 水杨酸对黄瓜叶片抗氧化酶系的调节作用. 植物学报, 40(4): 256-261. |
沈文飚, 徐朗莱, 叶茂炳, 等. 1996. 抗坏血酸过氧化物酶活性的测定的探讨. 植物生理学通讯, 32(3): 203-205. |
孙存普, 张建中, 段绍瑾. 1999. 自由基生物学导论. 合肥: 中国科学技术大学出版社, 160-179.
|
王爱国, 罗广华. 1990. 植物的超氧自由基与羟胺反应的定量关系. 植物生理学通讯, (6): 55-57. |
朱广廉, 钟晦文, 张爱琴. 1990. 植物生理学实验. 北京: 北京大学出版社, 245-248.
|
Alvarez M R, Candela M E, Sabater F. 1986. Ascorbic acid content in relation to frost hardiness injury in Citrus limon leaves. Cryobiology, 23: 263-268. DOI:10.1016/0011-2240(86)90052-0 |
Cadenas E. 1989. Biochemistry of oxygen toxicity. Annu Rev biochem, 58: 79-110. DOI:10.1146/annurev.bi.58.070189.000455 |
Chen Z, Kless D F. 1991. Identification of soluble salicylic acid-binding protein that may function in signal transduction in plant disease resistance response. ProNatl Acad Sci USA, 88: 8179-8183. DOI:10.1073/pnas.88.18.8179 |
Chen Z, Ricigliano J W, Klessig D F. 1993a. Purification and characterization of a solube salicylic acidbinding protein from tobacco. Pro Natl Acad Sci USA, 90: 9533-9537. DOI:10.1073/pnas.90.20.9533 |
Chen Z, Silva H, Klessig D F. 1993b. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid. Science, 262: 1883-1886. DOI:10.1126/science.8266079 |
Deighton N, Muchenschnabel I, Goodman B A, et al. 1999. Lipid peroxidation and the oxidative burst associated with infection of Capsicum annum by Botrytis cinera. Plant J, 20(4): 485-492. DOI:10.1046/j.1365-313x.1999.00622.x |
Durner J, Klessig D F. 1995. Inhibition of ascorbated peroxidase by salicylic acid and 2, 6-dichlorosonicotinic acid, two inducers of plant defense responses. Pro Natl Acad Sci US, 92: 11312-11316. DOI:10.1073/pnas.92.24.11312 |
Fodor J, Gullner G, Adam A L, et al. 1997. Local and systemic responses of antioxidants to tobacco mosaic virus infection and to salicylic acid in tobacco. Plant Physiol, 114: 1443-1451. DOI:10.1104/pp.114.4.1443 |
Foyer C H, Souriau N, Petter S, et al. 1995. Overexpression of glutathione reductase but not glutanthione synthetase leads to increases in antioxidant capacity and resistance to photoinhibition in poplar trees. Plant Phyiol, 109: 1047-1057. DOI:10.1104/pp.109.3.1047 |
Jablonski P P, Anderson J W. 1981. Light -dependent reduction of dehydroascorbate by ruptured peachloroplasts. Plant Physiol, 67: 1239-1244. DOI:10.1104/pp.67.6.1239 |
Janda T, Szalai G, Tari I, et al. 1999. Hydroponic treatment with salicylic acid decreases the effects of chilling injury in maize(Zea mays L.)plants. Planta, 208: 175-180. DOI:10.1007/s004250050547 |
Padh H. 1990. Cellular function of ascorbic acid. Biochem Cell Biol, 68: 1166-1173. DOI:10.1139/o90-173 |
Patterson B D, MacRae E A, Ferguson I B. 1984. Estimation of hydrogen peroxide in plant extract using titanium(Ⅳ). Analytical Biochemistry, 139: 487-492. DOI:10.1016/0003-2697(84)90039-3 |
Rao M V, Paliyath G, Ormorod D P, et al. 1997. Influence of salicylic acid on H2O2 production, oxidative stress, and H2O2-metabolizing enzymes. Plant Physiol, 115: 137-149. DOI:10.1104/pp.115.1.137 |
Rao M V, Paliyath G, Ormrod D. 1996. Ultraviolet -B and ozone-induced biochemical changes in antioxidant enzymes of Arabidopsis thaliana. Plant Phyiol, 110: 125-136. DOI:10.1104/pp.110.1.125 |
Rasmussen J B, Hammerschmidt R, Zook M N. 1991. Systemic induction of salicylic acid accumulation in cucumber after inoculation with Pseudomonas syringae pvsyringae. Plant Phyiol, 97: 1342-1347. DOI:10.1104/pp.97.4.1342 |
Scandalio J G. Molecular genetics of superoxide dismutases in plants. In: Scandalios J G(ed). Oxidative Stress and the Molecular Biology of Antioxidant Defenses. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 1997, 545 ~ 546
|
 2002, Vol. 38
2002, Vol. 38
