文章信息
- 王满囷, 李周直.
- Wang Manqun, Li Zhouzhi.
- 滞育期间鞭角华扁叶蜂保护酶系统活力
- STUDIES ON THE ACTIVITIES OF ENZYMES OF PROTECTIVE SYSTEM DURING DIAPAUSE OF SAWFLY CHINOLYDA FLAGELLICORNIS
- 林业科学, 2002, 38(4): 100-104.
- Scientia Silvae Sinicae, 2002, 38(4): 100-104.
-
文章历史
- 收稿日期:2001-03-05
-
作者相关文章
2. 南京林业大学 南京 210037
2. Nanjing Forestry University Nanjing 210037
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)是生物体内重要的保护酶。SOD能够清除机体内超氧阴离子自由基O2-, 保护机体及细胞免受损伤; CAT在细胞中起着清除过氧化氢(H2O2)毒性的作用, 对生物的生长发育、代谢活动以及抗逆性具有重要的意义; POD则是机体内广泛存在的一种重要的催化过氧化氢分解的酶, 可以起到保护细胞膜结构和功能完整的作用(Fridovich, 1977; 方中允等, 1989)。研究表明昆虫体内也存在着由SOD、CAT、POD组成的保护酶系, 在昆虫各种生理作用或生化反应过程中起着清除氧自由基、保护昆虫机体免受损伤的重要作用(Trofimov, 1975; Felton et al., 1991; Felton et al., 1995; Pardini, 1995; 李周直等, 1994; 杨唐斌等, 1996; 薛芳森等, 1996; 1997; 吴小锋等, 1997; 1998a; 1998b)。
鞭角华扁叶蜂是柏木林的重要食叶害虫, 其年生活史有2个明显的不同阶段, 即繁殖阶段和以预蛹滞育越夏越冬阶段(萧刚柔, 1992; 崔相富等, 1992)。滞育是昆虫逃避不利环境的重要方式, 其特征是代谢活动显著降低, 形态发育停止。大多数昆虫在滞育期间氧消耗明显减少, 即使在夏季高温下滞育的昆虫, 其氧消耗仍保持一个极端低的水平(Adamek et al., 1985; Tauber et al., 1986; 吴坤君等, 1989; 梁成杰等, 1998; 王满等, 2001)。既然昆虫在滞育期间代谢速率很低, 而SOD、CAT和POD的活力与代谢强度以及机体的抗逆性有关, 那么, 鞭角华扁叶蜂滞育期间, 预蛹SOD、CAT和POD 3种保护酶活力如何?是否也有所下降?本研究的目的在于探讨鞭角华扁叶蜂体内3种保护酶活力与发育及滞育的关系。
1 材料与方法 1.1 试验虫源鞭角华扁叶蜂幼虫在室内常温条件下, 以水培柏木当年生枝叶饲养。虫龄以幼虫脱皮次数来记数, 在各龄幼虫脱皮第2天收集样品, 10个1、2龄幼虫为1个样品, 其余各龄以单个虫体为一个样品, 重复5次。预蛹采集于浙江省仙居县。
1.2 酶液提取将供试虫体加入预冷的PBS(pH7.0)缓冲液, 在冰浴中研磨提取, 匀浆置于2 ℃, 10000 r·min-1下离心20 min, 上清液即为酶提取液。
1.3 酶活力测定用南京建成生物工程研究所提供的试剂盒测定。SOD活力测定的原理:通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O2-), 后者氧化羟胺形成亚硝酸盐, 在显色剂的作用下呈现紫红色, 用72型可见光分光光度计(550 nm)测定其吸光度。当被测样品中含SOD时, 则对超氧阴离子自由基(O2-)有专一的抑制作用, 使形成的亚硝酸盐减少, 比色时测定管的吸光度低于对照管的吸光度, 通过公式可计算出被测样品中的总SOD活力。其中酶活力单位(NU)定义为:每毫克虫体中SOD的抑制率50 %时所对应的SOD量为一个亚硝酸盐单位。
CAT活力测定的原理:根据CAT分解H2O2的反应可通过加入钼酸铵而迅速中止, 剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物, 在405 nm处测定其生成量, 可计算出CAT活力单位。其中以每分钟分解1 μmol的H2O2为1个CAT活力单位(NU)。
POD活力测定的原理:根据POD可以促进过氧化氢(H2O2)与还原型GSH反应生成H2O及氧化型谷胱甘肽(GSSG), 谷胱甘肽过氧化物酶的活力可用其酶促反应的速度来表示, 测定此酶促反应中还原型谷胱甘肽的消耗, 则可求出酶的活力。
2 结果与分析 2.1 幼虫期体内3种保护酶活力的变化幼虫期体内3种保护酶活力的变化如图 1。从图 1中可看出, 鞭角华扁叶蜂幼虫体内总SOD活力随虫龄的增大而升高, 两者之间呈正相关, 老龄幼虫总SOD活力高于幼龄幼虫总SOD活力。经方差分析, 各虫龄之间的总SOD活力的差异显著(P = 0.05), 说明SOD活力水平与虫龄关系密切。

|
图 1 幼虫期3种保护酶活力的变化 Fig. 1 The activities of three protectivies enzymes of larval stage ○POD; ●CAT; ▲SOD. |
CAT活力在整个幼虫期间的变化趋势与SOD相似, 随着幼虫发育和生长而迅速升高, 6龄幼虫CAT活力是1龄幼虫的3.5倍。经方差分析, 各虫龄之间CAT活力的差异极显著(P =0.01), 说明CAT活力与虫龄关系密切, 呈正相关。
与SOD活力的变化趋势相反, 鞭角华扁叶蜂幼虫体内POD活力随虫龄的升高而下降, 呈负相关, 幼龄幼虫POD活力明显高于老龄幼虫, 2龄幼虫POD活力是6龄幼虫的3倍多。经方差分析, 各龄幼虫之间POD活力的差异极显著(P =0.01)。说明POD活力水平与虫龄密切相关。
2.2 滞育期间预蛹体内SOD活力的变化鞭角华扁叶蜂预蛹滞育期间SOD活力变化如图 2。从图 2可以看出, 鞭角华扁叶蜂预蛹SOD活力在整个滞育期间的变化较大, 有两个峰值, 但同幼虫体内SOD活力比较, 预蛹体内SOD活力一直处于较低的水平。在入土后的70 d左右(8月17日)达最高水平(第1个峰值), 雌雄预蛹SOD活力分别由刚入土的(0.69 ±0.04)NU·mg-1和(0.80 ±0.07)NU·mg-1升高至(0.96 ±0.06)和(1.56 ±0.06)NU·mg-1, 之后SOD活性逐渐下降, 直至2个月后11月15日(入土158 d左右)达滞育期间的第2个峰值, 雌雄预蛹的SOD活力分别为: (0.58 ±0.07)NU·mg-1和(0.89 ± 0.07)NU·mg-1。之后鞭角华扁叶蜂预蛹体内的SOD活力水平又处于较为平稳的状态, 一直维持至第2年化蛹。对比鞭角华扁叶蜂越夏、越冬期的气温变化趋势, 预蛹体内SOD活力达最高值时, 此时正处于高温期间; 10月中旬后气温逐渐下降, SOD活力开始升高。说明外界环境温度的变化对预蛹体内SOD活力有影响。
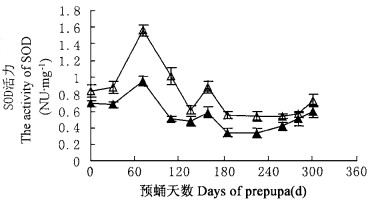
|
图 2 滞育期间预蛹体内SOD活力的变化 Fig. 2 The changes of SOD activity of prepupa during diapause △male; ▲female. |
从图 2也可以看出, 在整个的滞育期间, 雌雄预蛹体内SOD活力的变化趋势相似, 但并不完全相同, 方差分析的结果表明雌雄预蛹SOD活力在整个的滞育期间差异不显著, 说明SOD的代谢不存在性别的差异。而对同一发育时期雌雄预蛹体内SOD分析发现, 在整个的滞育期间, 雄预蛹体内SOD活力始终高于同一时期雌预蛹体内SOD活力(图 2)。如刚入土时, 雄预蛹体内SOD活力为(0.84 ±0.07)NU ·mg-1, 雌预蛹体内的SOD活力为(0.69 ±0.04)NU·mg-1, 前者为后者的1.2倍, 经方差分析, 该时期两者的差异显著(P =0.05)。
2.3 滞育期间预蛹体内CAT活力的变化鞭角华扁叶蜂预蛹滞育期间体内CAT活力的变化如图 3。从图 3可看出, 与SOD代谢变化不同, 预蛹体内CAT活力在滞育期间总的趋势是逐渐下降, 但不同时期CAT活力又有变化, 如在刚入土时, 雌雄预蛹体内CAT活力分别为(1.82 ±0.09)和(2.21 ± 0.14)NU·mg-1, 到10月下旬(135 d左右)已降至(1.00 ±0.11)和(1.234 ±0.07)NU·mg-1。随着气温的降低, CAT活力又有所升高, 到12月中旬(184 d左右)雌雄预蛹CAT活力分别升高至(1.55 ±0.08)和(1.67 ±0.09)NU·mg-1, 之后维持较为平稳的状态, 直到化蛹。与幼虫期间机体CAT活力相比较, 预蛹期间的CAT活力有所降低。对比气温变化, 机体CAT活力变化趋势同气温的变化有一定的相关性, 如在7、8月份气温较高的这一段时期内, CAT的活力水平较低; 而在冬季寒冷的季节里, CAT活力水平有所升高。这可能说明高温能引起预蛹体内CAT活力下降, 而低温能导致预蛹体内CAT活力升高, 预蛹在滞育期间体内CAT活力与温度密切相关。
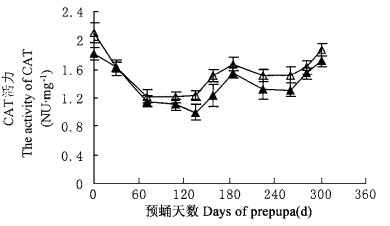
|
图 3 滞育期间预蛹体内CAT活力的变化 Fig. 3 The changes of CAT activity of prepupa during diapause △male; ▲female. |
从图 3也可以看出, 在整个的滞育期间, 雌雄预蛹体内CAT活力的变化趋势相似, 经方差分析, 表明雌雄预蛹CAT活力在整个的滞育期间差异不显著。而对同一发育时期雌雄预蛹体内CAT分析发现, 在整个滞育期间, 雄预蛹体内CAT活力始终高于同一时期雌预蛹体内CAT活力(图 3)。如刚入土时, 雄预蛹体内CAT活力为雌预蛹体内的CAT活力的1.2倍, 经方差分析, 该时期差异显著(P =0.05)。
2.4 滞育期间预蛹体内POD活力的变化鞭角华扁叶蜂预蛹体内POD活力在整个滞育期间的变化如图 4。从图中可以看出, 预蛹在滞育期间体内POD活力均处于较低的水平, 除在入土后30 d左右(7月6日), POD有一个峰值外, 在整个滞育期间, 无论是炎热的夏季还是寒冷的冬季, 预蛹体内POD活力一直处于较为平稳的状态, 变化趋势不明显。这种现象一直维持到第2年2月下旬, 之后, 随着预蛹滞育结束和化蛹, 鞭角华扁叶蜂体内POD活力迅速升高。同幼虫期POD活力相比较POD活力变化不大。对比滞育期间气温的变化, 预蛹期POD活力受环境温度的影响不大。
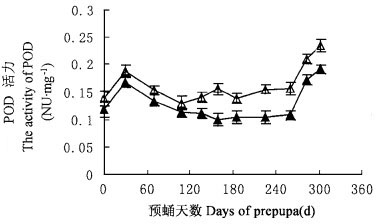
|
图 4 滞育期间预蛹体内POD活力的变化 Fig. 4 The changes of POD activity of prepupa during diapause △male; ▲female. |
从图 4也可以看出, 在整个的滞育期间, 雌雄预蛹体内POD活力的变化趋势相似, 但仍有差异, 方差分析的结果表明雌雄预蛹POD活力在整个滞育期间差异显著(P =0.05)。而对同一发育时期雌雄预蛹体内POD活力分析发现, 在整个滞育期, 雄预蛹体内POD活力始终高于同一时期雌预蛹体内POD活力(图 4)。在刚入土时, 雄预蛹体内POD活力为(0.14 ± 0.01)NU·mg-1, 雌性预蛹体内的POD活力为(0.12 ±0.01)NU·mg-1, 前者为后者的1.2倍左右, 经方差分析, 该时期差异显著(P =0.05)。
3 讨论上面的结果表明, 鞭角华扁叶蜂幼虫体内3种保护酶活力与幼虫虫龄密切相关, 其中SOD和CAT活力与虫龄呈正相关, 表现在老龄时SOD和CAT活力分别可达1龄幼虫的1.5和3.5倍; POD活力则与虫龄呈负相关, 幼龄幼虫的POD明显高于老龄幼虫。这一结果与李周直等(1994)的结论SOD活力水平与虫龄呈负相关, POD活力水平随虫龄增大而稍有下降, 以及CAT活力与虫龄呈正相关的结论稍有差异(李周直等, 1994), 同薛芳森等(1996; 1997)的结论CAT活力随虫龄升高而下降, SOD活力随虫龄增大而升高的结论也不完全一致。这说明对于不同的昆虫, 其保护酶活力变化的趋势可能有所不同。
鞭角华扁叶蜂滞育期间, 预蛹体内SOD、CAT、POD活力同幼虫期保护酶活力相比较, 均有较大幅度的下降, 这同Trofimov(1975)报道的松黄叶蜂滞育蛹越夏期间CAT活力下降, 以及薛芳森等(1996; 1997)报道的黑纹粉蝶滞育蛹越夏过程中CAT和SOD酶活力均下降的结论相一致, 这可能与昆虫滞育期间代谢强度下降有关。通过对预蛹呼吸代谢的测定, 滞育期间, 预蛹的耗氧量比幼虫期下降了70 %(王满等, 2001), 而O2-的产生必须有O2的参与, 因此生物体合成SOD的能力也必然下降, 导致预蛹滞育期间SOD活力比幼虫期有所下降; 同样, 预蛹滞育期间CAT和POD活力也有所下降。实验结果还显示SOD、CAT活力的变化与气温的变化有密切的关系, 高温或低温都会引起预蛹体内保护酶活力的变化, 这就造成预蛹在不同的发育时期, 尽管其代谢强度及耗氧量差别不大, 保护酶活力存在着较大的差异; 但不同的是POD活力受环境温度的影响较小。
在生理情况下, 生物体内的自由基不断在产生, 同时也不断地被清除, 因而显不出自由基对机体的损伤, 由于某些生理作用或生化反应中需要O2-等参与, 机体还要通过自由基的产生与清除来维持有利无害的、生理性低水平的、稳定平衡的自由基浓度, 这就需要这三种保护酶之间协调的作用(方允中等, 1989)。对鞭角华扁叶蜂幼虫体内保护酶活力分析发现, SOD活力随着幼虫的生长发育而升高, 与此相适应, CAT的活力也随之升高, 尽管这期间POD活力随之稍有降低, 但CAT增长的幅度要大于POD降低的幅度, 因此机体内清除H2O2总能力是随着幼虫的生长发育而增大。这种协调作用的关系也表现在滞育预蛹整个发育过程中。SOD、CAT、POD的协调作用, 可能是预蛹期间鞭角华扁叶蜂死亡率很低的原因之一。
崔相富, 陶华齐, 王于荣, 等. 1992. 鞭角华扁叶蜂生物学特征及防治方法的研究. 林业科学研究, 5(3): 321-327. |
方允中, 李文杰主编.自由基与酶基础理论及其在生物学和医学中的应用.北京: 科学出版社, 1989
|
李周直, 沈惠娟, 蒋巧根, 等. 1994. 几种昆虫体内保护酶系统活力的研究. 昆虫学报, 37(4): 399-403. DOI:10.3321/j.issn:0454-6296.1994.04.002 |
梁成杰, 赵玲, 吴燕, 等. 1998. 春尺蠖蛹呼吸代谢与滞育关系的研究. 林业科学研究, 11(3): 339-341. DOI:10.3321/j.issn:1001-1498.1998.03.020 |
王满, 李周直. 2001. 鞭角华扁叶蜂预蛹呼吸代谢的特点. 林业科学研究, 14(6): 616-620. DOI:10.3321/j.issn:1001-1498.2001.06.005 |
吴坤君, 龚佩瑜, 李秀珍. 1989. 棉铃虫越冬蛹呼吸代谢的某些特点. 昆虫学报, 32(2): 136-143. DOI:10.3321/j.issn:0454-6296.1989.02.003 |
吴小锋, 徐俊良, 崔为正. 1997. 家蚕血淋巴超氧化物歧化酶活力及其影响因素. 蚕业科学, 23(1): 38-41. |
吴小锋, 徐俊良, 崔为正. 1998a. 家蚕血液过氧化氢酶活力及其与蚕抗逆性的关系. 昆虫学报, 41(2): 124-129. |
吴小锋, 徐俊良, 崔为正, 等. 1998b. 家蚕血淋巴中过氧化物酶活力及其影响因素. 蚕业科学, 24(1): 36-38. |
萧刚柔主编.中国森林昆虫(第2版).北京: 中国林业出版社, 1992
|
薛方森, 李保同, 朱杏芬. 1996. 黑纹粉蝶滞育蛹体内超氧歧化酶活力的初步研究. 江西植保, 19(1): 34-36. |
薛方森, 魏洪义, 朱杏芬. 1997. 黑纹粉蝶滞育蛹体内过氧化氢酶活力的研究. 植物保护学报, 24(3): 204-208. DOI:10.3321/j.issn:0577-7518.1997.03.003 |
杨唐斌, 梅尚筠. 1996. 热休克对家蚕幼虫抗氧化酶活性的影响. 生物化学与生物物理进展, 23(2): 153-156. |
Adamek G, Fisher J. 1985. The oxygen consumption of non-dormant and dormant larvae of Chironomus plumosus(Diptera). J. Insect Physiol., 31(10): 767-772. DOI:10.1016/0022-1910(85)90069-1 |
Felton G W, Duffey S S. 1991. Protective action of midgut catalase in lepidopteran larvae against oxidative plant defenses. J. of Chem. Ecol., 17: 1715-1732. DOI:10.1007/BF00993724 |
Felton G W, Summers C B. 1995. Antioxidant systems in insects. Arch.of Insect Biochem. and Physiol., 29: 187-197. DOI:10.1002/arch.940290208 |
Fridovich I. 1977. Oxygen is toxic. Bioscience, 27(7): 462. DOI:10.2307/1297527 |
Pardini R S. 1995. Toxicity of oxygen from naturally occurring redox-active pro-oxidants. Arch. of Insect Biochem.and Physiol., 29: 101-118. DOI:10.1002/arch.940290203 |
Tauber J, Tauber A. 1986. Seasonal Adaption of Insects. New York: Oxford University Press, 85-96.
|
Trofimov V B. 1975. Some unusual physiological characteristics of diapause in Neodiprion sertifer. Ekologiya, 5: 85-88. |
 2002, Vol. 38
2002, Vol. 38
