文章信息
- 黄卓烈, 李明, 詹福建, 谭绍满.
- Huang Zhuolie, Li Ming, Zhan Fujian, Tan Shaoman.
- 不同生长素处理对桉树无性系插条氧化酶活性影响的比较研究
- STUDY ON THE COMPARISON OF THE CHANGES OF OXIDASE ACTIVITIES IN EUCALYPTUS CUTTINGS TREATED WITH DIFFERENT AUXINS
- 林业科学, 2002, 38(4): 46-52.
- Scientia Silvae Sinicae, 2002, 38(4): 46-52.
-
文章历史
- 收稿日期:2000-08-07
-
作者相关文章
2. 华南农业大学林学院 广州 510642
2. College of Forestry, South China Agricultural University Guangzhou 510642
过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)在植物的生长、发育中起重要的作用。近年来的研究发现, 这些酶与植物不定根的发生和发展有着密切的关系。Bhattacharya(1989)指出, 在根形成期间, 用NAA处理插条可增加不定根数量, 但体内IAAO活性和POD活性下降, 而IAA含量上升。黑松苗用IAA等生长素处理后, 随着生根进程, POD和IAAO活性升高, 但未发现POD活性或IAAO活性与根的生长过程有简单的相关关系。而用POD电泳分析表明, POD谱带与根的生长有一定的关系(Kieliszewska-Rokicha, 1989)。用NAA处理菜豆的胚根, 胚根的生长与POD活性有一定的联系, 而IAAO活性与POD活性呈现相似的变化规律(Bagatharia et al., 1998)。用阿魏酸处理生长8 d的玉米苗时, 根和枝伸长速度减小, POD和IAAO活性上升, 而PPO活性减小, 且POD的增加与木质素及酚类化合物的含量增加相对应(Devi, 1996)。“生长素-酚”的缩合物(生根素)是在PPO、POD以及一些其它酶的作用下合成的(Haissig, 1974)。研究指出, 在插条根原基发育期间, POD活性显著增加, 不定根的起源和发育可能包括酶的作用和其它一些因素的影响。可见, 不定根的发生与氧化酶有联系。
桉树是我国南方的重要造林树种。但桉树插条一般难以生根(Hartney, 1980)。国内外对桉树扦插生根的生物化学研究并不多。有关POD、PPO和IAAO活性变化与桉树插条不定根发生的关系的研究在国内外还未见报道。针对这种情况, 本研究利用不同的生长素处理几个桉树无性系的插条, 分析在生根诱导过程中, 插条体内POD、PPO和IAAO的活性的变化, 以揭示不同生长素对这些酶的作用效果以及这些酶与桉树扦插生根的关系, 为桉树生产和更深一步研究桉树的扦插生根机理提供理论依据。
1 材料与方法 1.1 供试材料供试桉树为尾叶桉(Eucalyptus urophylla)MLA无性系(简称MLA)、U6无性系(简称U6)和刚果12号桉(Eucalyptus ABL.12)W5无性系(简称W5)。均为国家林业局雷州林业科学研究所提供。其中, MLA是难生根无性系, 而U6和W5是相对容易生根的无性系(李明等, 2000a)。
1.2 试验方法 1.2.1 不同激素处理对桉树无性系插条生根过程氧化酶活性影响效果的比较试验用组培苗萌芽条嫩梢作插条。扦插基质由细河砂和黄泥混合, 2种成分的体积比为1:1, 在烘箱中以100 ℃高温消毒30 min, 取出待其冷却后, 拌以百菌清, 用量为0.05 g·(100g)-1基质, 晾24 h。插条母株为栽培于田间约8 ~ 10个月生的桉树组培苗。分别从这些母株上剪取8 ~ 10 cm的插条, 保留顶端1对小叶。将剪下的插条立即浸入水中保湿。然后将插条浸入0.1 %的KMnO4溶液中10 min作表面消毒。取出后分别用3种生长素处理:1号:1000 mg·kg-1的吲哚乙酸(IAA); 2号:1000 mg·kg-1的吲哚丁酸(IBA); 3号:100 mg·kg-1的α-萘乙酸(NAA)。生长素的处理方法是:将生长素溶解于蒸馏水中, 将插条基部浸入生长素溶液中3 min后取出扦插。另外用清水浸泡插条3 min作为对照。对照和各种生长素处理均设3次重复, 每次重复用插条50株。扦插时, 将处理好的插条的基部插于已消毒的育苗基质上, 深度为2 ~ 3 cm。插后基质保持湿润, 空气湿度保持在85 %以上, 叶面有雾化水滴。插后用薄膜覆盖, 以保持湿度。棚内各处的温度和光照一致。控制棚内温度, 温度高于30 ℃时撤去薄膜。每周喷施百菌清(0.05 %)一次控制病害。插后定期取样进行分析。取样时速插入清水中, 带回实验室置于-20 ℃冰箱贮存备用。取样时剪取插条基部3 cm茎段, 称量、切碎、匀浆, 进行酶活性分析。由于桉树是难生根的植物, 不用生长素处理的插条在扦插后3 ~ 5 d即开始死亡, 因此本研究无法具有完整的空白对照。
1.2.2 过氧化物酶活性测定POD的提取和活性测定用李明等(2000a)的方法。用反应系统在第15 ~ 45 s之间的光密度变化值(ΔO.D)计算酶活性, 即每mg蛋白质每min改变1个O.D580值为1个酶活性单位(U)。
1.2.3 多酚氧化酶活性测定PPO的提取和活性测定用李明等(2000b)所述的方法进行。以每mg蛋白质每min改变1个O.D525值为1个酶活性单位(U)。
1.2.4 吲哚乙酸氧化酶活性的测定IAAO的提取和活性测定用李明等(2000b)所述的方法进行。以每mg蛋白质在1 h内分解破坏IAA的μg数〔μg IAA·(mg protein h)-1〕表示酶活性大小。
1.2.5 可溶性蛋白含量的测定采用Bradford(1977)的方法测定, 用牛血清蛋白为标准。
1.2.6 数据处理方法各酶活性的数据用双因素方差分析进行统计, 确定差异显著性。
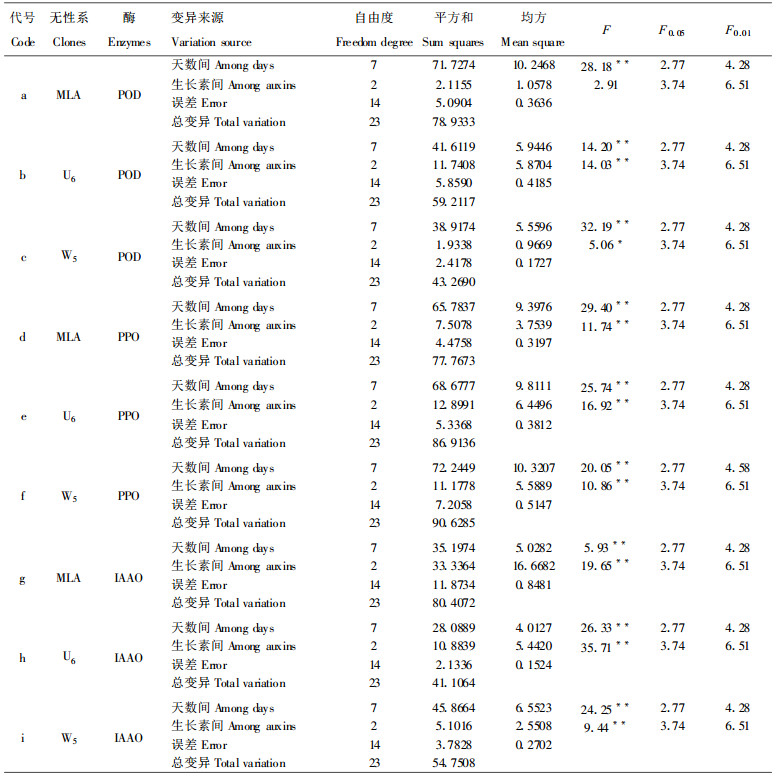
2 结果与分析 2.1 IAA、IBA、NAA处理MLA插条生根期间的POD活性比较桉树扦插生根过程可分为愈伤组织诱导期、不定根形成期、新根伸长期3个阶段, 但各无性系在各阶段所经历的时间有所不同(李明等, 2000a)。当分别用IAA、IBA和NAA处理MLA的插条后, 在扦插生根过程中, 其体内POD活性随生根进程而不同(图 1)。生根的不同时期POD活性呈现一定的规律性变化。在愈伤组织诱导期(0 ~ 20 d), 3种生长素都使POD活性呈上升趋势; 在不定根形成期(20 ~ 25 d), 3种激素处理的POD活性都稍有下降。但到了新根伸长期(25 d以后), POD活性又呈上升趋势。在3种生长素的供试浓度下, NAA和IBA处理的POD活性较高。方差分析结果(表 1a)表明, 3种生长素处理后在不同的天数内POD活性变化极显著, 充分说明MLA的生根过程与POD活性有极密切的关系。3种生长素都极大幅度地提高了MLA插条的POD活性。而不同生长素之间的差别并没有达到显著水平。这说明在MLA中, IAA、IBA、NAA对促进POD活性进而引起生根有相近的生理作用。
|
图 1 不同生长素处理MLA插条POD活性变化 Fig. 1 Changes of POD activity in MLA cuttings treated with IAA, IBA, andNAA
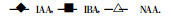
|
|
|
用IAA、IBA、NAA处理U6的插条后, POD活性的变化见图 2。结果表明, 扦插后U6的POD活性随生根进程而变化。在根的愈伤组织诱导期(0 ~ 15 d), 随生根天数增加而上升; 在不定根形成期(15 ~ 20 d), 酶活性下降; 至根伸长期(25 d以后), 酶活性又呈上升趋势。IAA和NAA处理的样品都如此。而用IBA处理的样品POD活性变化则较平缓地上升。方差分析结果(表 1b)表明, 3种生长素处理U6后, 随生根的进程POD呈现极显著的上升趋势。说明3种生长素对U6插条的促根作用与POD活性有极密切的联系。从图 2还可以看出, IAA和NAA处理引起POD活性升高的程度比IBA大, 方差分析结果(表 1b)表明, IAA和NAA与IBA的作用效果比较有极显著的差异。说明对于U6插条POD活性的提高, 在本试验中IAA和NAA的作用效果要比IBA好。
|
图 2 不同生长素处理U6插条后POD活性的变化 Fig. 2 Changes of POD activity in U6 cuttings treated with IAA, IBA, and NAA
|
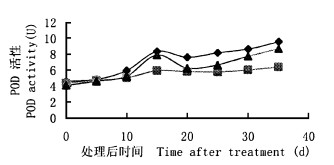
用IAA、IBA、NAA处理W5插条后, POD活性变化见图 3。结果表明, W5的POD活性变化也呈明显的规律性。在愈伤组织诱导期, POD活性相继上升, 到不定根诱导期, POD活性下降。而到新根伸长期, POD活性又上升。方差分析结果(表 1c), W5插条的不定根发生和发展与POD活性变化有极显著的联系。3种生长素对W5插条POD活性促进有显著的差异, IAA和NAA比IBA稍差。

|
图 3 不同生长素处理W5插条后POD活性的变化 Fig. 3 Changes of POD activity in W5 cuttings treated with IAA, IBA, and NAA, respectively

|
当用IAA、IBA、NAA处理MLA插条后, 在扦插生根过程中PPO活性的变化见图 4。在愈伤组织诱导期(0 ~ 20 d)酶活性相继上升, 到新根形成期, PPO活性慢慢下降。方差分析结果(表 1d)表明, MLA的生根过程伴随着PPO活性的极显著上升, 说明MLA的不定根的发生与发展与PPO活性有非常密切的联系。3种生长素对MLA插条PPO的促进效果有极显著的差异, IAA和NAA比IBA要好得多。

|
图 4 不同生长素处理MLA插条后PPO活性的变化 Fig. 4 Changes of PPO activity in MLA cuttings treated with IAA, IBA, and NAA, respectively
|
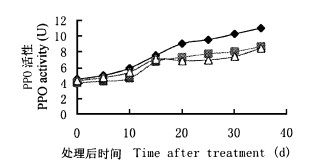
用各种生长素处理U6插条后体内PPO活性变化与生根的关系见图 5。3种生长素处理后在生根过程中PPO活性都显著上升。方差分析结果(表 1e)表明, 插条在扦插后生根过程中PPO活性的变化与处理后时间的关系极显著。说明U6插条的生根与PPO活性有紧密联系。不同生长素对U6插条PPO的促进效果有极显著的差异, 在本实验中, IAA要比IBA和NAA好得多。

|
图 5 不同生长素处理U6插条后POD活性的变化 Fig. 5 Changes of POD activity in U6 cuttings treated with IAA, IBA, and NAA, respectively
|
用不同的生长素处理W5的插条后, 体内的PPO活性的变化见图 6。随着生根进程, 3种生长素处理都使W5的PPO活性大幅度上升。方差分析结果(表 1f)表明, 各生长素处理后不同天数内酶活性的变化极显著。这表明W5插条不定根的发生和发展与PPO活性有密切的关系。另一方面, 各生长素作用效果之间的差异极显著, 说明在促进W5插条的PPO活性方面, IAA的效果要比IBA和NAA好得多。
|
图 6 不同生长素处理W5插条后PPO活性的变化 Fig. 6 Changes of PPO activity in W5 cuttings treated with IAA, IBA, and NAA, respectively
|
当用各种生长素处理MLA插条后, 在生根期间IAAO活性变化的情况见图 7。各种生长素处理MLA都促进了IAAO的活性。方差分析结果(表 1g)表明, 处理后各天数之间IAAO活性的变化极显著。这说明MLA插条不定根的发生与发展与IAAO有非常紧密的联系。此外, 在MLA中, 各种生长素对IAAO的促进效果有极显著的差异, IAA比IBA和NAA好得多。

|
图 7 不同生长素处理MLA插条后IAAO活性的变化 Fig. 7 Changes of IAAO activity inMLA cuttings treated with IAA, IBA, and NAA, respectively
|
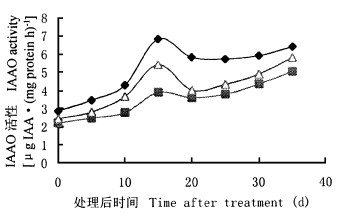
用各种生长素处理U6插条后体内IAAO活性变化与不定根生长的关系见图 8。生长素处理后, 随着生根的进程, IAAO活性呈现规律性的变化。在愈伤组织诱导期(0 ~ 15 d)内, IAAO活性急剧上升。到不定根形成期(15 ~ 20 d), 酶活性有下降。而进入新根伸长期(25 d以后), 酶活性又慢慢升高。方差分析结果(表 1h)表明, 各种生长素处理后IAAO活性变化极显著, 又说明在U6中不定根的形成与IAAO活性有十分密切的关系。另一方面, 不同生长素对U6插条的IAAO活性作用效果差异极显著, IAA的促进效果要比IBA和NAA好得多。
|
图 8 不同生长素处理U6插条后IAAO活性的变化 Fig. 8 Changes of IAAO activity in U6 cuttings treated with IAA, IBA, and NAA, respectively
|
当用各种生长素处理W5插条后, 生根期间体内IAAO活性的变化见图 9。随着生根进程, IAAO活性也呈规律性的变化。除在不定根形成期酶活性稍有下降外, 其余时期均上升。方差分析结果(表 1i)表明, 生根各时期IAAO活性的差异极显著, 说明在W5中, 不定根的发生与发展与IAAO活性有非常密切的联系。另外, 不同生长素的作用效果之间差异极显著, 在W5中, IAA和NAA促进IAAO活性的效果要比IBA好得多。

|
图 9 不同生长素处理W5插条后IAAO活性的变化 Fig. 9 Changes of IAAO activity in W5 cuttings treated with IAA, IBA and NAA, respectively

|
对于生长素、氧化酶、不定根的发生3者间的关系, 不少学者进行过研究。有结果证明, 用生长素处理植物插条时其基因表达受到促进, PPO活性明显提高(Haissgi, 1974)。用生长素处理Pistacia vera时, 导致体内PPO和IAAO活性都大幅度提高(Al Barazi et al., 1984)。用生长素处理玫瑰的嫩枝时, 体内的PPO活性也大大提高(Balakrishnamurthy et al., 1988)。有人认为, IAA处理所引起的根原基的发生决定于IAA对RNA和DNA合成的促进作用, 从而促进基因的表达合成相关的酶。外源的IAA或插条自己合成的生长素是通过消除对基因的抑制, 促进RNA合成的(郑均宝等, 1991)。根原基的发生和发育需要有mRNA的合成, 这些特殊的mRNA将会翻译合成某些特殊的酶, 从而促进根原基发生。徐继忠等(1989)认为IBA对插条的作用, 是通过IAA而起作用的。IAA能促进体内POD、PPO、IAAO等酶的活性变化, 从而促进细胞的脱分化, 产生愈伤组织。在本试验中, 用生长素处理插条后, 在生根的愈伤组织诱导阶段, POD、PPO、IAAO活性均大幅度上升。到了新根形成期, 各酶活性上升速度放慢, 甚至稍有下降。到新根伸长期, 各酶活性又上升。这充分揭示了桉树不定根的发生和发展与这3种氧化酶的密切联系。不定根的形成是插条形成新器官的过程, 形成新器官的过程必然是以相应的代谢为基础的, 而代谢是由相应的酶催化的。因此, 不定根的发生和发展伴随着某些酶活性的变化是很正常的。本研究所揭示的桉树插条的不定根形成与POD、PPO、IAAO的关系更加肯定了前人的观点。
那么, POD、PPO、IAAO与不定根发生和发展的相关机理又是怎样的? POD、IAAO之间具有密切的关系。已知吲哚乙酸(IAA)的一个非常重要的生理功能就是促进不定根的形成。体内的IAAO可以氧化IAA, 而POD也能氧化IAA(Gebhardt, 1982; Haissig, 1986)。从本研究结果可知, 难生根植物的POD、IAAO活性高, 降解IAA的作用强, IAA被破坏较多, 向下输送的IAA含量很少, 对诱导生根不利。反之, 易生根植物POD活性低, 其降解IAA能力较弱, 而输送到茎基部的IAA就较多, 对诱导根原基的形成有利。这可能是桉树难易生根特性与POD和IAAO活性高低的辩证关系的一个侧面。
据报道, PPO对不定根的形成十分重要(Bhattacharya et al., 1980; Al Barazi et al., 1984)。Bhattacharya (1989)就曾经证明PPO催化生长素代谢, 促进不定根的起源与发育。Molnar等(1972)发现Hydrangen macrophylla的茎组织产生不定根时, PPO活性剧烈地上升。用胡萝卜的愈伤组织进行培养时, 伴随着根点的出现, PPO活性也急剧上升(Habaguchi, 1977)。在菜豆的插条生根期间PPO活性大幅度上升(Upadhyaya et al., 1986)。Foong等(1981)报道, 在易生根的Rhododendron ponticum体内的PPO活性较高, 而在难生根的“ R.Jan Dekens”中PPO活性就要低得多。本试验利用桉树插条作为研究材料也发现, 在其不定根的发生和发展过程中PPO活性也大幅度提高。但是, PPO又是怎样促进生根的呢?有学者认为, 体内的酶类物质对不定根的起源和发育起着极其重要的作用(Basu et al., 1986; Balakrishnamurthy et al., 1988)。用外源的酚类化合物处理菜豆的插条可大幅度提高插条的发根量(Poapst et al., 1967)。难生根的枝条与容易生根的枝条之间有一个重要的差别就是其体内酚类物质的含量不同, 难生根的枝条含有较少的酚类物质, 容易生根的枝条则含有较多的酚类物质(Hartman et al., 1976)。PPO的一个重要作用是催化这些酚类物质与IAA综合而形成一种“IAA -酚酸复合物”(Haissig, 1974), 这种复合物是一种生根的辅助因子, 具有促进愈伤组织的分化、促进不定根形成的活性(Poapst et al., 1967; Bassuk et al., 1981; Balakrishnamurthy et al., 1988)。本实验的结果表明, 难生根桉树MLA插条内PPO活性较低, 因而可能催化形成的IAA -酚类复合物较少, 导致对生根不利。而U6和W5体内的PPO活性较低, 可以推测其合成的这种复合物较多, 因而就较大幅度地提高扦插生根率。可见本试验结果与上述观点是相符的。这也说明PPO在生根中确有可能主要起着催化这种复合物形成的作用。这也许是桉树难易生根特性与PPO活性的辩证关系的另一个侧面。
本实验的结果表明, 在桉树插条中使用生长素处理后, 在生根过程中POD、PPO、IAAO活性都呈现一定的规律性变化, 且在生根的一定阶段还表现相同的变化规律。这说明这3种酶在生根过程中既能独立发挥各自作用, 又可能不是孤立的, 而是相互影响从而促进生根的。
李明, 黄卓烈, 谭绍满, 等. 2000a. 难易生根桉树的过氧化物酶活性及其同工酶多型性比较研究. 华南农业大学学报, 21(3): 56-59. |
李明, 黄卓烈, 谭绍满, 等. 2000b. 难易生根桉树多酚氧化酶、吲哚乙酸氧化酶活性及其同工酶的比较研究. 林业科学研究, 13(5): 493-500. |
徐继忠, 陈四维. 1989. 桃硬枝插条内源激素(ABA、IAA)含量变化对生根的影响. 园艺学报, 16(4): 275-277. DOI:10.3321/j.issn:0513-353X.1989.04.008 |
郑均宝, 刘玉军, 裴保华, 等. 1991. 几种木本植物插穗生根与内源IAA、ABA的关系. 植物生理学报, 17(3): 313-316. DOI:10.3321/j.issn:1671-3877.1991.03.005 |
Al Barazi Z, Schwabe W W. 1984. The possible involvement of polyphenol-oxidase and the auxin-oxidase system in root formation and development in cuttings of Pistacia vera. J Hort Sci, 59(3): 453-461. DOI:10.1080/00221589.1984.11515218 |
Bagatharia S B, Chanda S V. 1998. Changes in peroxidase and IAA oxidase activities during cell elongation in Phaseolus hypocotyls. Acta Physiol Plant, 20(1): 9-13. DOI:10.1007/s11738-998-0037-x |
Balakrishnamurthy G, Madhava Rao V N. 1988. Changes in phenols during rhizogenesis in rose(Rosa bourboniana Desp). Curr Sci, 57(17): 960-962. |
Bassuk N L, Hunter L D, Howard B H. 1981. The apparent of polyphenol oxidase and phloridzion in the production of apple rooting cofactors. J Hort Sci, 56(4): 313-322. DOI:10.1080/00221589.1981.11515007 |
Basu R N, Mandal K, Punjabi B.Propagation of tropical and subtropical horticultural crops.Bose R K et al (ed).Naya Prakash, India, 1986: 87
|
Bhattacharya N C.Enzyme activities during adventitious rooting.In: Davis T D et al(eds).Adventitous Root Formation on Cutting.Dioscorides: Portland, 1989, 88~101
|
Bhattacharya N C, Kumar A. 1980. Physiological and biological studies associated with adventitious root formation in Phaseolus mungo L.in relation to auxinphenol synergism. Biochem Physiol Pflanz, 175: 421-435. DOI:10.1016/S0015-3796(80)80028-X |
Bradford M M. 1977. A rapid and sensitive method for the quantation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72(2): 248-254. |
Devi S R, Prasad M M V. 1996. Ferulic acid mediated changes in oxidative enzymes of maize seedlings implication in growth. Biol Plant, 38(3): 387-395. DOI:10.1007/BF02896668 |
Foong T W, Barnes M F. 1981. The levels of reserve metabolites and oxidative enzymes in the cuttings of easy-to-root and diffcult-to-root rhododendrons. Biochem Physiol Pflanzen, 176: 206-216. DOI:10.1016/S0015-3796(81)80073-X |
Gebhardt K. 1982. Activation of indole-3-acetic acid oxidase from horseradish and prunus by phenols and hydrogen peroxide. Plant Growth Regul, 1(2): 73-84. DOI:10.1007/BF00024500 |
Habaguchi K. 1977. Alterations in polyphenol oxidase activity during organ redifferentiation from carrot calluses cultured in vitro. Plant Cell Physiol, 18: 181-189. |
Haissig B E.Metabolic processes in adventitious rooting of cuttings.In: jackson M B (ed).New Root Formation in Plant and Cuttings.Lancaster: Martinus Nijhoff, 1986, 141~189
|
Haissig B E. 1974. Influence of auxins and synergists on adventitious root primordium in initiation and development. New Zealand J For Sci, 4: 311-323. |
Hartman T, Kester D E.Plant propagation-principle and practices.3rd edn.New Delhi: Prentice Hall of India, 1976
|
Hartney V J. 1980. Vegetative propagation of the Eucalyptus. Austr For Res, 10(3): 191-211. |
Kieliszewska-Rokicha B. 1989. Effect of treating scots pine(Pinus sylvestris L.)seedlingswith phytohormone on the growth of the root system and on the peroxidase and IAA oxidase enzyme activities in roots. Arboretum-Kornckie, 32: 207-219. |
Molnar J M, La Croix L J. 1972. Studies of the rooting of cuttings of Hydrangea macrophylla:enzyme changes. Can J Bot, 50: 315-322. DOI:10.1139/b72-042 |
Poapst P A, Durkee A B. 1967. Root differentiating properties of some simple aromatic substances of the apple and pear fruit. J Hort Sci, 42: 429-438. DOI:10.1080/00221589.1967.11514226 |
Upadhyaya A, Davis T D, Sankhla N. 1986. Some biochemical changes associatied with paclobutrazol-induced adventitious root formation on bean hypocotyl cuttings. Ann Bol, 57: 309-315. |
 2002, Vol. 38
2002, Vol. 38