文章信息
- 裴东, 袁丽钗, 奚声珂, 谷瑞升.
- Pei Dong, Yuan Lichai, Xi Shengke, Gu Ruisheng.
- 核桃品种试管嫩茎生根的研究
- SHOOT ROOTING IN VITRO FOR WALNUT CULTIVARS
- 林业科学, 2002, 38(2): 32-37.
- Scientia Silvae Sinicae, 2002, 38(2): 32-37.
-
文章历史
- 收稿日期:2000-08-21
-
作者相关文章
2. 中国科学院植物研究所 北京 100093
2. The Institute of Botany, CAS Beijing 100093
核桃无性繁殖困难一直是困扰核桃发展的最为突出的问题(郗荣庭等, 1996; 陈正华, 1986; 刘淑兰等, 1986), 表现在:一方面新品种不断涌现, 而另一方面应用于规模化栽培的新品种却寥寥无几, 因而严重制约着核桃优种化和产业化进程, 是急待解决的重要课题。核桃无性繁殖困难表现在其常规扦插难于生根, 嫁接成活率不稳定、繁殖系数低等; 另外早实优良品种形成长枝的能力很差, 尤其7~8 a生以上的树体表现更为突出(裴东等, 1998), 接穗量远远不能满足嫁接需要。因此探索新方法解决核桃试管苗生根问题和提高繁殖系数成为研究的关键。试管培养作为新兴植物再生技术具遗传稳定, 繁殖系数高, 条件可控制、繁殖率稳定等特点, 已广泛地应用到植物的繁殖实践中。然而, 核桃的试管繁殖研究尽管起步于20世纪80年代初, 但试管嫩茎生根问题一直没有得到很好的解决。进入90年代, 在生根研究方面虽然获得了一定的进展(Gale et al., 1988; Berros et al., 1993; Ana et al., 1993; Durous et al., 1997;Driver et al., 1984), 但采用的外植体多为合子胚、实生苗、杂种核桃等在发育阶段上属幼态的组织, 对于核桃成龄品种的试管繁殖则少见报道。本研究自1992年开始, 以长期继代培养的核桃品种为试材, 通过外源激素处理的2步诱导生根和嫩茎外植体的选择等, 成功地诱导了试管嫩茎生根, 获得了较为满意的结果。
1 材料和方法 1.1 材料继代培养4 a的核桃品种试管嫩茎, 继代间隔约为20 d, 品种为:辽宁-1号、新早丰、中林5号、元丰、维那(Vina)、强特勒(Chandler) (郗荣庭等, 1996)。
1.2 方法 1.2.1 培养基及培养条件基本培养基为DKW(Driver et al., 1984), 继代扩繁培养基为DKW附加1.0 mg·L-1 BA和0.001 mg·L-1 IBA。第1步诱导生根培养基为1/4 DKW附加不同浓度IBA; 第2步生根培养基为不含生长调节剂的DKW。转移培养的介质为蛭石附加一定量的DKW。培养温度为25℃±3℃, 光照强度为1800Lx, 每天16 h光照和8 h黑暗。继代和生根诱导均在250 mL圆柱状培养瓶中进行。
1.2.2 生根处理生根诱导方法分别采用1步和2步诱导生根法。1步诱导生根法的做法是:将试管嫩茎一直培养在添加生长素类(IBA、NAA)的培养基中。在过去的工作及预备试验的基础上, 设计了2步诱导生根法。对试管嫩茎进行了不同生长素(IBA)处理与不同处理天数的试验, 以及不同天数的光或暗培养条件, 目的是筛选出最佳处理的生长素浓度和处理天数, 以及培养条件, 详见本文2.1。2步诱导生根试验所采用的外植体均为幼嫩、节间较长、叶片较小并呈嫩绿色、茎叶夹角小的嫩茎。即本文2.3的Ⅰ类幼态茎。每个处理的嫩茎数为30~36株, 每个处理重复3次。
1.2.3 生长素(IAA)和脱落酸(ABA)测定采用高效液相色谱进行分析, 取样量为30株组培苗, 充分混匀后用于分析。准确称取样品1~3 g, 在研钵中剪细并加入80%冰甲醇10 mL, 研细后转至150 mL三角瓶中, 再加20 mL 80%冰甲醇后加塞, 超声波振荡2 h(不断加入冰块, 保证温度低于4℃)后过滤, 滤渣中再加入20 mL 80%冰甲醇, 摇匀后放置冰箱中过夜后再过滤, 合并滤液。取10 mL滤液通过Seppar C18小柱, 弃去滤出液, 用2 mL乙腈冲洗Seppar C18小柱, 收集洗出液, 经0.45μm滤膜过滤后, 清洗液待上HPLC分析。IAA提取回收率大于90%。
1.2.4 数据统计分析数据按DUNCAN新复极差分析进行多重比较。不同小写字母表示差异显著性(P<0.05)。
2 结果与分析 2.1 嫩茎外植体不定根的诱导嫩茎(Shoots)为试管内由芽或不定芽抽生的茎, 有些研究者称之为幼茎或无根试管苗。为了便于分析单因素的作用, 本实验所用的品种为新早丰。
2.1.1 诱导生根法对嫩茎生根的影响采用1步诱导生根法诱导生根的效果很差。如果培养基中附加的生长素浓度较高, 嫩茎外植体的基部会肿大并愈伤化, 很少有根的形成, 而且长时间处理会出现茎尖坏死、叶片干枯、脱落以致全株死亡; 若降低附加生长素的浓度, 又几乎没有不定根发生。总之, 几年的试验结果表明, 采用一步诱导生根法辽宁-1号等6个供试品种的试管生根率均在30%以下。根据核桃对生长素反应的特点, 结合植物生根对外源生长调节剂需求特点, 我们研究了采用将嫩茎先放在含有生长素的培养基培养一定时间, 而后转至无外源激素的培养基中的2步诱导生根法。获得了良好的诱导生根的效果, 极显著地提高了生根率和降低了嫩茎基部愈伤化发生, 生根植株的生长状态普遍良好(图版Ⅰ-1、2)。

|
图版Ⅰ Plate Ⅰ 1.新早丰核品种试管中生根In vitro rooting for Xinzaofeng walnut cultivar. 2.辽宁1号核桃品种试管中生根In vitro rooting for Liaoning walnut cultivar. 3、4核桃试管生根苗下地移栽成活(3新早丰, 4辽宁1.) Survival of in vitro walnat rooted shoots transplanted into in -sterile soil(3Xinzaofeng, 4Liaoning). |
以下研究对诱导嫩茎生根所附加的生长调节剂的种类、浓度、处理天数及暗培养的效果进行了筛选, 方法均采用2步诱导生根法。
2.1.2 IBA的浓度和处理天数对生长素的种类和浓度研究结果表明:在暗培养条件下IBA和NAA均可诱导核桃试管嫩茎生根, 但以IBA效果更好(表 1)。
|
|
由表 1可以看出, 两步诱导生根法采用5~10 mg·L-1 IBA处理, 嫩茎的生根率没有表现出明显差异, 生根率较高。低浓度或高浓度均对生根不利。浓度过低生根率低, 浓度过高不但生根率下降而且茎基愈伤化明显, 嫩茎尖变黑, 叶片脱落。
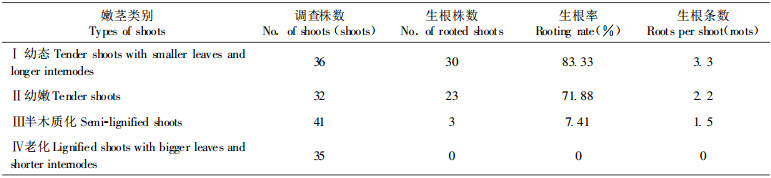
在1/4DKW基本培养基中附加5 mg·L-1 IBA, 进行黑暗处理, 其嫩茎处理的天数直接影响生根率(图 1)。图 1表明, IBA处理的最佳日数为10~15d, 生根率为73%~83%。不足10d和超过15d都对生根不利。时间短生根率低, 超过15d不仅生根率下降, 更重要的是会出现茎基愈伤化, 茎尖变黑和叶片脱落现象, 对以后的移栽会造成不利的影响。
|
图 1 IBA处理时间对核桃嫩茎生根的影响 Fig. 1 Impact of treatment time on in vitro shoot rooting for Xinzaofeng clutiva |
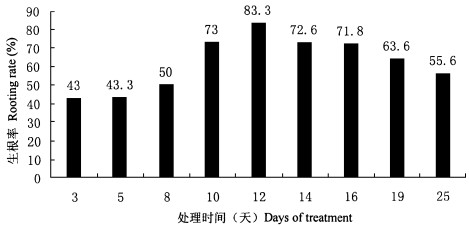
黑暗处理是诱导生根的必要条件。在对两个品种新早丰和辽宁1号的研究中发现, 在光和暗条件下各65株试管嫩茎进行生根诱导中, 光诱导的, 生根率为零; 经过暗处理, 两个品种分别有49株和53株生根, 生根率分别为75.4%和81.5%。
|
图 2 黑暗与光照条件对核桃嫩茎生根的影响 Fig. 2 Effect of dark and light on in vitro shoot rooting for walnut cultivars

|
在嫩茎外植体状态对生根影响的研究中, 根据嫩茎的表现特征, 将其分为4类:Ⅰ类(幼态茎):幼嫩, 节间较长, 叶片较小并呈嫩绿色、茎叶夹角小; Ⅱ类(幼嫩嫩茎):与Ⅰ类相比苗的状态更为幼嫩, 节间更短, 叶片和茎叶夹角更小; Ⅲ类(半木质化嫩茎):与Ⅰ类相比苗的状态老化, 茎部半木质化, 节间较长; Ⅳ类(老态嫩茎)与Ⅲ类相比苗的状态更老化, 叶片呈淡黄色, 节间较短, 茎叶夹角较大。取4类表观不同、具有不同发育状态的嫩茎进行不定根诱导, 其生根率表现出很大差异(表 2)。
|
|
Ⅰ类生长旺盛的幼态嫩茎生根率最高, 达83.3%; Ⅱ类嫩茎次之, 生根率71.88%; Ⅲ类半木质化茎生根率明显降低, 为7.41%; Ⅳ类老态黄化茎, 很难诱导生根, 生根率为零。因此欲获得较高的生根率必须调整好嫩茎的生长状态。在保证生长充实的基础上, 获得生长旺盛、发育阶段处于幼态的嫩茎是诱导不定根发生的前提条件。
2.4 品种间试管苗生根的差异和移载在满足试管嫩茎生根的条件下, 进行了早实核桃品种根诱导试验, 结果见表 3。
|
|
表 3表明:不同品种试管嫩茎的生根率存在差异, 其中以元丰、新早丰和辽宁-1号生根率最高, 上宋、维纳、强特勒为生根率中等。品种间生根条数差异不显著, 说明应用上述方法诱导早实核桃品种生根可以获得较好的生根效果。生根的嫩茎已成功地进行了下地移栽(图版Ⅰ-3、4)
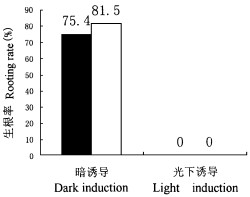
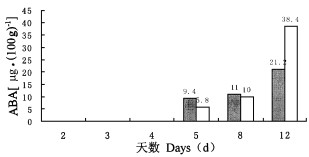
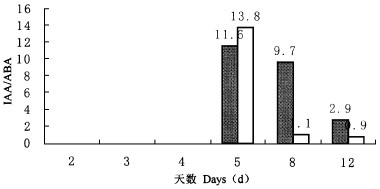
2.5 光照和暗培养下嫩茎诱导生根过程中内源IAA和ABA含量变化外植体新早丰核桃试管内幼态嫩茎在MS培养基中附加IBA 5.0 mg·L-1, 置于光和暗两种条件下, 培养初期隔1~2 d取材1次, 5 d以后隔3~4 d取材1次, 直到第12 d。测定结果见图 3、4、5。
|
图 3 在光或暗培养条件下IAA含量的变化 Fig. 3 Change of IAA in root-induced shoots under light and dark conditions for Xinzaofeng cultivar
|
|
图 4 在光或暗培养下ABA含量的变化 Fig. 4 Change of ABA in shoots inducing rooting under light and dark conditions for Xinzao feng cultivar

|
|
图 5 光或暗培养条件下嫩茎IAA/ABA的变化 Fig. 5 Change of IAA/ABA in shoots inducing rooting under light and dark conditions for Xinzaofeng cultivar

|
从图 3可以看出: (1)在光照培养下, 嫩茎内源IAA会迅速升高, 其高峰为第5~8 d, 变化曲线呈圆头型; (2)在暗培养下, 第2~3 d IAA含量未检测到。而第4 d开始水平升高, 第5 d达到高峰, 第8 d下降, 第12 d又有所回升, 变化曲线峰呈尖顶型, 且呈双峰; (3)在光照培养条件下, 嫩茎内源IAA含量始终高于在暗培养条件下。
图 4表明: (1)不论是光培养或暗培养, 在嫩茎中最初4 d均检测不到ABA; (2)从第5 d开始嫩茎ABA含量逐渐上升, 而且暗培养比光培养上升得快。
为了解IAA和ABA二者平衡对嫩茎生根的影响, 将IAA/ABA比值变化绘成图 5。结果表明, 在光培养第2、3 d, 由于ABA为零或较少, IAA/ABA的值较高, 第5 d为11.6, 随后不断下降, 到12 d时为2.9;在黑暗条件下由于IAA极低或为0, 因此诱导第2~4 d IAA/ABA值为0, 第5 d为13.8;第6 d急剧下降为1.1, 到12 d为0.9, IAA/ABA急剧下降主要是由于嫩茎内ABA含量提高得比较快。
3 讨论 3.1 试管嫩茎根器官发生与内外源生长素的关系核桃是较难发生不定根的树种(郗荣庭等, 1996; 陈正华等, 1986; Gale et al., 1988)。虽然在生根方面已开展了大量研究, 但对其难生根的机制还缺乏深入的了解(Berros et al., 1993)。在核桃品种的继代培养中发现, 核桃是对生长素类物质较为敏感而对细胞分裂素类物质不敏感的树种。试管继代培养仅需附加极其微量的IBA(0.001mg·L-1), 但不含IBA却不能获得继代效果。如果附加生长素的浓度稍高, 不但试管嫩茎增殖受到影响, 培养的材料会产生明显的愈伤化。在试管诱导核桃生根中发现采用较高浓度生长素进行长时间的诱导, 试管嫩茎的茎基部极易肿大并愈伤化, 常导致诱导失败。植物不定根的形成是一系列组织分化顺序性累积的结果:首先表现在某一特定组织的细胞脱分化, 进行有序的分裂并分化出根原基和进一步发育和生长。这一过程可划分为4个阶段:诱导期、根原基发端期、根发育和伸长期。每个阶段各有其生理生化特征及其相应的调控因素。Christine (1991)在对烟草器官发生过程详尽的研究中发现, 器官的发生需要外源生长调节剂的诱导, 而器官原基的生长发育并不依赖于外源生长调节剂。鉴于前人的研究结果和核桃对外源生长素类物质反应较敏感的特点, 我们采用了两步诱导生根法, 首先利用高浓度的生长素启动根原基的发生, 而后转移至无生长素的培养基使根原基生长发育。实验证明这一诱导方法成功地实现了核桃试管嫩茎生根, 并获得了较高的生根率。这一方法也为其它难于诱导生根的树种(如板栗)提供了借鉴。
外源生长调节剂可改变内源激素的水平, 通过调节内源激素平衡进而对细胞分化和发育发挥作用。生长素具有调节细胞分裂周期实现细胞的有序分裂, 与根原基发端密切相关。通常用于不定根诱导的生长素类物质为IBA。他人研究发现, IBA诱导不定根的主要方式是通过转化为IAA而起作用的(谷瑞升等, 1999), 本研究获得了一致的结果, 再次证实了无论在光照还是黑暗条件下外源IBA均可诱导核桃嫩茎的内源IAA和ABA升高, 改变了嫩茎内源激素平衡状况, 进而促进不定根的发生。
生根试验表明, 光照条件下试管嫩茎生根率很低, 而黑暗条件下生根率较高。比较两者在内源IAA、ABA和IAA/ABA变化, 发现黑暗培养具有较高生根率, 可能与下列变化有关:第1, 在黑暗条件下, 内源IAA在第8 d出现峰值下降后第12 d水平又开始升高, IAA再次升高可能与根原基的发育有关; 第2, 在光照条件下, 内源IAA变化曲线为圆头峰, 而暗处理为尖头峰, 表明光照条件下嫩茎对外源IBA反应快。第3, 从第5~12 d, 在光培养嫩茎内的ABA含量提高了2.4倍, 而在黑暗下培养却提高了6.6倍。内源激素与植物组织和细胞的生长、分裂和发育联系密切, 内源激素水平及激素间平衡的改变间接说明了植物生理代谢方式的改变。然而上述证据并不能完全解释为什么光照条件会对不定根产生抑制作用。光照抑制不定根的发生是一个非常复杂而又有趣的现象。在对其它树种如板栗、杏属、橄榄、枣等研究中也发现暗处理插条黄化后易生根(MoCown, 1988)。因此这一问题尚需深入研究。
3.2 试管嫩茎的发育状态与生根的关系大量研究结果表明, 树木发生不定根的难易首先取决于基因型, 受本身遗传因素决定, 表现在不同树种和同一树种不同个体间发生不定根能力差异悬殊。除本身遗传因素外, 不定根的发生与树木的发育状态密切相关, 幼龄态较成龄态较易诱导发生不定根。现已证实采取人工措施可使成龄树体复幼, 恢复其不定根发生能力。这些复壮措施包括对成龄树木进行重剪以促发萌蘖, 诱发树干基部产生不定枝、将成龄组织或器官嫁接至幼龄砧木上以及试管内连续多次继代培养等(Morgan, 1997)。其中试管内连续多次继代培养的措施对树木嫩茎复幼是有效的。受遗传因素决定, 核桃属于较难发生不定根的树种, 同时早实核桃品种其组织具有较高的阶段发育年龄, 因此其生根更难。试验材料是经过了4 a继代培养, 使嫩茎不断幼化, 这可能是获得较高的试管诱导生根率的重要原因, 今后应当对不同继代时期与嫩茎生根的关系进行细致的研究, 提出继代复幼临界期, 用于指导核桃组培生产。另外, 目前对长期的继代培养使成龄树嫩茎复幼进而提高生根率的机制还不清楚, 这一方面尚需开展大量研究。
陈正华主编.木本植物组织培养及其应用.北京: 高等农业出版社, 1986, 456~465
|
谷瑞升, 蒋湘宁, 郭仲琛. 1999. 植物离体培养中器官发生机制的研究进展. 植物学通报, 16(3): 171-177. |
刘淑兰, 韩碧文. 1986. 核桃(Juglans regia L.)的离体繁殖. 北京农业大学学报, 12(2): 113-117. |
裴东, 奚声珂. 1998. 核桃早实品种微枝接穗试管扩繁技术的研究. 林业科学研究, 11(4): 350-354. DOI:10.3321/j.issn:1001-1498.1998.04.002 |
郗荣庭, 张毅萍主编.中国果树志核桃卷, 北京: 中国林业出版社, 1996, 20~27
|
Ana Rguez, Tarrazo J, Lgnacio de bsebastian Angeles, et al. 1993. Influence of the phenological state of field grownwalnut buds on their in vitro establishment. Acta Hoticulture, 311: 153-156. |
Berros B, Astorga R, Rey M, et al. 1993. Rooting studies on "in vitro" walnut Tissues: Aging effect. Acta Horticulture, 311: 105-116. |
Christine H, Vendrig J C, Onckelen H V. 1991. The accumulation and metabolism on plant growth regulators during organogenesis in cultures of thin cell layers of Nicotiana tabaccum. Physiol. Plant, (83): 578-584. |
Driver J A, Kuniyukoi A H. 1984. In vitro propagation of Paradox walnut rootstock. Hort Science, 19(4): 507-509. |
Duroux L, Fontaine E, Breton C et al. Histological and biochemical characterization of adventitious root formation inwalnut cotyledon fragments, In: Biology of Root Formation and Development(Eds by Altman & Waisel). New York: Plenum Press, 1997(9): 75~84
|
Gale M, Charles A L.In vitro propagation of mature persian walnut cultivars Hortscience, 1988, 23(1) : 220
|
Jay-Allemand C, Peng S, Capelli P, et al. 1993. Micropropagation of hybrid walnut tree. Acta Horticulture, 311: 117-123. |
Mo Cown B H. 1988. Adventitious rooting of tissus information. In:Adventitious root formation in cuttings (Eds by Davis T D, Haissig B E and Sankhla N). Portland or USA: Dioscorides Press, 189-302.
|
Morgan C S, CarmenS M. 1997. Improving micropropagation conditions for adult-phase shoots of chestnut. Journal of Horticultural Science, 72(3): 433-443. DOI:10.1080/14620316.1997.11515531 |
Welander M. 1983. In vitro rooting of the apple rootstock M26 in adult and rejuvenate growth phases and acclimatization of the plantlets. Physiologia Plantarum, (58): 231-8. |
 2002, Vol. 38
2002, Vol. 38