文章信息
- 范国强, 翟晓巧, 刘心诚, 蒋建平.
- Fan Guoqiang, Zhai Xiaoqiao, Liu Xincheng, Jiang Jianping.
- 不同种泡桐叶片愈伤组织诱导及其植株再生
- CALLUS INDUCTION FROM PAULOWNIA PLANT LEAVES AND THEIR PLANTLET REGENERATIONS
- 林业科学, 2002, 38(1): 29-35.
- Scientia Silvae Sinicae, 2002, 38(1): 29-35.
-
文章历史
- 收稿日期:2001-10-24
-
作者相关文章
2. 许昌林业技术推广站 许昌 461000
2. Xuchang Forestry Popularization Station, He' nan Province Xuchang 461000
近年来, 国内外科学工作者利用生物技术得到了多种林木的愈伤组织或原生质体的再生植株(包慈华, 1979;黄健秋等, 1995;黄敏仁等, 1990;姜国武, 1988;唐巍等, 1998;王善平等, 1988, 1990;王影等, 1991; 1993; 1995;卫志明等, 1991; 1992;诸葛强等, 2000; Becwer et al., 1990; Gupta et al., 1987; Hakman et al., 1987; Laine et al., 1990; Schenk et al., 1972; Von Arnold et al., 1988)。愈伤组织再生植株培养是林木原生质体植株再生和利用原生质体培育转基因苗不可缺少的重要环节。泡桐为我国的重要速生用材树种, 虽然有人对白花泡桐原生质体再生植株作过研究, 但形成愈伤组织后没有成功获得其大量的完整再生植株(卫志明等, 1991), 并且不同种泡桐原生质体愈伤组织诱导和植株再生等方面存在一定的差异。本文研究了不同种泡桐叶片愈伤组织诱导及其再生植株的培养条件, 为不同种泡桐融合的原生质体愈伤组织诱导及其植株再生提供参考。
1 材料与方法 1.1 试验材料材料为1998 -09采于河南省郑州市的毛泡桐[ Paulownia tomentosa (Thunb.)Steud]、南方泡桐(P.australis Gong Tong)、白花泡桐[ P.fortunei (Seem)Hemsl]、兰考泡桐(P.elongata S.Y.Hu)和豫杂一号泡桐(P.tomentosa ×P.fortunei)的种子。
1.2 试验方法 1.2.1 泡桐无菌苗培养将上述5种泡桐种子分别用70 %的酒精消毒30 s后, 再用0.1 %的HgCl2消毒5min, 然后用无菌水冲洗5次, 放置于不含激素的PC培养基上在培养箱内培养。80d时, 可获得6 ~ 8叶龄的泡桐无菌苗, 取其叶片作愈伤组织诱导的材料。
1.2.2 泡桐叶片愈伤组织诱导培养基的筛选采用1 2MS、MS、B5、N6和PC 5种基本培养基, 附加一定量的NAA, 6-BA(以下简写为BA, 单位为mg·L-1, 下同)、蔗糖(2.5 %)、琼脂粉(0.8%)。将不同种的泡桐无菌苗的叶片切成约0.5 cm×1.0 cm的块(外植体), 放入三角瓶中(每种放10瓶, 每瓶3块外植体), 在温度为25℃±2℃暗培养箱内诱导愈伤组织。每隔两天观察1次, 待愈伤组织长到一定体积时, 移到光照强度为130 μ mol·m -2s-1、光照时间为16 h·d-1、温度为25 ℃±2 ℃的培养箱内继续培养。第20 d时观察叶片愈伤组织的诱导情况, 根据诱导率的大小, 确定叶片愈伤组织诱导的基本培养基和最适培养基。
1.2.3 芽分化最适培养基的筛选将诱导产生的5种泡桐叶片愈伤组织分别切成约1.0 cm3的小块, 放在MS附加0.1 ~ 1.1NAA和2 ~ 12BA的芽分化培养基上, 于光照条件下进行芽的分化(培养条件同上)。每种20瓶, 每瓶1块。第20 d时观察芽的分化情况, 并计算其芽分化率。
1.2.4 根诱导最适培养基的筛选将诱导的芽从其茎的基部剪断并转移到生根培养基上, 放入光照培养箱内进行根的诱导。第20d时观察生根情况(培养条件同上), 筛选出不同种泡桐根诱导的最适培养基。
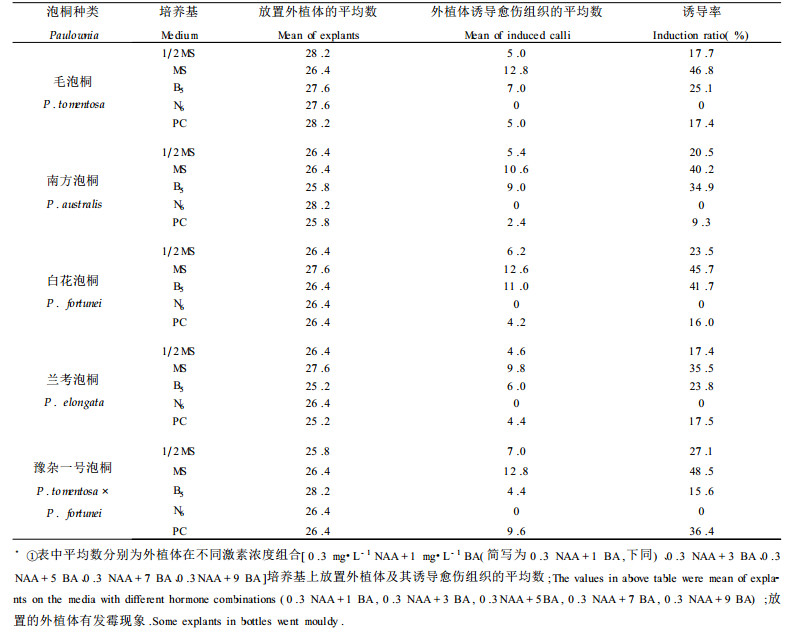
2 结果与分析 2.1 不同种泡桐叶片在不同培养基上愈伤组织的诱导从5种泡桐叶片在不同培养基上愈伤组织的诱导结果(表 1)可以看出, 毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐叶片在MS、1 2MS、B5、PC培养基上都有一定量的愈伤组织形成, 但诱导率随其种类不同而表现出一定的差异。毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐叶片在MS培养基上的诱导率都最高, 分别为46.8 %、40.2 %、45.7 %、35.5 %和48.5 %; 而在N6培养基上, 5种泡桐叶片皆没有愈伤组织形成。也就是说, 不同种泡桐叶片愈伤组织的形成随培养基的不同而有很大的变化。MS培养基可作为5种泡桐叶片诱导愈伤组织的基本培养基。
|
|
毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐叶片在不同激素浓度的MS培养基上愈伤组织的诱导结果(表 2)表明, 在NAA浓度为0.1时, 诱导率随BA浓度的升高而下降; 在NAA浓度为0.3 ~ 0.7时, 诱导率随BA浓度的升高大致呈先上升再下降的趋势; 在NAA浓度为0. 9 ~ 1.1时, 在6种BA的浓度组合中诱导率几乎为0。不同种泡桐叶片在MS培养基上愈伤组织的诱导结果见图版Ⅰ-A ~ E.
|
|
表 3表明, 毛泡桐叶片愈伤组织的芽分化率随激素浓度的变化而不同。当NAA的浓度在0.1时, 芽分化率随BA浓度的升高而下降; 当NAA的浓度为0.3 ~ 0.7时, 芽分化率随BA浓度的升高而升高; 而当NAA的浓度为0.9 ~ 1.1时, 不同BA的浓度组合中, 芽分化率为0。当BA浓度为8时, 随着NAA浓度的增加, 叶片愈伤组织的芽分化率逐渐减小; 当BA浓度为10和12时, 叶片愈伤组织芽分化率随NAA浓度增加呈先升高而后下降的趋势, 但二者随BA浓度增加, 叶片愈伤组织芽分化的数量存在着差异。从芽分化率看, 毛泡桐叶片愈伤组织在MS +0.3NAA +12 BA培养基上芽分化率最高。因此, 选此培养基为毛泡桐叶片愈伤组织芽分化的最适培养基。毛泡桐芽分化情况见图版Ⅰ-F。
|
|
南方泡桐叶片愈伤组织在NAA浓度为0.1时, 芽分化率随着BA浓度的升高而降低, 在NAA浓度为0.3时, 随BA浓度的升高而升高; 在NAA浓度为0.5 ~ 0.7, BA浓度为8 ~ 12时, 芽分化率较低; 当NAA的浓度为0.9 ~ 1.1时, 在BA的3个浓度组合中, 芽分化率均为0。在MS +0.3NAA +12 BA的培养基上, 南方泡桐叶片愈伤组织芽分化率最高。南方泡桐芽分化情况见图版Ⅰ-G。
白花泡桐叶片愈伤组织在0.3 ~ 0.5NAA +10 ~ 12 BA的激素浓度组合中有较高的芽分化率。当NAA的浓度在0.9 ~ 1.1范围时, 分别在BA的3种浓度组合培养基上芽分化率均为0。从分化率的高低看, MS +0.5NAA +12 BA的分化率最高达100 %, 其次是MS +0.3NAA +12 BA培养基, 芽分化率达95. 0 %, 其芽分化情况见图版Ⅰ- H。
兰考泡桐叶片愈伤组织NAA浓度为0.1、0.3和1.1时, 与3种BA浓度的组合中, 芽分化率均为0。在0.5 ~ 0.9 NAA +12 BA的激素浓度组合中有芽分化, 其中在MS +0.5NAA +12 BA的培养基上, 芽分化率最高达90.0 %, 因此, 可选择此培养基为兰考泡桐叶片愈伤组织诱导芽分化的最适宜培养基。其芽分化情况见图版Ⅰ-Ⅰ。
豫杂一号泡桐叶片愈伤组织在0.3 ~ 0.9NAA +10 ~ 12 BA的激素浓度组合范围内均有芽分化。其中以0.7NAA +12 BA的激素浓度组合芽分化率最高90.0 %。而NAA浓度为0.1、1.1时与BA的浓度组合中芽分化率均为0。因此, 可选择MS +0.7NAA +12 BA培养基为豫杂一号泡桐愈伤组织芽分化的最适宜的培养基。其芽分化情况见图版Ⅰ-J。
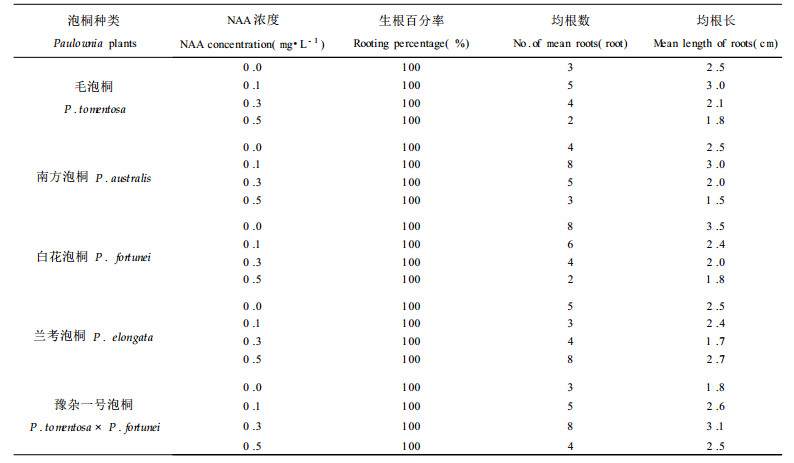
2.4 不同种泡桐诱导芽的根分化从5种泡桐叶片愈伤组织诱导出的芽的茎的基部剪断, 放入NAA浓度不同的1 2MS(改良的MS)培养基中, 第20d时观察其生根情况(图版Ⅰ-K ~ P), 并统计5种泡桐诱导芽的生根数及其长度(表 4)。毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐芽在生长素浓度为0、0.1、0.3和0.5的培养基上培养, 其生根率都可达到100 %, 这可能是由于不同种泡桐的芽诱导过程中, 其体内含有较高浓度生长素的缘故。但是, 不同种泡桐在不同生长素浓度培养基上, 生根的数量和长度存在着一定的差异。根据不同种泡桐诱导芽生根的多少及其长度可以认为, 毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐叶片愈伤组织诱导芽生根的最适培养基分别为1 2 MS +0.1 NAA、1 2MS +0.1NAA、1 2MS、1 2MS + 0.5NAA和1 2MS +0.3NAA。
|
|
植物组织或器官诱导愈伤组织的最适培养基随植物属、科和种的不同而有所差异。水稻和小麦等禾本科植物的组织或器官在加有适量浓度激素的N6培养基上能够诱导出愈伤组织(陈英等, 1980), 粉蓝烟草、矮牵牛和悬铃木在MS培养基上诱导出了大量愈伤组织(孙勇如等, 1982; 1991)。毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐叶片在以MS培养基为基本培养基上的愈伤组织诱导率比较高, 在1 2MS、B5和PC培养基上的诱导率较低, 而在N6培养基上无愈伤组织形成(表 1)。因此, 我们选择MS培养基为5种泡桐叶片诱导愈伤组织的基本培养基, 这与以前报导的泡桐快速繁殖采用的培养基相一致(何泼等, 1999;姜国武, 1988;施士争等, 1995;单雪艳, 1992)。由于植物种(品种)之间的遗传差异, 其体内的代谢活动也不尽相同, 特别是激素含量的差异, 导致了不同种(品种)植物器官或组织诱导愈伤组织所需培养基内激素水平的不同(黄敏仁等, 1990;卫志明等, 1991; 1992; Emily, 1991; Julie, 1986; Sticklen, 1986; Von Arnold et al., 1988)。毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐虽为同属植物, 并且南方泡桐、兰考泡桐和豫杂一号泡桐皆为毛泡桐和白花泡桐的杂交种(Fan et al., 2001), 但由于长期的自然进化, 引起体内基因发生变异, 从而使不同种之间的物理性状和生理生化代谢水平及激素含量出现差异, 因而要求培养的条件也有所不同。这可能就是导致毛泡桐、南方泡桐、白花泡桐、兰考泡桐和豫杂一号泡桐诱导叶片愈伤组织最适培养基不同原因所在。
包慈华. 1979. 海岸红杉组织培养诱导完整植株的初步研究. 科学通报, 24(7): 321-323. |
陈英, 等. 1980. 水稻游离花粉粒培养诱导形成植株的研究. 中国科学, 7(1): 46-54. |
单雪艳. 1992. 植物细胞培养与遗传操作. 北京: 科学出版社, 440-448.
|
何泼, 等. 1999. 泡桐遗传转化系统的建立. 山东大学学报(自然科学版), 34(3): 332-338. |
黄健秋, 等. 1995. 马尾松成熟合子胚的体细胞胚胎发生和植株再生. 科学通报, 40(1): 72-75. DOI:10.3321/j.issn:0023-074X.1995.01.023 |
黄敏仁, 等. 1990. 林木原生质体培养的现状. 植物生理学通讯, (2): 75-78. |
姜国武. 1988. 经济植物组织培养. 北京: 科学出版社, 216-220.
|
施士争, 等. 1995. 泡桐组织培养系统性研究初报. 江苏林业科技, 22(3): 20-22. |
孙勇如, 等. 1982. 粉蓝烟草与矮牵牛的属间体细胞杂种植株的再生. 遗传学报, 9(4): 284-288. |
孙勇如. 1991. 植物原生质体培养. 北京: 科学出版社, 116-122.
|
唐巍, 等. 1998. 火炬松胚性愈伤组织诱导和植株再生的研究. 林业科学, 34(3): 115-119. DOI:10.3321/j.issn:1001-7488.1998.03.017 |
王影, 等. 1993. 林木原生质体培养研究进展. 南京林业大学学报, (7): 91-95. |
王影. 1991. 杨树细胞悬浮培养及体细胞胚胎发生的研究. 南京林业大学学报, 15(3): 31-36. |
王影, 等. 1995. 小叶杨原生质体培养植株再生及其同工酶的变化. 林业科学, 31(4): 310-318. DOI:10.3321/j.issn:1001-7488.1995.04.001 |
王善平, 等. 1988. 木本植物的原生质体培养. 细胞生物学杂志, 11: 14-18. |
王善平, 等. 1990. 毛白杨的叶肉原生质体培养再生植株. 中国科学(B辑): 1260-1263. |
卫志明, 等. 1991. 悬铃木叶肉原生质体培养再生植株. 植物学报, 33(11): 813-818. |
卫志明. 1992. 桑树叶肉原生质体培养再生植株. 植物生理学通讯, 28(4): 248-249. |
卫志明, 镰田博·原田宏. 1991. キリ(Paulownia fortunei) のブロトガの植物体再生. 植物组织培养, 8(2): 111-113. |
诸葛强, 等. 2000. 杨树体细胞融合研究. 南京林业大学学报, 24(2): 6-10. DOI:10.3969/j.issn.1000-2006.2000.02.002 |
Becwar MR, Nagmani R, et al. 1990. Initiation of embryogeni cultures and somatic embryos development in loblolly pine. Can. J. For. Res., 20: 80-81. |
Emily E C. 1991. Plantlet multiplication from white pine (Pinus strobus L.)embros in vitro:bud induction and rooting. Plant Cell, Tissue and Organ Culture, 26: 107-114. DOI:10.1007/BF00036114 |
Fan Guoqiang. 2001. Protein diversity of Paulownia plant leaves and clusters. Journal of Forestry Research, 12(1): 21-24. DOI:10.1007/BF02856794 |
Gupta P K, Durzan D J. 1987. Biotechnology of somatic polyembryogenesis and plantlet regeneration in loblolly pine. Biotechnology, 5: 147-151. |
Hakman I, Fowke L C, et al. 1985. The development of somatic embryos on tissue cultures initiated from immature embryos of Picea abies. Plant Sci., 38: 53-59. DOI:10.1016/0168-9452(85)90079-2 |
Hakman I, Fowke L C. 1987. Somatic embryogenesis in Picea glaua and Picea mariana. An. J. Bot., 65: 656-659. |
Julie A. 1986. Techniques for enhanced release of leaf protoplast in Populus. Plant Cell Reports, 5: 284-287. DOI:10.1007/BF00269823 |
Laine E, David A. 1990. Somatic embryogenesis in immature embryos and protoplast of Pinus caribaea. Plant Sci., 69: 215-224. DOI:10.1016/0168-9452(90)90120-D |
Schenk R U, Hildebrant A C. 1972. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Can. J. Bot., 50: 199-204. DOI:10.1139/b72-026 |
Sticklen M B. 1986. Shoot regeneration from protoplasts of Ulmus×Pioneer. Plant Science, 47: 29-34. DOI:10.1016/0168-9452(86)90007-5 |
Von Arnold S, Woodward S. 1988. Organpgenesis and embryogenesis in mature embryos of Picea sitchensis. Tree Physiol., 4: 291-300. DOI:10.1093/treephys/4.3.291 |
 2002, Vol. 38
2002, Vol. 38