文章信息
- 郭文硕.
- Guo Wenshuo.
- 锥栗对栗疫病的抗性与苯丙氨酸解氨酶的关系
- THE RELATIONSHIP BETWEEN THE CHESTNUT RESISTANCE TO BLIGHT AND PHENYLALANINE AMMONIALYASE (PAL)
- 林业科学, 2001, 37(专刊1): 90-93.
- Scientia Silvae Sinicae, 2001, 37(专刊1): 90-93.
-
文章历史
- 收稿日期:2001-01-08
-
作者相关文章
苯丙氨酸解氨酶(PAL)是植物体内苯丙烷类物质代谢的关键酶, 而苯丙烷类代谢又是形成咖啡酸、绿原酸、类黄酮和木质素等多种抗菌物质的主要途径(Lowell et al., 1966)。许多研究指出, 植物受病原菌侵染后, PAL活性有所提高, 同时伴随木质素、绿原酸合成的增加(Norman et al., 1975; Friend et al., 1973; 杨家书等, 1986; 胡景江等, 1992; 王敬文等, 1982), 表明PAL在植物抗病性中的地位。本研究选择了4个不同抗性的锥栗[Castanea henryi (Skan) Reld. et Wils.]品种, 测定其受栗疫菌[Cryphonectria parasitica (Murr.) Barr.]侵染后PAL比活力的变化和苯丙酸类代谢产物木质素、绿原酸的差异, 以及绿原酸对栗疫菌生长的影响, 试图探讨锥栗抗栗疫病的机制。
1 材料和方法 1.1 试验材料在福建南平福建林学院西芹教学林场锥栗品种试验地内, 选取抗病品种小毛榛(C10)、中抗品种薄壳子(C6)、中感品种乌壳长芒(C5)和感病品种黄榛(C7)、作为测试材料。于接种前和接种后48 h, 72 h, 96 h, 120 h, 144 h和168 h分别取样测定, 取样部位为离接种点0~1 cm处的组织。
1.2 接种体的制备和接种方法在福建省建瓯市水源乡和龙村乡采集锥栗病枝干上的栗疫菌子座, 用1g·L-1升汞溶液消毒2~3 min, 用无菌水漂洗2~3次后置PDA培养基上, 在25℃下培养, 得菌种纯化在试管斜面培养基上, 置4℃下保存。进行人工接种时, 将菌种挑取菌块置PDAmb (每升PDA加0.1 g蛋氨酸和0.001 g生物素)平板上25℃下培养5 d后, 用内径0.6 cm打孔器切下菌块备接种用.采用室内水培枝条人工接种的方法(不同锥栗品种的枝条均在同等的水培条件下进行各项指标的比较测定, 其测定的结果能较准确地反映出不同锥栗品种对栗疫病的抗病性差异。)。
1.3 PAL提取和酶活力测定参照张志良(1986)和陈建中等(1997)的方法。取枝条皮层1 g鲜重, 加4.5 mL 0.1 mol·L-1硼酸缓冲液(pH8.7, 内含1×10-3 mol·L-1EDTA, 20×10-3 mol·L-1β-巯基乙醇)和少量石英砂及少许聚乙烯吡咯烷酮在冰浴中研磨匀浆, 4℃下10000 r·min-1离心30 min, 上清液用于酶活性测定。酶反应检测液组成:硼酸缓冲液3.9 mL, 酶液0.1 mL, L-苯丙氨酸(0.6×10-3mmol·L-1) 1 mL。40℃下反应60 min, 6 mol·L-1HCl终止反应。751分光光度计290 nm处测消光值的变化。以OD值变化0.01为1个活性单位。
1.4 木质素含量的测定参照X.H.波钦诺克(1981)介绍的方法。取枝条树皮0.5鲜重, 用0.5 mol·L-1硫酸—重铬酸钾溶液氧化水解样品中的木质素, 过量的重铬酸钾用0.1 mol·L-1的莫尔氏盐滴定后计算木质素含量。
1.5 绿原酸含量的测定参照杨家书等(1986)的方法。取枝条皮层2 g鲜重, 置60℃下烘至恒重, 加50倍重的乙醇提取1 h, 提取液1 mL加4 mL乙醇后, 加入0.5 g活性炭脱色, 过滤后于75l型分光光度计324 nm波长下测定吸收值, 按绿原酸标准曲线转换出绿原酸含量。
1.6 绿原酸对栗疫菌菌丝生长影响的测定PDA培养基和绿原酸母液, 经15磅压力灭菌处理30 min, 分别在灭菌培养皿中配制含绿原酸浓度为0%、0.05%、0.1%、和0.2%的10 mL PDA培养基, 移植0.6 cm直径的菌丝块, 25℃培养7 d后, 测量各菌落直径。
1.7 绿原酸对栗疫菌分生孢子萌发影响的测定在培养皿内分别加入绿原酸为0%、0.05%、0.1%、和0.2%的溶液9 mL, 再分别加入1 mL栗疫菌分生孢子液, 混匀后于25℃培养24 h, 取适量培养液镜检, 统计其孢子总数及萌发数。
1.8 蛋白质含量测定用考马斯亮蓝G-250测定蛋白质含量(管原洁等, 1981)。
以上试验均设3次重复。
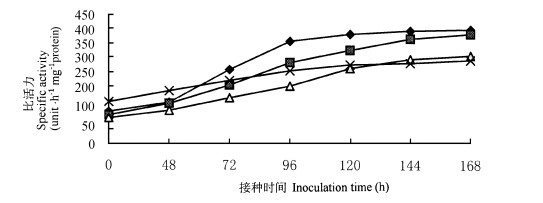
2 结果与分析 2.1 不同抗性品种PAL比活力变化从图 1可以看出, 在接种前的健康皮层组织中, PAL比活力的高低顺序为感病品种 > 抗病品种 > 中抗品种 > 中感品种, 即PAL比活力与抗感病性之间无明显相关; 各品种接种后48 h内, PAL比活力均缓慢上升; 接种后48~96 h, 抗病品种PAL比活力骤升, 96 h后趋于缓升; 中抗品种接种后48~144 h PAL比活力大幅度上升, 144~168 h趋缓; 中感品种和感病品种在接种后的整个潜育期内, PAL比活力也都有升高, 但升幅较小和较缓。从图 1也可看出接种144 h后, PAL比活力为抗病品种 > 中抗品种 > 中感品种 > 感病品种。
|
图 1 锥栗的苯丙氨酸解氨酶比活力 Fig. 1 The phenylalanine ammonialyase specific activity of Castanea henryi
 小毛榛Castanea henryi Xiaomaozheng; 小毛榛Castanea henryi Xiaomaozheng;  薄壳子Castanea henryi Bokezhi; 薄壳子Castanea henryi Bokezhi;
 乌壳长芒Castanea henryi Wukechangmang; 乌壳长芒Castanea henryi Wukechangmang;  黄榛Castanea henryi Huangzhen 黄榛Castanea henryi Huangzhen |
木质素的前体物质是PAL酶催化的苯丙酸类代谢中间产物——阿魏酸, 因而木质素的含量受PAL酶控制。从图 2可见, 未接种的健康组织中抗病性强的品种的木质素含量比抗病性弱的品种的木质素含量高; 各品种接种后, 木质素含量均上升, 但在接种72~96 h时, 抗病品种和中抗品种呈异常下降, 96 h后又缓慢上升; 在接种后的任何时间段内, 木质素含量都是抗病品种 > 中抗品种 > 中感品种 > 感病品种。

|
图 2 锥栗木质素含量 Fig. 2 The content of lignin in Castanea henryi 图例同前。Ditto. |
咖啡酸是绿原酸的前体。咖啡酸也是PAL控制的苯丙酸类代谢中间产物, 所以绿原酸的含量的变化同样受PAL酶的制约。本研究结果(见图 3)表明, 各品种接种后48 h内, 绿原酸含量均下降, 48 h后, 各品种均开始上升, 但抗病品种小毛榛在96~120 h时出现绿原酸含量的异常下降, 随后又大幅度上升。从图 3也可看出, 不论是接种前还是接种后, 绿原酸的含量与各品种的抗病性之间不呈规律性的相关。

|
图 3 锥栗绿原酸含量 Fig. 3 The content of chlorogenic acid in Castanea henryi 图例同前。Ditto. |
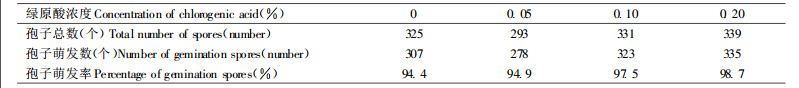
不同浓度的绿原酸抑制栗疫菌菌丝生长的测定结果(表 1)表明, 绿原酸对栗疫菌菌丝的生长有一定的抑制作用, 绿原酸含量达0.20%时, 菌丝生长受到27.7%的抑制, 但从图 3可以看出, 栗树树皮中的绿原酸含量远低于此值, 故在栗树体中其抑制作用是极小的。
|
|
从表 2可以看出, 绿原酸对栗疫菌分生孢子的萌发没有抑制作用, 但似有一定的刺激作用。
|
|
不少研究者在研究植物抗病性时发现, 植物感染病害后, 会出现PAL活性升高, 以及某些抗菌物质的积累(杨家书等, 1986; Friend et al., 1973; Green et al., 1975)。从而有的研究者提出PAL的活力大小可作为植物抗病性的生理指标。但是, 也有一些研究者则认为, 健全植物在被病菌侵染后, 为了生成一些抗菌物质, 已有的PAL已经很充分, PAL并不参与抗病反应(铃木直治等, 1985)。
本试验结果表明, 栗疫菌侵染锥栗后, PAL产生激烈的反应, 但在抗病性不同的品种中和侵染潜育期的不同时期的反应是不同的。侵染前及潜育期的初期PAL与抗感病性不相关, 而在潜育期的后期PAL抗病品种明显比感病品种高。因此, 在分析PAL在抗感病性中的作用时, 选择取样的时间非常的重要, 不同的取样时间有截然不同的实验结果。
本试验结果表明, PAL控制的苯丙酸类代谢产物木质素在锥栗对栗疫菌的抗性中起着重要的作用, 与品种的抗病性呈正相关, 可作为衡量锥栗品种抗病性的生化指标; 绿原酸在锥栗受栗疫菌侵染的潜育期内的不同时期, 其含量有的上升有的下降, 与品种的抗病性不呈规律性相关。从绿原酸对菌丝生长的影响的试验结果来看, 各个锥栗品种体内所含的绿原酸的浓度远不足以影响病原菌, 从而从另一侧面说明了锥栗体内的绿原酸含量多少与抗病性无关。从绿原酸对栗疫菌分生孢子萌发的影响看, 绿原酸有助于分生孢子的萌发, 这可能是由于低浓度的绿原酸可作为分生孢子萌发的碳源。
波钦诺克X H著(荆家海, 丁钟荣译).植物生物化学分析方法.北京: 科学出版社, 1981, 178~181
|
陈建中, 盛炳成, 刘克均. 1997. 苯丙酸类代谢与苹果对轮纹病抗性的关系. 果树科学, 14(3): 149-152. |
管原洁, 副岛正美著(张旭译).蛋白质的定量法.第二版.北京: 农业出版社, 1981, 186~188
|
胡景江, 文建雷, 景耀, 等. 1992. 杨树体内苯丙烷代谢与其对溃疡病抗性的关系. 植物病理学报, 22(2): 185-188. |
铃木直治等著, 张际中等译.近代植物病理化学.上海: 上海科技出版社, 1985, 121~123
|
王敬文, 薛应龙. 1982. 苯丙氨酸解氨酶在抗马铃薯晚疫病中的作用. 植物生理学报, 8(1): 35-43. |
杨家书, 吴畏, 吴友三, 等. 1986. 植物苯丙酸代谢与小麦对白粉病抗性的关系. 植物病理学报, 16(3): 169-173. |
张志良, 吴光耀. 1986. 植物生物化学技术和方法. 北京: 农业出版社.
|
Friend J, Regnolds S B, Aveyard W A. 1973. Phenylalanine Ammonia-lyase.Chlorogenic and lignin in potato tuber tissue inoculated with Phytophthora infestans. Physiologic Plant pathology, 3(4): 495-507. |
Green N E, Hadwiger L A, Graham S O. 1975. Phenylalanine ammonia lyase, Tyrosine ammonia lyase and lignin in wheat inoculated with Erysiphe graminisf. sp. tritici. Phytopathology, 65(10): 1071-1074. DOI:10.1094/Phyto-65-1071 |
Lowell B, Johnson B L B, Scheile F P Jr. 1966. Protein and enzyme changes in Barley leaves infected with Erysiphe graminisf. sp. hordei. Phytopathology, 56: 1405-1410. |
Norman E G, Lee A H, Shirl O G. 1975. Phenylalanine ammonia-lyase, tyrosine ammonialyase and lignin in wheat inoculated with Erysiphe graminisf. sp. tritici. Phytopathology, 65(10): 1071-1074. DOI:10.1094/Phyto-65-1071 |
 2001, Vol. 37
2001, Vol. 37