文章信息
- 杨传平, 刘桂丰, 梁宏伟, 张慧.
- Yang Chuanping, Liu Guifeng, Liang Hongwei, Zhang Hui.
- 耐盐基因Bet-A转化小黑杨的研究
- STUDY ON THE TRANSFORMATION OF POPULUS SIMONII ×P. NIGRAWITH SALT RESISTANCE GENE BET-A
- 林业科学, 2001, 37(6): 34-38.
- Scientia Silvae Sinicae, 2001, 37(6): 34-38.
-
文章历史
- 收稿日期:2001-06-25
-
作者相关文章
2. 山东师范大学 济南 250014
2. Shandong Teachers University Ji'nan 250014
土壤的盐渍化是影响农林业生产和生态环境的严重问题。全世界的盐碱地约占陆地面积的三分之一左右, 我国也有大面积的盐碱地, 仅海岸带、滩涂就达667×104 hm2, 且有逐年增加的趋势(中国统计局, 1997)。在内陆干旱、半干旱地区的不适当灌溉所产生的大面积次生盐渍化也日益严重。如何利用大面积的盐碱地、荒漠化土地和丰富的咸水资源发展农林业, 这是国际上和生物科学技术迫切需要解决的重大课题。进行盐碱地的改良日益受淡水资源的限制, 培育耐盐新品种是开发和利用盐渍地的有效方法。采用传统的方法培育耐盐新品种虽然简便可行, 但进展缓慢, 至今尚未培育出真正的耐盐品种。随着分子生物技术的发展, 人们寄希望于基因工程育种(分子育种), 力图迅速培育出具有一定耐盐性的植物新品种, 为盐渍化地区的农林业生产和生态环境建设服务。
目前, 许多研究者正在利用基因工程手段进行高效耐盐植物的培育。在一些草本植物上的研究已取得了很大的进展, 获得了数种不同耐盐途径的转基因植株。在木本植物上的耐盐转基因研究尚不多见报道。
小黑杨(Populus simonii×P. nigra)是黑龙江省在20世纪70~80年代曾主推广的一个优良树种, 具有速生和较强抗寒能力的优良品性。我们在完成了东北主要树种及灌木抗盐碱性生理指标测定及抗性机理的观察、树种抗盐能力分析、分级及排序、树种在不同盐胁迫下生长差异分析等工作的基础上, 以小黑杨为转化受体材料, 进行耐盐基因的遗传转化工作。通过根癌农杆菌(Agrobacterium tumefacien)介导将胆碱脱氢酶基因Bet-A导入小黑杨中, 建立了遗传转化系统, 获得了转化子。
1 材料和方法 1.1 材料 1.1.1 植物材料小黑杨(P. simonii×P. nigra)取自东北林业大学校园内的优良无性系。
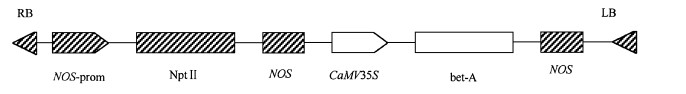
1.1.2 菌种本研究所用的含Bet-A基因中间表达载体prok Ⅱ质粒, 含植物表达载体的根癌农杆菌AGL1均由山东师范大学惠赠。外源基因Bet-A在植物表达载体上的结构如图 1所示。
|
图 1 Ti表达载体上的Bet-A基因结构图 Fig. 1 The structural drawing of Bet-A in Ti expression vector |
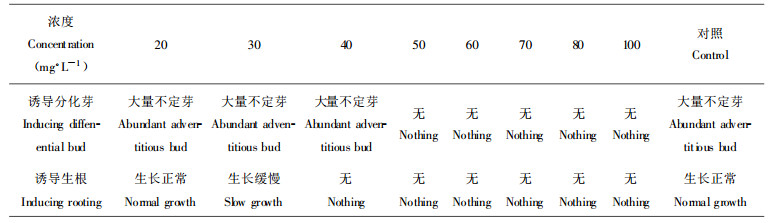
在春季选取室外成年大树中下部的新生嫩叶为外植体, 消毒灭菌后切成0.5 cm×0.5 cm的小块, 然后分别接种到设计好的各组培养基上。根据预备试验和前人研究, 以MS为基本培养基, 设计附加植物激素的试验: BA的激素水平分别为0.1 mg·L-1、0.2 mg·L-1、0.5 mg·L-1、1.0 mg·L-1、1.5 mg·L-1 5个水平; NAA的激素水平分别为0.01 mg·L-1、0.02 mg·L-1、0.05 mg· L-1、0.1 mg·L-1、0.2 mg·L-1、0.3 mg·L-1 6个水平, 连同不加激素的对照共31个处理组合。每个处理组合有10瓶, 每瓶接种4块小叶片。在25 ℃±2 ℃、光照13 h·d-1下培养3周后进行小叶片的生长分化调查, 记录分化的叶片外植体块数, 每块小叶片分化不定芽的数目、不定芽的生长情况等。根据调查的结果进行比较, 从而筛选出小黑杨芽分化和增殖的最适宜培养基。然后进行生根培养基的筛选和卡那霉素敏感性试验。
1.2.2 菌种的活化和工程菌液的制备在含有50 mg·L-1卡那霉素(Kan)和50 mg·L-1利福平(Rif)的LB或YEB平板培养基上划线培养根癌农杆菌, 28 ℃下培养2~3 d。从平板上挑取单菌落, 接种在含上述抗生素的液体培养基中, 28 ℃下振荡培养至OD600值为0.6~0.8时即可。
取培养好的菌液在4000 r·min-1下离心5 min收集菌体, 用不含激素的MS液体培养基重悬稀释至OD600为0.2~0.4左右待用。也可取少量菌液用MS液体培养基稀释后继续振荡培养至OD600为0.2~0.4左右待用(可添加100~500 μmol·L-1的乙酰丁香酮诱导转化)。
1.2.3 叶盘法侵染转化选取无菌苗上充分展开的、深绿色的、大小形状基本一致的叶片, 从而使其在生理、生化状态上基本保持一致。将其切成0.5 cm×0.5 cm的小叶块, 在不含选择剂的分化培养基上预培养2~3 d。然后将其浸泡在制备好的工程菌液中5~20 min左右, 在这一过程中可轻轻摇动, 使每一叶切片均能与根癌农杆菌充分接触。取出后用无菌滤纸将多余的菌液吸干。先将其置于不含选择剂的分化培养基上共培养3 d, 再转置于含50 mg·L-1卡那霉素、300~500 mg·L-1的头孢霉素的脱菌分化培养基上脱菌选择培养, 每15 d继代1次。在光照下培养, 室温在25 ℃±2 ℃。20~25 d后开始分化产生不定芽。
1.2.4 转基因植株的检测(1) 转化苗的叶片再生实验:取转化再生苗的叶片(较大的、伸展开的), 在叶背面划数道伤口, 然后接种在含50 mg·L-1卡那霉素的分化选择培养基上。取未转化对照苗做同样的处理接种在选择培养基和非选择培养基上, 观察其生长分化情况。(2)聚合酶链式反应(PCR)检测:植物总DNA的提取采用CTAB法从幼嫩的叶片中提取(王关林, 1998)。阳性对照为含有中间表达载体的prok Ⅱ质粒, 提取方法是SDS-碱解法(顾红雅等, 1995)。
PCR扩增引物为:
5′端引物 5′-ATCGATTCTAGACCCGGGATGCAATTTGACTACATCATTATT-3'
3′端引物 5′-GATATCGAGCTCAACTCTCAATTCTGATCGGTTCCTGC-3′
以prok Ⅱ质粒上的目的基因片段为阳性对照, 以未经转化苗的总DNA为阴性对照, 对转化苗的DNA样品进行PCR扩增检验。反应体系为(总体积20 μL): 10×Buffer 2.0 μL, dNTP (10 mmol·L-1)0.3 μL(终浓度为0.15 mmol·L-1), 3′引物2.0 μL(终浓度为1 μmol ·L-1), 5′引物2.0 μL(终浓度为1 μmol· L-1), MgCl2 1.6 μL(终浓度2.0mmol·L-1), 模板DNA 2.0 μL, Taq DNA聚合酶(5U·μL-1) 0.2 μL, 去离子水9.9 μL。反应是在0.2 mL的微量离心管中进行的, 反应程序为: 94 ℃预变性5 min, 94 ℃变性1 min, 56 ℃变性1 min, 72 ℃扩增2 min, 72 ℃延伸7 min, 共30个循环。(3) Southern杂交检测: Southern杂交检测是采用Boehringer公司的DIG DNA Labeling and Detection Kit进行的。首先从prok Ⅱ质粒上获取目的基因全长片段, 然后对其进行地高辛标记, 使其成为标记探针, 即可以进行下一步的Southern斑点杂交和印迹杂交(王关林, 1998)。杂交完成以后, 利用试剂盒的一系列的检测试剂进行免疫检测, 通过颜色反应可以显示出杂交的结果。
2 结果与分析 2.1 叶片外植体组培系统的建立 2.1.1 诱导不定芽的产生将切好的小叶块置于最适宜的培养基上, 在培养室光照条件下培养, 叶片为绿色、变厚长大, 切口处发生轻微的愈伤组织, 随后开始产生不定芽, 最早5~10 d即可见到, 20 d后形成大量不定芽。通过对各个处理水平的生长情况比较, 最终确定小黑杨叶片分化再生的最适宜培养基为MS+0.5 mg·L-1 BA+0.1 mg·L-1 NAA。这一处理不仅形成的不定芽数目多, 而且形成芽所需的时间短。选取2 cm以上的粗壮芽苗进行生根实验, 确定小黑杨组培苗生根的最适培养基为1/2 MS+0.1 mg·L-1 NAA。
2.1.2 抗卡那霉素临界浓度试验由于目的基因上嵌合有卡那霉素抗性基因NPT Ⅱ, 若外源基因已整合进小黑杨基因组中, 再生植株便能够在含有卡那霉素的培养基上正常生长, 因此可以利用卡那霉素做为遗传转化的选择剂。为了确定小黑杨叶片对卡那霉素的抗性, 进行了叶片诱导分化培养、芽诱导生根对卡那霉素的临界浓度的试验。
由表 1可以看出, 小黑杨叶片在含40 mg·L-1卡那霉素时能够发生不定芽, 在50 mg·L-1时没有任何启动。因此, 对小黑杨进行外源基因的转化时, 50 mg·L-1的卡那霉素为最低选择剂量。同样可以看出, 卡那霉素含量达到30 mg·L-1时抑制根的发生, 40 mg·L-1卡那霉素时为小黑杨根系忍耐的极限。
|
|
经过根癌农杆菌侵染的叶片, 在选择培养基上培养3周后, 在叶片伤口处开始生出绿色的小芽点, 待小芽长至2 cm左右时切下转至生根培养基中生根培养(图 2、3)。
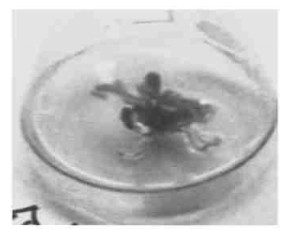
|
图 2 转化再生植株 Fig. 2 Plant of transformation regeneration |
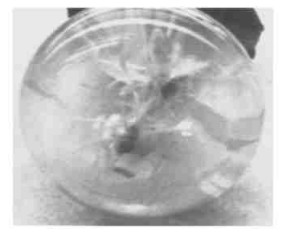
|
图 3 生根的转化苗 Fig. 3 Rooting of transformed plant |
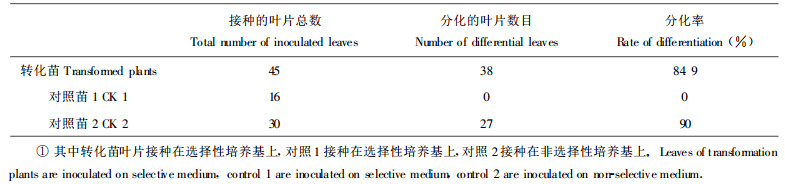
在卡那霉素选择性培养基上, 转化植株的叶片能够正常的生长, 并且在切口处长出大量的绿色小芽点。而未转化对照苗的叶片则变黄、枯死。关于转化苗叶片的再生情况见表 2。
|
|
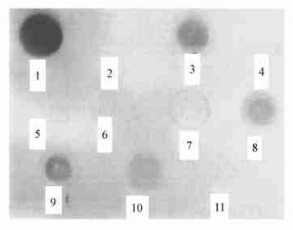
通过农杆菌介导转化小黑杨叶片获得转基因再生植株后, 利用PCR扩增快速检测11株转化再生苗(图 4)。小黑杨转化再生植株组培苗通过PCR分析, 有4、5、8、9、11、12、13号7株获得特异性扩增条带, 而对照未扩增出任何片段。初步证明在这些植株中有Bet-A基因的插入。
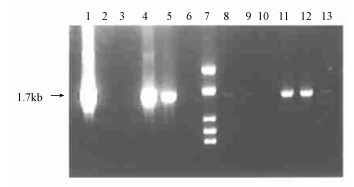
|
图 4 部分转化再生植株的PCR检测电泳图谱 Fig. 4 Gel electrophoresis of PCR products of part regenerated poplars 泳道1为阳性对照, 泳道2为阴性对照, 泳道7为标准分子量, 其余为检测样品。 Lane 3~13: PCR products form different transformed plants; Lane 1: from prok Ⅱ as a positive control, Lane 2: from untransformed plant, Lane 7: Marker. |
选取11株经根癌农杆菌侵染的转化植株提取DNA, 进行斑点杂交检测。从图 5我们可以看出, 第3、4、7、8、9、10、11号与Bet-A探针杂交呈阳性反应, 未经转化的对照植株2号呈阴性反应。从图中还可以看出, 杂交信号的强度也有所不同, 这可能是外源基因在植物中的拷贝数不同或其他的原因引起的。
从斑点杂交的阳性植株中选取3株(第3、9、10号)作了Southern印迹杂交检测, 第3、9号与Bet-A探针杂交呈阳性反应(见图 6, 即Lane3和Lane5), 获得了1.7 Kb的杂交条带。而阴性对照与探针杂交呈阴性反应, 无任何杂交带产生。Southern印迹杂交的结果表明, 胆碱脱氢酶基因Bet-A已经整合到小黑杨的染色体基因组中, 获得了转基因植株。
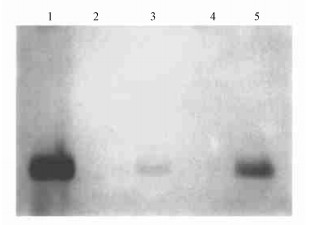
|
图 6 转化苗的印迹杂交检测 Fig. 6 Print hybridization of transformed plants 图 6中1号同样是阳性对照, 2号为阴性对照, 其余为检测样品。 Fig. 6 Lane 1: from prok Ⅱ as a positive control, Lane 2: from untransformed plant, Lane 3~5: transformed plants. |
本研究首先建立了小黑杨组培再生体系, 然后通过根癌农杆菌介导法, 将胆碱脱氢酶基因Bet-A导入小黑杨中, 获得了再生植株。通过PCR扩增和Southern杂交检测, 证实了外源基因已整合到小黑杨的染色体基因组中。
顾红雅, 瞿礼佳, 明小天. 1995. 植物基因与分子操作. 北京: 北京大学出版社, 103-105.
|
郝贵霞, 朱祯, 朱之悌. 1999. 毛白杨遗传转化系统优化的研究. 植物学报, 41(9): 936-940. DOI:10.3321/j.issn:1672-9072.1999.09.005 |
李玲, 韩一凡. 1992. 杨树对卡那霉素敏感性的测定. 林业科学, 28(1): 95-96. |
王关林, 方宏筠主编.植物基因工程原理与技术.北京: 科学出版社, 1998
|
郑均宝, 等. 1996. 雄性毛白杨离体叶片再生及抗虫基因转化. 河北林学院学报, 11(2): 97-101. |
Gosta Lilius, NildasHolmberg and Leif Bulow. 1996. Enhanced NaCl stress tolerance in transgenic tobacco expressing bacterial choline dehydrogenase. Biotechnology, 14: 177-180. |
Lamark T, et al. 1991. DNA sequence and analysis of the bet genes encoding the osmoregulatory Choline-Glycine betaine pathway of E. coli. Mol. Microbiol, 5: 1049-1064. |
 2001, Vol. 37
2001, Vol. 37