文章信息
- 宋漳.
- Song Zhang.
- 液体深层培养绿僵菌分生孢子的研究
- STUDIES ON SPORULATION OF METARHIZIUM IN SUBMERGED CULTURE
- 林业科学, 2001, 37(5): 134-139.
- Scientia Silvae Sinicae, 2001, 37(5): 134-139.
-
文章历史
- 收稿日期:2000-06-13
-
作者相关文章
目前国内外生产绿僵菌分生孢子制剂常用固体发酵法或两相发酵法, 这些方法生产周期长, 产品易被污染, 产量低, 不能大量满足生物防治的需要。而液体深层培养具有生产周期短, 产品不易被污染, 生产率高, 培养条件易控制等优点, 倍受人们所推崇。现已知有少数几种昆虫致病丝孢菌, 如Aspergillus ochraceus (Vézina et al., 1965)、Hirsutella thompsonii var. synnematosa (Winkelhoff et al., 1984)、Beauveria bassiana (Thomas et al., 1987)以及绿僵菌(樊美珍等, 1993)的某些菌株在液体深层培养中能产生液生分生孢子。且有研究认为在某些培养条件下产生的液生分生孢子的性质与气生分生孢子相似(Thomas et al., 1987)。因此, 本文着重从绿僵菌液生分生孢子形成与培养基组成的关系, 以及液生分生孢子对森林主要害虫马尾松毛虫的侵染性等方面进行较为系统的研究。
1 材料与方法 1.1 供试菌种金龟子绿僵菌Metarhizium anisopliae (Metsch.)Sorokin, M337、M103、M104;贵州绿僵菌Metarhizium guizhouense Chen et Guo, M115;金龟子绿僵菌大孢变种Metarhizium anisopliae var. major (Jonnston)Tulloch, M336;黄绿绿僵菌Metarhizium flavoviride Gams, M335。以上菌种均来源于中国农业菌种保藏中心。
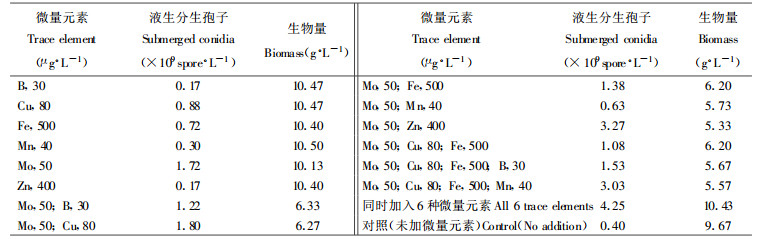
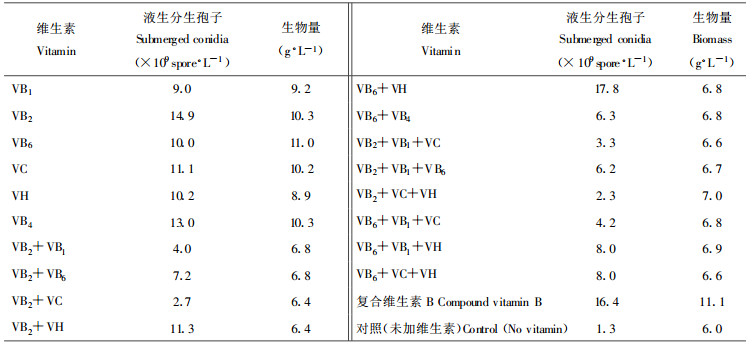
1.2 培养基成分(1) 基础盐(g·L-1):KH2PO4 1.50、MgSO4·7H2O 0.50、CaCl2 0.01;(2)微量元素(μg·L-1):H3BO3 30、MnSO4·4H2O 40、Na2MoO4 ·2H2O 50、CuSO4·5H2O 80、ZnSO4·7H2O 400、FeCl3·6H2O 500; (3)维生素(15 μg·L-1):VB1、VB2、VB6、VC、VH、VB4、复合维生素B; (4)吐温80 :0.1 %; (5)碳源(25 g·L-1):葡萄糖、蔗糖、可溶性淀粉、乳糖、麦芽糖; (6)氮源(15 g·L-1):豆饼粉、花生饼粉、玉米粉、麦麸、酵母浸出汁、蛋白胨、KNO3。最终培养基的pH调至6.8。
1.3 试验方法取供试斜面菌种加0.1 %吐温80无菌水, 用无菌操作打散混匀、稀释, 使其最终含孢量为1.0×109个孢子·L-1, 250 mL三角瓶装入49 mL培养液, 接入1 mL孢子悬浮液, 试验设3个重复, 置(25 ±1)℃恒温摇床中振荡培养, 振荡频率为130 r·min-1, 接种后每隔12 h取样观察。液生分生孢子用血球计数板计数, 生物量用干物质称量法测定, 即将培养液过滤, 120 ℃烘干2 h, 称重。
1.4 液生分生孢子对马尾松毛虫的毒力生物测定选用金龟子绿僵菌M337菌株接种于液体培养基中, 置(25 ±1)℃、振荡频率为130r·min-1的恒温摇床中振荡培养144 h, 大量形成液生分生孢子, 然后滤除菌丝体, 浓缩液生分生孢子悬浮液, 再用0.1 %吐温80无菌水配制成浓度梯度分别为:1.0×1011~1.0×107个孢子·L-1的液生分生孢子悬浮液。每种浓度设3个重复, 每个重复30条3~4龄马尾松毛虫Dendrolimus punctatus Walker。用微量注射器吸取上述菌液滴于幼虫体表, 每虫接种量为0.1mL菌液, 对照组用0.1 %吐温80无菌水接种。处理后放入装有松针的罐头瓶中, 瓶盖装有铁丝网, 以保持通气, 置于25 ℃下饲养。每日更换松针, 喷清水以保持高湿, 逐日统计感染死亡虫数。同时以M337菌株的气生分生孢子对马尾松毛虫的毒力测定为对比试验, 接种方法同上。
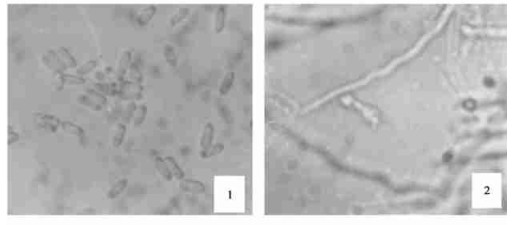
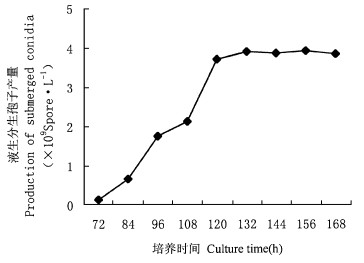
2 结果与分析 2.1 液生分生孢子形成与菌株的关系振荡培养24 h后, 绿僵菌分生孢子开始萌发, 原生质转移至芽管生长点, 芽管自孢子一端或两端伸出。36 h菌体呈网状, 48 h菌体呈团状, 60 h菌体出现产孢结构, 开始形成液生芽孢子, 液生芽孢子呈长卵形。72 h液生芽孢子开始大量形成, 部分芽孢子以循环产孢方式, 不经营养生长阶段, 直接从芽孢子上形成分生孢子, 液生分生孢子卵球形, 与气生分生孢子有明显差异(图 1)。此后液生分生孢子产量逐渐增加, 120~144 h达到最高产孢量(图 2)。本试验所选用的6个菌株中, 有4个菌株可通过微循环产孢形成液生分生孢子, 另2个菌株始终仅形成液生芽孢子。且各菌株的产孢能力差异很大(表 1)。可见, 绿僵菌微循环产孢现象的发生及液生孢子的产量与菌株有一定的相关性(樊美珍等, 1993), 通过对菌株的筛选, 可望获得适合液体发酵生产液生分生孢子菌剂的菌株。
|
图 1 气生分生孢子(1)×750和液生分生孢子(2)×875形态比较 Fig. 1 Morphology of aerial conidia (1)×750 and submerged conidia (2)×875 |
|
图 2 不同培养时间绿僵菌M337菌株的产孢量 Fig. 2 Sporulation curve of M337 strain at different culture time |
|
|
以豆饼粉为氮源组配成不同碳源的培养基、以蔗糖为碳源组配成不同氮源的培养基, 同时在以上不同碳、氮源培养基中加入B、Cu、Fe、Mn、Mo、Zn 6种微量元素和VB1, 以金龟子绿僵菌M337菌株为供试菌株测定不同碳、氮源对液生分生孢子形成的影响。M337菌株在以上各种液体培养基中振荡培养120 h后生长量和产孢情况如表 2和表 3。经统计分析表明, 不同的碳源和氮源对金龟子绿僵菌M337菌株的生物量和液生分生孢子形成具有极显著的影响。经LSR法检验可知, 蔗糖、可溶性淀粉、乳糖是有利于绿僵菌形成液生分生孢子的较好碳源, 且它们之间无显著差异。花生饼粉、酵母浸出汁、蛋白胨是有利于绿僵菌形成液生分生孢子的较理想氮源, 且它们之间无显著差异。同时从试验中还可以看出复杂的有机氮源比简单的无机氮源更有利于液生分生孢子的形成。
|
|
|
|
在以花生饼粉、蔗糖、基础盐、吐温80为基础培养基中加入不同的微量元素, 用M337菌株接种, 测定微量元素对绿僵菌液生分生孢子形成的影响。试验结果表明(表 4):微量元素对绿僵菌液生分生孢子的形成有重要影响。当单个微量元素或2个以上的微量元素组合加入时, 可以看出钼是最重要的微量元素, 对绿僵菌液生分生孢子的形成有很大的影响。锌、钼组合加入时, 锌为刺激因子, 液生分生孢子产量比单一的钼元素加入时明显增大。但当以上6种元素同时加入时, 可获得最大的产孢量, 说明微量元素对绿僵菌液生分生孢子形成的影响应是协同进行的。
|
|
在以花生饼粉为氮源、蔗糖为碳源的培养液中加入不同维生素作为生长辅助因子, 每处理的最终维生素含量设定为每升培养液中维生素含量为15 μg。研究结果如表 5所示, 经方差分析可知, 不同维生素对金龟子绿僵菌菌丝生长及液生分生孢子的形成影响显著。复合维生素B和VB6可使绿僵菌获得最大的生物量(11.1 g·L-1和11.0 g·L-1), 而VB6+VH和复合维生素B能使绿僵菌获得最大的液生分生孢子产量(17.8×109个孢子·L-1和16.4×109个孢子·L-1)。可见, 在培养液中添加适宜的生长辅助因子, 能有效促进液生分生孢子的形成。
|
|
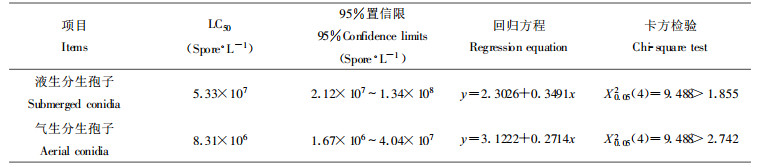
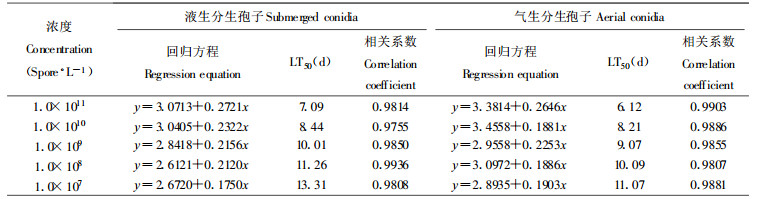
以3~4龄马尾松毛虫幼虫为生测对象, 接种处理2 d后松毛虫个体开始死亡, 虫尸经数天后出现典型的绿色僵虫症状, 侵染12 d后的死亡情况见表 6。通过LD50的BASIC程序(稍做修改)运算(张宗炳, 1988), 结果得到死亡率(用机率值)与感染浓度(用对数值)的回归方程和LC50(见表 7), LT50的计算结果见表 8。从生物测定结果可以看出, 绿僵菌M337菌株的液生分生孢子和气生分生孢子对马尾松毛虫的僵虫率相近, 液生分生孢子的毒力仅略低于气生分生孢子。
|
|
|
|
|
|
绿僵菌某些菌株如M337、M103、M104、M115经液体振荡培养72h后, 能通过微循环产孢方式, 不经营养生长阶段, 直接从液生芽孢子上形成液生分生孢子, 且这种微循环产孢现象的发生和产孢能力与菌株有一定的相关性。
绿僵菌液生分生孢子的形成与培养基成分关系密切。不同的碳、氮源对绿僵菌液生分生孢子形成具有极显著的影响。蔗糖、可溶性淀粉和乳糖是液体培养分生孢子的较好碳源, 而花生饼粉、酵母浸出汁和蛋白胨则是较理想的氮源, 且复杂的有机氮源比简单的无机氮源更有利于液生分生孢子的形成。同时试验结果还显示:微量元素和维生素对促进绿僵菌液生分生孢子的形成具有重要影响。B、Cu、Fe、Mn、Mo、Zn的协同作用将有力促进液生分生孢子的产生。在培养基中添加VB6+VH或复合维生素B能有效促进绿僵菌液生分生孢子的形成。有研究资料表明, 液生孢子产生方式和数量受控于营养成分和培养环境条件(Vézina et al., 1965; Adámek, 1965; McCoy et al., 1972; Campbell et al., 1978; 樊美珍等, 1993)。因此, 选择适当的菌株和适宜的培养基对绿僵菌液体深层培养液生分生孢子尤为重要。
从室内对马尾松毛虫毒力的生物测定结果来看, 绿僵菌M337菌株的液生分生孢子对马尾松毛虫的毒力仅略低于气生分生孢子。因此, 作为一种微生物杀虫剂, 液体发酵生产绿僵菌分生孢子有进一步研究的价值。
樊美珍, 郭超, 薛文奇. 1993. 金龟子绿僵菌液体深层培养初报. 中国虫生真菌研究与应用, (3): 146-149. |
张宗炳编著.杀虫剂的毒力测定-原理·方法·应用.北京: 科学出版社, 1988, 388~391
|
Adámek L. 1965. Submerse cultivation of fungus Metarhizium anisopliae (Metxch.). Folia Microbiol, 10: 255-257. DOI:10.1007/BF02875956 |
Campbell R K, Perring T M, Barnes G L, et al. 1978. Growth and sporulation of Beauveria bassiana and Metarhizium anisopliae on media containing various amino acids. J.Invert.Pathol, 31: 289-295. DOI:10.1016/0022-2011(78)90218-5 |
McCoy C W, Hill A J, Kanavel R F. 1972. A liquid medium for the large-scale production of Hirsutella thompsonii in submerged culture. J.Invert.Pathol, 19: 370-374. DOI:10.1016/0022-2011(72)90236-4 |
Thomas K C, Khachatourians G G, Ingedew W M. 1987. production and properties of Beauveria bassiana conidia cultivated in submerged culture. Can.J.Microbiol, 33: 12-20. DOI:10.1139/m87-003 |
Vézina C, Singh K, Sehgal S N. 1965. Sporulation of filamentous fungi in submerged culture. Mycologia, 57: 722-736. DOI:10.1080/00275514.1965.12018259 |
Winkelhoff A J, McCoy C W. 1984. Conidiation of Hirsutella thompsonii var.synnematosa in submerged culture. J.Invert.Pathol, 43: 56-68. |
 2001, Vol. 37
2001, Vol. 37