文章信息
- 高克祥, 刘晓光, 郭润芳, 淮稳霞, 张敏.
- Gao Kexiang, Liu Xiaoguang, Guo Runfang, Huai Wenxia, Zhang Min.
- 木霉菌对杨树树皮溃疡病菌拮抗作用的研究
- STUDY ON THE ANTAGONISM OF TRICHODERMA SPECIES ON CANKER PATHOGEN FUNGI OF POPULAR
- 林业科学, 2001, 37(5): 82-86.
- Scientia Silvae Sinicae, 2001, 37(5): 82-86.
-
文章历史
- 收稿日期:2000-10-09
-
作者相关文章
2. 河北农业大学林学院 保定 071000
2. Forestry College of Agricultural University of Hebei Baoding 071000
杨树烂皮病和水泡溃疡病是我国杨树栽培区普遍发生的重要枝干病害。尤其在幼林上发生和危害较重,严重制约了杨树生产的发展(向玉英等,1996)。传统的化学药剂防治,在抑制病原菌的同时,也杀死了树体上有益的拮抗微生物,同时也会使病原菌产生抗药性,并污染环境。因此,生物防治作为综合防治的一个重要环节,越来越多地受到人们的关注。
木霉菌(Trichoderma spp.)是自然界中普遍存在并有丰富资源的拮抗微生物,它具有广谱性、适应性强和多机制性的特点。首先,木霉菌竞争作用强,它能迅速生长,进行营养和空间位点的竞争。它还能产生挥发性或非挥发性的抗菌类物质,如木霉素、胶霉素、绿色木霉素和抗菌肽等,对多种病原菌有抑制作用。此外还具有重寄生作用,可从病原菌体内吸取营养物质,削弱病原菌的生长势,甚至杀死病原菌。据报道,木霉不仅对病原微生物有拮抗作用,而且能直接作用于植物,促进其萌发、生长和开花,且其本身受外界干扰影响小,由此在植病生物防治中占有重要地位,具有广阔的应用前景(徐同等,1993;项存悌等,1991;Inbar et al.,1994)。
对具有潜力的拮抗微生物的合理利用的先决条件是对其寄生过程和机理的了解(Gupta et al.,1999)。本试验研究了哈茨木霉(Trichoderma harzianum Rifai)T88菌株(以下简称T88)和深绿木霉(T. atroviride Bissett)T95菌株(以下简称T95)对能严重危害杨树枝干的杨树烂皮病菌[Cytospora chrysosperma (Pers.)Fr.]和杨树水泡溃疡病菌(Dothiorella gregaria Sacc.)的拮抗和重寄生现象。这为木霉菌在杨树烂皮病和溃疡病的田间生物防治中的应用提供了理论依据。
1 材料和方法 1.1 供试菌种木霉菌为哈茨木霉(T.harzianum)T88菌株(由东北林业大学项存悌教授自杨树树干上分离)和深绿木霉(T.atroviride)T95菌株(由笔者自苹果树腐烂病病疤上分离纯化而得)。
病原菌为致病力强的杨树烂皮病菌(C.chrysosperma)(有性型为Valsa sordida Nit)C菌株和杨树水泡溃疡病菌(D.gregaria)[有性型为Botryosphaeria ribis (Tode)Gross.Et Dugg.] D菌株。
以上菌种均由河北农业大学林学院病理实验室保存和提供。
1.2 平皿对峙培养接种方法参考高克祥等(1999),切取培养5 d同质等量的木霉菌和病原菌的菌丝块接种于PDA平板上距中心2 cm处同一直线的两点上,同时设只接种病原菌为对照,每处理三个重复,于25 ℃恒温培养,并逐日观察、测量木霉菌的菌落指向病原菌菌落的半径RT88和RT95,病原菌菌落指向木霉菌菌落的半径RC和RD以及只接病原菌的对照半径R0。当两菌落接触相交后,观察记载木霉对病原菌的抑制,包围,侵入并占领病原菌营养空间的过程。当两菌落交接后,在交接部位或病菌菌落内部挑取菌丝在显微镜下观察二者的相互作用。
1.3 木霉菌产生的挥发性代谢物对病原菌落的影响试验方法参考Dennis et al.(1971),在培养皿的底和盖上均倒上PDA培养基制成平板,同时分别在盖上接种同质等量的木霉菌的菌丝块,在底上接种同质等量的病原菌的菌丝块,合上培养皿后,用封口膜密封。以底上只接种病原菌,而盖上不接种木霉菌为对照,每处理3个重复。将培养皿倒置,在25 ℃下培养,24 h、48 h、72 h测量病原菌的菌落半径。
1.4 木霉菌产生的非挥发性代谢物对病原菌菌丝干重的影响试验方法参考朱天辉等(1994),每瓶含50 mL的马铃薯葡萄糖培养液中接种同质等量的木霉菌的菌丝块两块,在25 ℃黑暗条件下,静止培养两周后,先用无菌脱脂棉滤去菌丝,然后离心(4000 r·min-1,10 min),取上清液,再用无菌滤纸过滤。滤液的一部分湿热灭菌30 min。另一部分用细菌过滤器抽滤灭菌,得到两种木霉菌的4种无菌液。4种无菌液分别用马铃薯葡萄糖培养液配制成50%、100%浓度,以不含木霉菌滤液的马铃薯葡萄糖培养液为对照。每个浓度各接种同质等量的病原菌的菌丝块一块,每处理3个重复。25 ℃培养8 d,滤取菌丝烘干称重。
1.5 载片培养观察试验方法参考高克祥等(1999)用灭菌的解剖刀划取15 mm×10 mm的PDA薄膜,置于灭菌的载片中央,然后挑取等量木霉和病原菌的菌丝分别接种于小方块两平行边的中点,在25 ℃恒温下保湿培养,逐日镜检观察两菌的相互作用。用Olypus摄影显微镜拍摄显微照片。
1.6 扫描电镜观察试验方法参考朱天辉等(1994)、Chambers(1995)、Elad(1983)等人,用1.5的方法进行载片培养5 d后,当在光学显微镜下观察出现重寄生现象时,用玻璃刀切取小块在PDA膜边缘长有菌丝的玻璃片。在3%戊二醛(0.1 mol·L-1磷酸缓冲液pH 7.0)中,4 ℃冷藏固定6 h后,用0.1 mol·L-1磷酸缓冲液冲洗3次,样品再用乙醇系列浓度(50%,70%,80%,90%,100%)逐级脱水(每级处理10 min),乙酸异戊酯置换,进行临界点干燥和离子溅射后,在美国产的KYKY-1000B扫描电镜下观察,并拍摄照片。
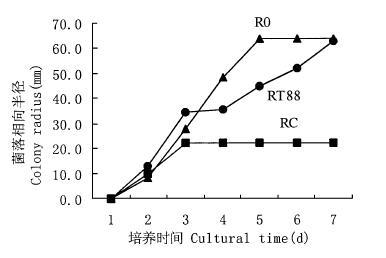
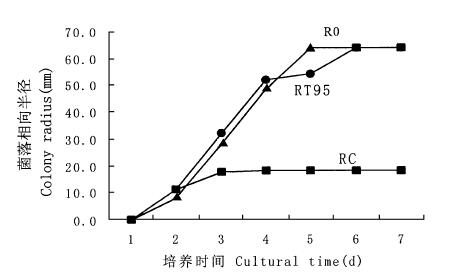
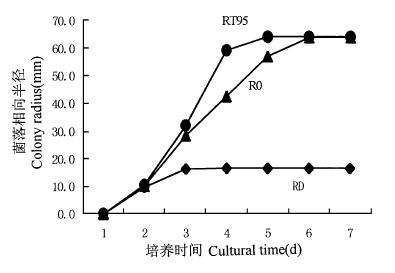
2 结果与分析 2.1 平皿拮抗作用对峙培养结果表明:木霉菌T88和T95对两种树皮溃疡病原菌均有明显的抑制作用,并且T95抑制作用大于T88(图 1~4)。约3 d木霉菌与病原菌开始接触,4 d时,木霉菌开始包围或覆盖病原菌,使其面积不再向接种木霉的方向扩展。而木霉菌丝再进一步扩展侵入病原菌菌落,最终病菌菌落萎缩,平皿2/3以上区域甚至整个平皿为木霉菌所占据,并形成大量绿色分生孢子。在木霉菌与杨树水泡溃疡病菌对峙培养中,与T88对峙的病菌菌丝萎蔫,菌落高低不平。与T95对峙的病菌的气生菌丝消解,菌落变薄,病菌对峙半径与对照相比要小得多。
|
图 1 T88-杨烂皮病菌对峙培养 Fig. 1 T88-C in dual culture |
|
图 2 T95-杨烂皮病菌对峙培养 Fig. 2 T95-C in dual culture |

|
图 3 T88-杨水泡溃疡病菌对峙培养 Fig. 3 T88-D in dual culture |
|
图 4 T95-杨水泡溃疡病菌对峙培养 Fig. 4 T95-D in dual culture |
R0:对照病菌的菌落半径Colony radius of pathogen in control;RT88:对峙培养中木霉菌T88指向病菌的菌落半径Colony radius of Trichoderma T88 in dual culture;RT95:对峙培养中木霉菌T95指向病菌的菌落半径Colony radius of Trichoderma T95 in dual culture;RC:对峙培养中杨树烂皮病菌指向木霉菌的菌落半径Colony radius of Cytospora chrysosperma in dual culture;RD:对峙培养中杨树水泡溃疡病菌指向木霉菌的菌落半径Colony radius of Dothiorella gregaria in dual culture.
2.2 木霉菌产生的挥发性代谢物对病原菌菌落的影响试验结果表明:两种木霉菌均能产生挥发性代谢物质并不同程度地抑制病菌菌落的生长(表 1)。T88和T95对杨树烂皮病菌的抑制比对杨树水泡溃疡病菌明显,T95随培养时间的延长,抑制作用逐渐增强,T95比T88产生的挥发性物质的抑菌作用更明显。T95对杨树烂皮病菌的抑制率在72 h达80.30%。镜检结果表明,两种木霉菌产生的挥发性物质能使病原菌的菌丝断裂、原生质浓缩或变稀薄。
|
|
两种木霉菌的培养滤液,无论是过滤灭菌,还是湿热灭菌,都可以抑制病菌的生长,使其菌丝干重降低,滤液的浓度越大,抑制作用越强。滤液经过过滤灭菌和湿热灭菌后,在同一浓度下对菌丝干重的影响无显著差异(表 2)。这表明此非挥发性代谢物具热稳定性。
|
|
在光学显微镜下,可以观察到木霉菌T88和T95的菌丝在杨树烂皮病病菌的菌丝上平行或波浪式生长(图版Ⅰ-1、2、4),并在其上产生附着胞或钩状分枝吸附于病原菌的菌丝上(图版Ⅰ-1、4),或穿透病原菌的菌丝生长(图版Ⅰ-3)。在木霉菌与杨树水泡溃疡病菌的载片对峙培养中,T88可以使病菌菌丝断裂,原生质浓缩(图版Ⅰ-5),T95的菌丝也沿着病菌菌丝平行生长(图版Ⅰ-6)。

|
图版Ⅰ Plate Ⅰ 1. 哈茨木霉菌丝(T88)在杨树烂皮病菌菌丝(C)上平行生长; 2. 深绿木霉菌丝(T95)在杨树烂皮病菌菌丝(C)上呈波浪形生长; 3. 哈茨木霉菌丝(T88)穿过杨树烂皮病菌菌丝(C)生长; 4. 深绿木霉菌(T95)产生钩状物(H)吸附在杨树烂皮病菌菌丝(C)上; 5. 在哈茨木霉(T88)的拮抗作用下, 杨树水泡溃疡病菌(D)菌丝细胞原生质浓缩、菌丝断裂; 6. 木霉菌(T95)菌丝在杨树水泡溃疡病菌(D)菌丝上平行生长。 1. The hyphae of Trichoderma harzianum T88 grew parallel on the hyphae of Cytospora chrysosperma (C). 2. The hyphae of Trichoderma atroviride T95 grew in wave on the hyphae of Cytospora chrysosperma (C). 3. The hyphae of Trichoderma harzianum T99 penetrated the hyphae of Cytospora chrysosperma (C). 4. A hook (H) of Trichoderma atroviride T95 grasping a hypha of Cytospora chrysosperma (C). 5. The cytoplasm of hyphal cells of Dothiorella gregaria (D) concentrated, their hyphal cells collapsed after interaction with Trichoderma harzianum T88. 6. The hyphae of Trichoderma atroviride T95 grew parallel on the hyphae of Dothiorella gregaria (D). |
木霉菌T88和T95的菌丝均能穿过两种病原菌的菌丝生长,在穿透点病菌的菌丝增粗,并有裂痕产生(图版Ⅱ-1~4)。T88使杨树水泡溃疡病菌的菌丝断裂(图版Ⅱ-5),T95产生的钩状物钩附在杨树水泡溃疡病菌的菌丝上(图版Ⅱ-6)。

|
图版Ⅱ Plate Ⅱ 1. 哈茨木霉菌丝(T88)穿透杨树烂皮病菌菌丝(C); 2. 深绿木霉菌丝(T95)穿透杨树烂皮病菌菌丝(C); 3. 哈茨木霉菌丝(T88)穿过杨树水泡溃疡病菌菌丝(C); 4. 深绿木霉菌丝(T95)刚穿透杨树烂皮病菌菌丝(C); 5. 在哈茨木霉(T88)的拮抗作用下, 杨树水泡溃疡病菌(D)产生裂口; 6. 深绿木霉菌(T95)产生钩状物(H)钩在杨树水泡溃疡病菌菌丝(D)上。 1. The hyphae of Trichoderma harzianum T88 penetrated the hyphae of Cytospora chrysosperma (C). 2. The hyphae of Trichoderma atroviride T95 penetrated the hyphae of Cytospora chrysosperma (C). 3. The hyphae of Trichoderma harzianum T88 penetrated the hyphae of Dothiorella gregaria (D). 4. The hyphae of Trichoderma atroviride T95 penetrated just the hyphae of Cytospora chrysosperma (C). 5. The hyphae of Dothiorella gregaria (D) broke after antagonism with Trichoderma harzianum T88. 6. A hook (H) of Trichoderma atroviride T95 hooked a hypha of Dothiorella gregaria (D). |
本试验结果表明,供试的两种木霉菌T88和T95菌株对杨树烂皮病菌和水泡溃疡病菌均有较强的空间和营养的竞争作用。笔者另外的试验结果证明,这两种木霉菌对能引起苗木立枯病的丝核菌(Rhizoctonia solani)、合欢枯萎病的镰刀菌(Fusarium oxysporium)、苹果根朽病的蜜环菌(Armillaria mealla)、山楂扦插苗白绢病的齐整小核菌(Sclerotium rolfsii)等4种土传病菌有明显的拮抗作用,同时分别对能引起枝干部和叶部病害的病原真菌:苹果树腐烂病菌(Cytospora.mali)、苹果枝干轮纹病菌(Macrophomak kuwatsukai)、苹果轮斑病菌(Alternaria alternata)也有明显的拮抗作用。说明这两种木霉菌都是适应性较强的广谱性拮抗真菌,在林果病害生物防治中具有广阔的开发应用前景。
木霉菌作为普遍存在并具有丰富资源的拮抗微生物,在植病生防中具有重要的不可替代的地位。木霉菌对病原菌的拮抗作用具有广谱性的特点,但不同的种,同种的不同菌株都存在着拮抗活性的差异及拮抗对象种类上的差别。在图 3中RT88的值远低于图 1中RT88、图 2和图 4中的RT95的值,这可能是因为木霉菌T88菌株对生长较快的杨树水泡溃疡病菌D菌株的拮抗活性没有另外3组处理中的木霉菌表现的作用强的缘故。从表 1中也可以看出,T88菌株产生的挥发性代谢物对杨树水泡溃疡病菌的抑制率最小。
木霉菌对植物病原真菌的拮抗作用包含有多种机制,一般认为有竞争作用,产生抗菌素类物质及重寄生作用。本试验中,我们用光学显微镜和扫描电镜观察到木霉菌T88和T95菌株对两种病原菌的重寄生作用有:在病菌的菌丝上平行或波浪式生长;产生附着胞或钩状分枝吸附于病原菌的菌丝上;穿透病原菌的菌丝;使病菌菌丝断裂,原生质浓缩等。在重寄生过程中,木霉菌对病原菌的识别、接触、穿透和寄生的生理生化机理,有待深入研究。
两种木霉菌能产生一类抑制病菌菌落生长的挥发性代谢物质,T95比T88产生的挥发性物质的抑菌作用更为明显。在密闭条件下,T95最高抑制率可以达到80.30%,但在一般状态下,这一特性在拮抗作用中的潜能大小,尚需进一步研究。
T88和T95产生的非挥发性代谢物质能够抑制病菌菌丝干物质的积累,并具有热稳定性。如果提取这类非挥发性物质应用于田间生物防治,可能会有广阔的应用前景。然而,这类代谢物质的组成成分和作用机理尚有待于分析研究。
高克祥, 刘晓光, 等. 1999. 木霉菌株T88对七种病原真菌的拮抗作用. 河北林果研究, 14(2): 159-162. DOI:10.3969/j.issn.1007-4961.1999.02.016 |
高克祥, 刘晓光, 等. 1999. 木霉对杨树水泡溃疡病菌的拮抗作用. 安徽农业大学学报, 26(增刊): 80-84. |
向玉英, 郭树云. 1996. 杨树水泡型溃疡病防治指标研究. 林业科学研究, 41(4): 409-412. DOI:10.3321/j.issn:1001-1498.1996.04.014 |
项存悌, 高克祥, 等. 1991. 杨树烂皮病生物防治研究. 东北林业大学学报, 19(6): 15-25. |
徐同, 钟静萍, 等. 1993. 木霉对土传病原真菌的拮抗作用. 植物病理学报, 23(1): 63-66. DOI:10.3321/j.issn:0412-0914.1993.01.001 |
朱天辉, 邱德勋. 1994. Trichoderma harzianum对Rhizoctonia solani的抗生现象. 四川农业大学学报, 12(1): 11-15. |
Chambers S M, Scott E S. 1995. In vitro antagonism of Phytophthora cinnamomi and P. citricola by isolates of Trichoderma spp. and Gliocladium virens. Journal of Phytopathology, 143: 471-477. DOI:10.1111/j.1439-0434.1995.tb04557.x |
Dennis C, Webster J. 1971. Antagonistic properties of species-group of Trichoderma. Trans. Br. Mycol. Soc., 57: 25~39, 41~48, 303~369. DOI:10.1016/S0007-1536(71)80077-3 |
Elad Y, Chet I, et al. 1983. Parasitism of Trichoderma spp. on Rhizoctonia solani and Sclerotium rolfsii scanning electron microscopy and fluorescence microscopy. Phytopathology, 73: 85-88. DOI:10.1094/Phyto-73-85 |
Gupta V P, Tewari S. K, et al. 1999. Ultrastructure of Mycoparasitism of Trichoderma, Gliocladium and Laetisaria species on Botryodiplodia theobromae. Journal of Phytopathology, 147: 19-24. DOI:10.1111/j.1439-0434.1999.tb03802.x |
Inbar J, Abramsky M, et al. 1994. Plant growth enhancement and disease control by Trichoderma harzianum in vegetable seedlings grown under commercial conditions. European Journal of Plant Pathology, 100: 337-346. DOI:10.1007/BF01876444 |
 2001, Vol. 37
2001, Vol. 37