文章信息
- 李云, 朱之悌, 田砚亭, 张志毅, 康向阳.
- Li Yun, Zhu Zhiti, Tian Yanting, Zhang Zhiyi, Kang Xiangyang.
- 秋水仙碱处理白杨雌花芽培育三倍体植株的研究
- STUDIES ON OBTAINING TRIPLOIDS BY COLCHICINE TREATING FEMALE FLOWER BUDS OF WHITE POPLAR
- 林业科学, 2001, 37(5): 68-74.
- Scientia Silvae Sinicae, 2001, 37(5): 68-74.
-
文章历史
- 收稿日期:2000-01-27
-
作者相关文章
三倍体和二倍体或其他倍性的多倍体相比,绝大多数三倍体的营养生长通常是最好的(鲍文奎,1988),一般说来,三倍体具有2个基本特征,1是由细胞体积增加所引起的巨大性,2是由细胞减数分裂过程紊乱造成的不育性,这两个特点非常适合以获取材积为目标和以无性繁殖方法育苗的林木树种,因此三倍体育种在林木遗传改良中具有重要价值(Benson et al.,1967;Einspahr et al.,1968;1970)。虽然在自然界中选择三倍体取得了良好的效果(朱之悌等,1998),但选择群体小,选择随机性大,费工费时,在实际工作中还有一定的局限性(Dwived et al.,1989),因此,三倍体育种走向人工选育。目前人工培育林木三倍体的途径主要有:①利用四倍体与二倍体杂交(杨今后等,1992;Einspahr,1965;Johnsson,1945);②通过胚乳离体培养(陈如珠等,1991;顾淑荣等,1987;Tulecke et al.,1988);③选择或诱导2 n配子,与正常异性配子杂交(杨今后等,1992;朱之悌等,1995)。对于杨树三倍体育种工作,如果采用第1条杂交途径,选育四倍体需要较长的育种时间;利用胚乳离体培养诱导三倍体植株,虽然方法很好,但杨树的种子非常小,内胚乳缺或很薄(任宪威,1997),难以分离其胚乳;只有第3种方法较适合杨树三倍体育种,该方法可获得较大的选择群体,为所获三倍体进行优中选优奠定条件(因为不是所有的三倍体都比二倍体好)。然而,到目前为止,人工培育的杨树三倍体是由2 n花粉与正常雌配子杂交获得的(朱之悌等,1995),所获三倍体与母本细胞质遗传关系不大。如果能够在考虑细胞核遗传的同时,也考虑母本细胞质遗传,即利用2 n雌配子培育三倍体,有可能是一条新的有效途径。
根据细胞质遗传理论,被子植物的大多数种表现为母系遗传(胡适宜,1997),二倍体杂种的核染色体一半来自母本,另一半来自父本,而细胞质遗传物质几乎全部来自母本(冯午等,1993),因此后代表现出的许多性状更接近母本性状。如果把具有优良性状母本的性细胞染色体加倍成2 n雌配子,再与正常雄配子杂交,其三倍体后代核染色体组成的三分之二来自母本,细胞质遗传物质几乎全部来自母本,并且在诱导2 n雌配子时,2 n雌配子的细胞质遗传物质也有可能增加,使三倍体后代会更多地接受母本的遗传物质。因此,通过母本性细胞染色体加倍途径培育三倍体是有意义的。
在杨树上最早用于诱变2 n雄配子的方法是化学诱导法(Johnsson et al.,1940)。在所用化学药品中,最有效的为秋水仙碱(colchicine)。许多学者用秋水仙碱溶液处理毛新杨(P.tomentosa×P. bolleana)、毛白杨(P.tomentosa)、欧洲山杨(P.tremula)、美洲山杨(P.tremuloides)和美洲黑杨(P.deltoides)雄花芽获得2 n雄配子,然后授粉得到三倍体植株(张志毅等,1992;Johnsson et al.,1940;Winton,1968)。这些三倍体都是利用2 n雄配子获得的,既然利用雄配子染色体加倍的方法可获得三倍体,那么反过来,能否用雌配子染色体加倍的新途径也获得三倍体?到目前为止,在木本植物中利用2 n雌配子获得三倍体的报道极少,成功的报道仅有诱导桑树雌配子染色体加倍培育三倍体一例(Dwived et al.,1989),而在其它木本植物三倍体育种中还未见有关报道。本试验旨在探索人工诱导杨树雌配子染色体加倍新途径的可能性及可行方法,以期培育出新的白杨三倍体。
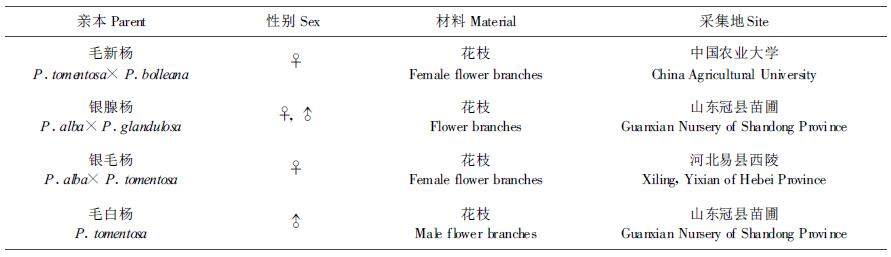
1 材料和方法 1.1 材料选用生殖力强、杂交亲和性好、结籽率高的杨树杂种雌株和产花粉量大、育性好的杨树杂种雄株(表 1)。在1月份采集所需雌、雄花枝,用塑料膜包裹保湿,运回后保存于低温、背风、避光处。
|
|
选基部直径1 cm以上的雌花枝,剪成80~100 cm的枝段,在温室中水培催芽,每3 d换1次水,昼温10 ℃~20 ℃,夜温4 ℃~10 ℃。当花芽处于减数分裂时期(董源,1984)分别用浓度为0.75%、0.50%或0.25%的秋水仙碱和1%二甲基亚砜(Dimethyl sulfoxide)混合液处理经过水培1~5 d雌花枝上的雌花芽,然后继续水培、并杂交和收集种子。(1)注射法处理雌花芽:将微量注射器的针头从花芽顶端顺着花芽纵轴插入到花芽中部或基部,把药液直接注入雌花芽中,每个芽注射20 μL,每天上下午各注射1次,连续注射5次。(2)棉浸法处理雌花芽:用刀片剥去雌花芽的芽鳞,露出花序,用脱脂棉将花序裹住,外包塑料膜保湿,用注射器穿透塑料膜将药液注入到脱脂棉中,每个芽注射0.2~0.3 mL,每天补充药液2~3次,连续处理3 d。(3)瓶浸法处理雌花芽:将花枝上的雌花芽直接插入装有秋水仙碱药液的棕色小瓶中浸泡,连续处理3 d。对照为在温室水培并未经秋水仙碱溶液处理的雌花枝。处理和对照均取大样本,每组合处理雌花序50穗以上,如在处理过程中落序落花严重时(处理小花数量不足1000朵),其数据不再用于试验分析。
1.2.2 筛选单倍性花粉、杂交和播种育苗取雄花枝,截成50~100 cm长的枝段,于温室中水培催花和收集花粉。由于在毛白杨自然花粉中,约有0~14.3%的二倍性大粒花粉(朱之悌等,1998),为防止花粉中偶尔有极个别大花粉,对所获花粉进行纯化处理,根据Winton等(1970)和朱之悌等(1995)的经验,即用35 μm(600目)孔径的金属网筛过筛[Mashkina等,(1989)认为普通花粉粒直径为25~35 μm,大花粉为37.5~52.5 μm之间]弃去筛网上边的大粒花粉,保留筛网漏下的小粒花粉,抽样镜检,以保证全部是单倍性花粉。
在授粉期中,将雌花芽用纸袋隔离,授粉时打开,授粉结束时封住,每天授粉2次,连续授粉2~3 d,然后继续水培,等蒴果裂开吐絮时,收集种子。将种子进行去序、挑种、干燥、称重和计数,在4 ℃低温处理5~7 d后播种,当苗高达5~10 cm时,定植于大田。
1.2.3 苗期表型初选群体的选择在生长季观察和测定苗期生长表现,以每个处理组合为单位,以高生长和叶片大小为指标,将高生长和叶片大小超过本处理组合平均数的植株作为染色体镜检的入选群体,进行取样用于镜检。
1.2.4 倍性镜检和苗期生长量调查在生长期取苗木茎尖或根尖,于对二氯苯饱和液中预处理2~3 h (15 ℃),用卡诺固定液固定8 h(4 ℃)。解离(解离液为浓盐酸:乙醇=1:1)25~30 min,蒸馏水冲洗30 min,用放置2周以上的改良碱性品红(朱澄,1982)染色12 h(0 ℃~5 ℃),最后进行压片、镜检(型号为BHS的OLYMPUS显微镜)和显微照像(PM-10AD的OLYMPUS自动显微摄影系统)。调查苗期三倍体植株叶片的纵径、横径、叶柄长、叶面积、叶片干鲜重以及生长高度、地径、胸径,其中叶片面积由日产的Digital Planimeter Placom (KP~80N)求积仪求得。
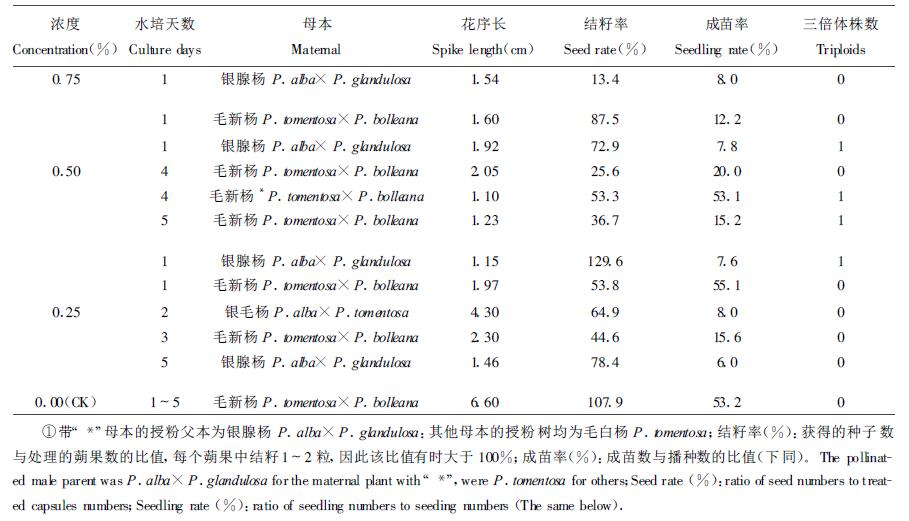
2 结果与分析 2.1 注射法处理雌花芽试验结果见表 2,用0.75%、0.50%、0.25% 3个浓度的秋水仙碱溶液注射雌花芽,均获得了种子和苗木,经对入选群体的染色体镜检发现,秋水仙碱溶液浓度为0.25%和0.50%时有诱变效果,分别检测出1、3株三倍体(见图 1),对照和0.75%秋水仙碱处理虽能得到种子和苗木,但均未发现三倍体。可见0.25%和0.50%的秋水仙碱溶液是注射法诱变三倍体的合适浓度,该浓度既能诱变染色体数目的增加,又不至于使处理的细胞全部被诱变剂毒害致死,并且0.50%浓度诱变效果较好。0.75%的秋水仙碱溶液处理未发现三倍体,可能是在诱变过程中高浓度的诱变剂杀死了被诱变的细胞。用0.25%和0.50%浓度处理时,水培1~5 d花枝上的花芽能够得到种子和苗木,其中水培银腺杨母本1 d发现2株三倍体,水培毛新杨雌花枝4 d和5 d各测得1株三倍体;0.75%的浓度处理时,仅有水培1 d花枝上的花芽得到种子和苗木,说明水培花芽时间越长,花芽越敏感,越不忍耐较高浓度诱变剂的作用。用3个浓度的秋水仙碱溶液注射雌花芽后的结籽率和成苗率均比对照低,并且浓度越高,结籽率和成苗率越低,花序长度变化也同样如此,可知较高秋水仙碱溶液浓度对花芽伤害较重。既然高浓度的秋水仙碱对细胞诱变作用较强,就应该有较多的变异机会,然而事实并非如此,在0.75%秋水仙碱溶液处理获得的入选苗木群体中,没有发现三倍体,推测原因:(1)高浓度处理很难获得较大的苗木群体,也就没有筛选三倍体的基础;(2)高浓度诱变时,能够生存的性细胞是那些处于对诱变剂相对不敏感分裂时期的细胞,这些细胞的染色体较难被加倍,因此由这些细胞发育的种子也就不可能是三倍体。(3)即使高浓度处理能够获得液体,这些也是苗期生长差的三倍体,不能进入入选群体,因此,也就没有被检出机会。
|
|
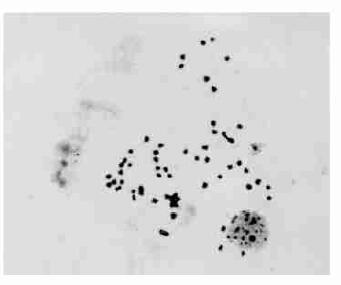
|
图 1 三倍体的染色体数(2n=3x=57) Fig. 1 The chromosome number of triploid (2n=3x=57) |
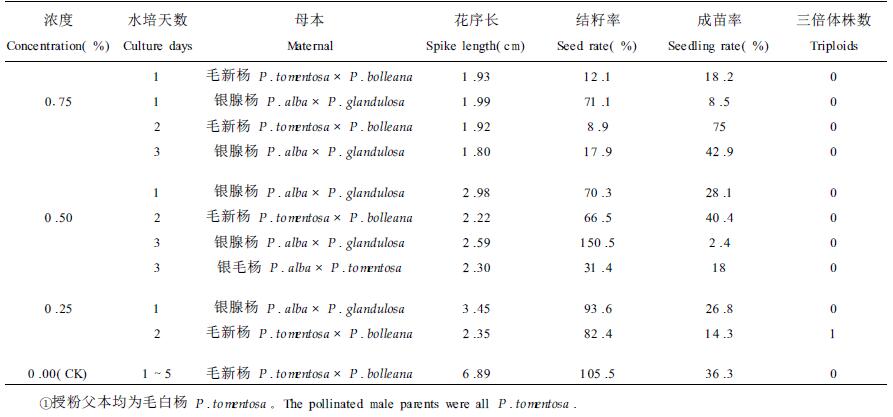
试验结果见表 3,用水处理(对照)时,虽有籽和苗,但没有发现三倍体。3个浓度的秋水仙碱溶液棉浸法处理均获得种子和苗木,但结籽率和成苗率远低于对照,并且随处理浓度增加,结籽率和成苗率降低,花序长度也有同样规律。在低浓度0.25%秋水仙碱诱变处理的入选群体中仅检测出1株三倍体,而两个较高浓度(0.50%和0.75%)的秋水仙碱诱变效果不佳,均未发现三倍体,分析原因可能是该方法诱变剂伤害了花芽中处于减数分裂时期的性细胞,最后得到的种子只是由那些未处于减数分裂时期的性细胞发育而成的。从不同的水培时间所得到的种子和苗木看,3个浓度处理水培4 d和5d的花芽,不论浓度大小均未获得种子和苗木,水培时间长的花芽比注射法更易脱落,说明棉浸处理法对花芽的伤害比注射法严重,这与棉浸法处理时剥去芽鳞使花芽受伤和使药液更直接作用于花芽有关,只有处理水培2 d的毛新杨花芽有结果,其它水培时间进行的处理均未发现三倍体。
|
|
瓶浸法处理结果见表 4,用水处理雌花芽(对照)时,未发现三倍体,用0.25%和0.50%浓度的秋水仙碱溶液处理雌花芽分别检测出1株和7株三倍体,而高浓度0.75%秋水仙碱溶液诱变效果不佳,未发现三倍体。在3个浓度秋水仙碱处理中,只有水培花枝2、3d的处理结籽和出苗,而对照水培花枝1~5 d均有籽和苗,说明水培花枝时间较长时,花芽对药剂的抵抗力降低,这与分化了的花芽长时间浸于诱变剂中不能忍受其伤害有关。水培1 d的银腺杨花枝检测出三倍体的数量最多,达7株之多,水培3 d的毛新杨花枝检测出1株三倍体,其它的水培时间没有结果,说明瓶浸处理时,并非水培花枝天数越长越好。
|
|
瓶浸处理时,诱变剂对花芽的作用和伤害规律与注射法和棉浸法基本相同,首先秋水仙碱处理缩短了花序的长度,同时也降低了结籽率和成苗率,并且秋水仙碱浓度越高,该趋势越重,说明随药剂浓度增加,对花序不良影响加重。只有在秋水仙碱浓度为0.25%和0.50%的处理中发现三倍体,而对照和0.75%的秋水仙碱浓度处理没有检测出三倍体,说明秋水仙碱瓶浸法诱导雌配子染色体加倍并非浓度越高越好,较高的秋水仙碱浓度(0.75%)对雌配子的伤害作用较为严重,不易得到种子和苗木,也就没有筛选三倍体的基础。这是因为瓶浸法诱变处理是用秋水仙碱溶液连续浸泡雌花芽3 d,在此期间雌花芽全部浸泡于药液中,使雌花芽长时间处在不良的逆境中,那些在细胞分裂过程中处于对环境影响敏感、染色体容易变异时期的细胞,不能忍耐高浓度长时间极端逆境而死亡。虽然高浓度处理能够得到种子和苗木,这是由那些处理对环境影响不敏感、染色体未加倍的雌配子获得的;低浓度的诱变剂也可能杀死一些处于减数分裂时期的细胞,但低浓度对花芽的伤害相对较轻,使一些性细胞的染色体被加倍而这些细胞又未被杀死,从而获得了既有三倍体又有二倍体的混合群体。
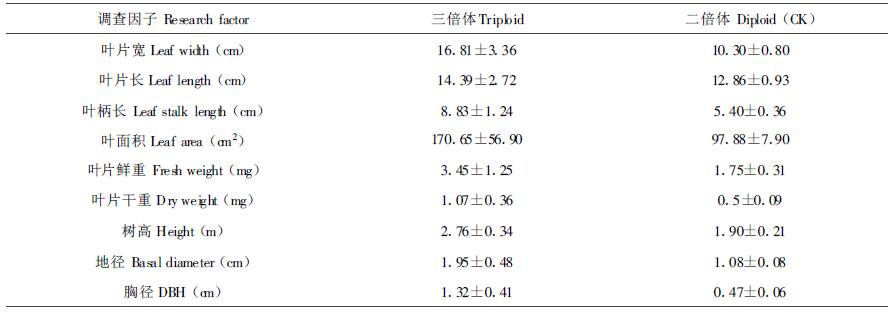
2.4 三倍体植株在苗期的生长表现从表 5看出,三倍体植株在苗期表现出明显的巨大性,在叶宽、叶长、叶柄长、叶面积、叶片干鲜重方面均超过了二倍体植株,其中三倍体植株的叶面积、叶片干重、叶片鲜重是二倍体植株的2倍左右。同时三倍体植株的高度、地径、胸径也超过了二倍体对照,特别是胸径达到二倍体植株的2倍以上,表现了三倍体植株的苗期速生优势。
|
|
(1) 本试验分别以水培雌花枝1~5 d开始诱变处理雌花芽,均从入选群体中检测出三倍体。其中毛新杨花枝水培时间1~5 d,银腺杨1~4 d,银毛杨2~3 d有效。
(2) 处理持续时间是影响雌配子染色体加倍的关键因子之一,本试验采用注射法连续处理2.5 d,棉浸法和瓶浸法分别连续处理3 d,均有效果。
(3) 秋水仙碱溶液处理白杨雌花芽培育三倍体的另一关键因素是秋水仙碱处理浓度,0.25%和0.50%的处理浓度有效,以0.50%较佳,高于该浓度发生药害,引起花序脱落或胚败育,得不到杂种后代。
(4) 秋水仙碱溶液注射法、棉浸法和瓶浸法3种处理方法均有效,其中以瓶浸法处理效果较好,从入选群体中检测出8株三倍体,而注射法和棉浸法各选出4、1株三倍体。从实用角度方面考虑,3种方法各有差异,注射法省药、费工,在连续处理过程中,要多次注射,每次注射都对花芽有机械伤害,容易引起花序脱落,得到种子的机率相对较低;棉浸法处理费工也费药,在剥芽鳞时对花芽有伤害,并且在连续处理过程中,要不断地补充药液,一般每天补充2~3次,每次用药量也较多,而且诱变效果不理想,但操作简单易行;第3种方法是瓶浸法,该方法省药省工,加1次药液即可完成全部处理过程,并且处理完毕后药液可以回收再用,处理效果也最好。
(5) 从入选群体中检测出的三倍体植株在苗期均表现出明显的巨大性和速生优势。
(6) 本试验首先在苗期根据苗木生长表现进行表型初步选择,然后对入选群体进行染色体数目镜检,因此在初选中有可能淘汰了一些生长不佳的三倍体植株,同时也减轻了染色体数目镜检的工作量。
鲍文奎.多倍体.见: 蔡旭主编.植物遗传育种学.第二版.北京: 科学出版社, 1988, 611~627
|
陈如珠, 李耿光, 张兰英. 1991. 红江橙胚乳愈伤组织诱导和三倍体植株再生. 植物学报, 33(11): 848-854. |
董源. 1984. 毛白杨胚胎学观察. 北京林学院学报, 1: 83-94. |
冯午, 邓岳芬, 李懋学, 等. 1993. 白菜甘蓝种间杂种后代细胞质遗传及其利用前景探讨. 园艺学报, 20(3): 267-273. DOI:10.3321/j.issn:0513-353X.1993.03.006 |
顾淑荣, 桂耀林, 徐廷玉. 1987. 枸杞胚乳植株的诱导及染色体倍性观察. 遗传学报, 14(1): 37-41. |
胡适宜. 1997. 被子植物质体遗传的细胞学研究. 植物科学, 39(4): 363-371. |
任宪威主编.树木学.北京: 中国林业出版社, 1997, 247
|
杨今后, 杨新华, 骆承军. 1992. 桑树多倍体及其育种研究进展. 蚕业科学, 18(3): 195-201. |
张志毅, 李凤兰. 1992. 白杨染色体加倍技术研究及三倍体育种(1). 北京林业大学学报, 14(增刊3): 52-58. |
朱澄主编.植物染色体及染色体技术.北京: 科学出版社, 1982, 42~93
|
朱之悌, 林惠斌, 康向阳. 1995. 毛白杨异源三倍体B301等无性系选育的研究. 林业科学, 31(6): 499-505. |
朱之悌, 康向阳, 张志毅. 1998. 毛白杨天然三倍体选种研究. 林业科学, 34(4): 22-30. DOI:10.3321/j.issn:1001-7488.1998.04.004 |
Benson M K, Einspahr D W. 1967. Early growth of diploid, triploid hybrid aspen. For. Sci., 13(2): 150-155. |
Dwived N K, Suryannrayana N, Sikdar A K, et al. 1989. Cytomorphological stuides in trploid Muiberry Evolved by diploidization of female gamete cells. Cytologia, 54: 13-19. DOI:10.1508/cytologia.54.13 |
Einspahr D W. 1965. Colchicine treatment of newly formed embryos of Quaking Aspen. For. Sci., 11(4): 456-459. |
Einspahr D W, Benson M K, Peckham J R. 1968. Wood and pulp properties of 5 year old diploid, triploid aspen. Tappi., 51(2): 72-75. |
Einspahr D W, Peckhma J R, BensonM K. 1970. Fiber and pulp properties of triploid and triploid hybrid aspen. Tappi., 53(10): 1853-1856. |
Johnsson H, Eklundh C. 1940. Colchicine treatment as a method in breeding hardwood species. Svensk PappTidn, 43: 373-377. |
Johnsson H. 1945. The triploid progeny of the cross diploid X tetraploid Populus tremula. Hereditas, Lund, 31: 411-440. |
Mashkina O S, Burdaeva L M, Belozerova M M, et al. 1989. Method of obtaining diploid pollen of woody species. Lesovedenie, 1: 19-25. |
Tulecke W, McGranahan G, Ahmadi H. 1988. Regeneration by somatic embryogenesis of triploid plants from endosperm of walnut, Juglans regia L. cv Manregian. Plant Cell Reports, 7(5): 301-304. DOI:10.1007/BF00269923 |
Winton L L. 1968. Fertilization in forced Quaking Aspen and Cottonwood. Silvae Genet, 17(1): 20-21. |
Winton L L, Einspahr D W. 1970. Tetraploid aspen production using unreduced triploid pollen. For. Sci., (16): 180-182. |
Zhu Zhiti, Kang Xiangyang, Zhang Zhiyi. 1997. The status and advances of genetic improvement of Populus tomentosa Carr. Journal of Beijing Forestry University, 6(1): 1-7. |
 2001, Vol. 37
2001, Vol. 37