文章信息
- 齐力旺, 李玲, 韩一凡, 韩素英, Dietrich Ewald.
- Qi Liwang, Li Ling, Han Yifan, Han Suying, Dietrich Ewald.
- 落叶松不同类型胚性和非胚性愈伤组织的生理生化差异
- PHYSIOLOGICAL AND BIOCHEMICAL CHANGES IN DIFFERENT KINDS OF EMBRYOGENIC CALLUS AND NON-EMBRYOGENIC CALLUS OF LARIX PRINCIPIS-RUPPRECHTII
- 林业科学, 2001, 37(3): 20-29.
- Scientia Silvae Sinicae, 2001, 37(3): 20-29.
-
文章历史
- 收稿日期:2000-06-21
-
作者相关文章
2. 山西农业大学林木生物技术研究中心 太谷 030801;
3. Federal Research Centre for Forestry, Institute for Forestry Tree Breeding and Biotechnology, Eberswalder Chaussee 6, 15377 Waldsiewersdorf, Germany
2. Research Centre of Forestry Biotechnology, Shanxi Agricultural University Taigu 030801;
3. Federal Research Centre for Forestry, Institute for Forestry Tree Breeding and Biotechnology, Eberswalder Chaussee 6, 15377 Waldsieversdorf, Germany
华北落叶松(Larix principis-Rupprechtii)是我国北方中高山地区重要的速生造林用材树种, 进行其体细胞胚胎发生的研究, 在针叶树快速繁殖与基因工程育种上有其特殊的用途。然而, 目前已报道的所有落叶松(Lelu MA, 1994、1997; Levee V, 1977; Tautorus TE, 1991等)体细胞胚胎发生研究表明, 随着胚性愈伤组织继代次数的增加, 体细胞胚的发生能力会逐渐下降, 10个月后明显降低, 有些转化为非胚性愈伤组织, 失去体细胞胚发生能力; 所以, 如何保持胚性愈伤组织持续、高效的体细胞胚发生能力, 是体细胞胚胎发生的关键问题之一。虽然近年来体细胞胚胎发生研究方面的报道不断增多, 但大多数研究受经验影响, 且存在偶然性, 没有一个稳定的体细胞胚胎发生实验系统, 对体细胞胚胎发生过程中生理生化的差异、分子机制以及发育过程等缺乏系统的研究, 不能高效、稳定地调控体细胞胚胎发生; 迄今国内外还未见落叶松胚性和非胚性愈伤组织生理生化差异研究的报道。因此, 本文从生理生化方面剖析不同类型胚性与非胚性愈伤组织的差异, 研究落叶松胚性与非胚性愈伤组织中激素、氨基酸、糖、离子含量等的变化, 旨在探索针叶树体细胞胚发生特点, 为进一步揭示其再生机理提供实验依据。
1 材料和方法 1.1 实验材料分别于1998-06-10、20、25, 07-06、15, 从山西省关帝林区定株采集2株华北落叶松优树的未成熟球果, 2个基因型材料分别接种。
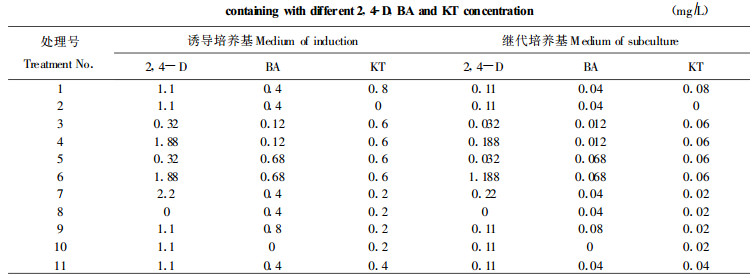
1.2 落叶松愈伤组织的诱导取落叶松球果中幼嫩合子胚, 在S培养基(Ewald, 1997)上采用311-A最优回归设计诱导、继代培养基; 继代培养用S+B (H3BO3由S的3.1mg/L增加至7.75mg/L)培养基, 附加2, 4-D、BA、KT减少为原来的1/10 (表 1)。
|
|
用镊子取出未成熟种子, 70 %酒精浸泡1 min、0.1 %升汞溶液6 min消毒, 无菌水冲洗5次后, 从侧部划开种壳, 取出种仁, 划破内种皮, 挑开胚乳, 嫩胚接种于培养基上, 每皿接种25个, 重复4次, 在温度23 ℃~25 ℃下暗培养, 15~25 d根据颜色、形态、结构等特征, 初步确定胚性愈伤组织, 以后每18~20 d继代1次, 每次转接时均挑取表面新分化的愈伤组织。
1.3 生理生化测定方法 1.3.1 乙烯释放量分析乙烯含量测定用气相色谱分析法, 玻璃填充柱0.5 m长, 填料用GDX-502, 柱温80 ℃, 进样口温度120 ℃, 衰减3×102, 纸速6 mm/min; 参照中国林业科学研究院分析中心(1994)第268页方法。
1.3.2 离子含量分析Ag+, Co++, Cd++, Zn++Cu++、Ni++、Fe++、Cr+++离子含量测定用原子吸收分光光度法, 样品在70 ℃烘干, 称取1 g置于坩埚内, 炭化, 600 ℃灰化4 h, 冷却, 10 mL 10 %硝酸溶解灰分, 热无离子水洗涤, 滤至100 mL容量瓶, 检验无Fe+++存在时, 定容、待测。
NO3-测定用离子色谱法, FIC-1型分析仪测定, 样品经无离子水洗净、晾干, 称1 g组织研碎, 加入50 mL无离子水搅拌30 min, 0.45 um滤膜过滤, 进行IC分析。
NH4+离子含量测定用紫外一可见分光光度计, 称0.2 g置50 mL消化管中, 湿润样品后, 加5 mL硫酸, 过夜, 滴加1 mL 30 %的双氧水, 加热消煮、冷却, 无离子水定容至50 mL, 过滤、待测。
1.3.3 游离糖含量分析游离糖含量测定用高效液相色谱法, 柱:Sugar-Pak-1, 柱温90 ℃, H2O为流动相, 流速0.7 mL/min, 检测器为RI:4x;称取样品400 mg于5 mL容量瓶中溶解、定容, 摇匀后, 0.45 um滤膜过滤, 待测。
1.3.4 酚酸含量分析酚酸含量测定用高效液相色谱法, 柱为:μ-Bonkapak PhenyL (0.4 cm×30 cm); 流动相:35 %CH3OH-65 %H2O (H3PO4调pH=4.5);流速:1.0 mL/min; 检测器:UV254 nm×0.1AUFS; 样品称取2 g于25 mL锥形瓶中, 加50 mL石油醚超声波中振荡30 min, 过夜, 滤去石油醚, 晾干转入150 mL圆底烧瓶中, 加50 %甲醇50 mL, 加热回流, 滤液浓缩至25mL定容, 取Waters公司Sep-pakC18小柱一支, 用5 mL甲醇活化, 5 mL水冲洗, 吸取5 mL样品提取液通过小柱, 弃去初洗液1 mL, 再收集2 mL洗出液, 待测。
1.3.5 激素含量分析生长素含量测定用高效液相色谱, 柱:Novapak C18 (0.4 cm×15 cm); 流动相:40 %CH3OH-15 %CH3CN-45 %H2O (H3PO4调pH=4);流速:0.7 mL/min; 检测器:UV254 nm×0.1AUFS。样品称取2 g研碎, 至50 mL锥形瓶中, 加50 mL石油醚在5 ℃浸泡过夜, 滤去石油醚, 加50 mL冷甲醇5 ℃下电磁搅拌4 h, 过滤, 残渣加冰甲醇30 mL搅拌1 h过滤, 合并滤液, 减压浓缩至25 mL。取2 mL浓缩液经已活化的小柱, 弃去淋出液, 用2 mL乙腈淋洗小柱, 淋洗液经0.5 um滤膜过滤、待测。
细胞分裂素含量测定用液相色谱柱:Novapak C18 (0.4 cm×15 cm); 流动相:15 %Ch3CN-25 %CH3OH-60 %H2O (H3PO4调pH=3.5);流速:0.7 mL/min; 检测器:UV254 nm×0.1ASUS; 样品称取2 g研碎后转至50 mL锥形瓶中, 加50 mL甲醇于冰箱内(4℃)放置24 h, 滤渣中再加30 mL甲醇4 ℃下电磁搅拌30 min, 过滤, 合并甲醇液, 用2 %NaOH调pH=8;用50 mL石油醚分两次萃取, 去掉石油醚相, 将甲醇液浓缩至25 mL定容, 0.5 um滤膜过滤, 待测。
1.3.6 氨基酸含量分析氨基酸分析仪柱, 为氨基酸分析专用阳离子交换柱(0.4 cm×30 cm), 柱温62 ℃, 检测器:M420荧光检测器(ex:338 nm, em:425 nm), 流速:0.4 mL/min, 柱后反应泵流速:0.8 mL/min (衍生剂OPA0.4 mL/min, 氧化剂次氯酸钠溶液0.6 mL/min); 参照中国林业科学研究院分析中心(1994)第216~218页方法进行。
1.3.7 色氨酸和半胱氨酸含量分析色氨酸和半胱氨酸测定方法参照中国林业科学研究院分析中心(1994)第238页与第252页方法。
2 实验结果 2.1 愈伤组织分类经诱导培养基上产生的胚性愈伤组织, 在继代培养基上生长16个月, 有的细胞系有稳定的体细胞胚发生能力, 有的细胞系体细胞胚发生能力下降, 产生形态、质地、颜色上不同的多种类型的愈伤组织, 其中有的甚至失去体细胞胚发生能力, 变成非性愈伤组织。以同一诱导培养基同一继代培养基上产生的不同类型的愈伤组织为材料, 研究落叶松不同类型的胚性愈伤组织及非胚性愈伤组织的生理生化差异, 探索(1)同一基因型同一细胞系不同类型愈伤组织内, 生理生化方面的差异; (2)同一基因型、不同细胞系(2A、2I细胞系以及3B、3C细胞系)愈伤组织内生理生化方面的差异; (3)不同基因型(2#基因型、3#基因型)的愈伤组织内生理生化方面的差异; (4)经ABA处理后(j)与同一细胞系(h)、同一基因型的不同细胞系(2I)、不同基因型(3B、3C)愈伤组织内, 生理生化方面的差异。
根据形态、质地、颜色和体细胞胚发生能力的不同, 划分10种不同类型胚性与非胚性愈伤组织情况见表 2。
|
|
落叶松胚性和非胚性愈伤组织内氨基酸含量(表 3)差异显著, 2#、3#基因型中质地硬的非胚性愈伤组织内18种氨基酸含量都高于胚性愈伤组织(图 1a)。(1) 2I细胞系, 硬质非胚性愈伤组织中氨基酸含量除色氨酸(Try)为胚性愈伤组织的1.6倍外, 其它17种氨基酸含量均为胚性愈伤组织的2倍以上; 尤其是精氨酸(Arg)含量非胚性愈伤组织是胚性愈伤组织的4倍, 赖氨酸含量为3倍以上; 图 1b、图 1c可见, 质地硬的非胚性愈伤组织(d)的氨基酸含量比软质非胚性愈伤组织明显高; 同为胚性愈伤组织的a, b, c中, b氨基酸含量最高。3#基因型中, f, g同为3C细胞系, f的体细胞胚分化频率100%, 各种氨基酸含量比体细胞胚分化频率12%的g细胞系含量低, 色氨酸、丙氨酸(Ala)与天门冬氨酸(Asp)含量g约是f的2倍。(2)不同基因型(2#, 3#)间不同类型的愈伤组织其氨基酸含量差异明显; (3)同一基因型、不同细胞系内, 如2I细胞系中的胚性愈伤组织c的氨基酸含量低于2A中的胚性愈伤组织h, 非胚性愈伤组织中氨基酸的含量则是2I细胞系高; (4)胚性愈伤组织j经ABA处理后, 与同一细胞系h的各种氨基酸含量也有差异, 其中Ala, Arg, Pro的含量j比h高20-30 %, Ile, Phe, Lys的含量j比I低20 %~40 %, Met含量j比I低2.7倍; 这些不同类型的愈伤组织中游离氨基酸含量的差异, 可能与氮的代谢、蛋白质的合成有关。
|
|

|
图 1 Fig. 1 |
游离糖含量的变化见图 2a、图 2b, 2I细胞系a、b、c、d、e中, 胚性愈伤组织a、b、c中b的多糖含量为6.036 g/100g·callus, 是非胚性愈伤组织中多糖含量的2.7倍, 不同类型的胚性愈伤组织中, 多糖含量也有差异, 是c的3.5倍; 表 4可见; 3#基因型的胚性与非胚性愈伤组织f、g、i中均检测到三糖, 分别为0.076、0.068、0.168 g/100g.callus, 但2#基因型的7种愈伤组织内均没有三糖, 表明基因型之间三糖含量存在很大差异; 而同一基因型、不同细胞系间, 如3B (i)的三糖含量是3C (f、g)的2倍还多。最明显的是在经过ABA、PEG处理后(j)多糖含量急剧升高, 为25.618 g/100g·callus, 比同一细胞系未经处理的愈伤组织(h)高出18倍, 是非胚性愈伤组织的11.9倍, 结果表明, 非胚性愈伤组织与胚性愈伤组织多糖含量的差异明显, 胚性愈伤组织内多糖的含量差异, 可能与胚性愈伤组织不同的发育时期有关。

|
图 2 Fig. 2 |
|
|
部分愈伤组织内可检测到酚酸(表 5), 2I细胞系b、d、e的胚性和非胚性愈伤组织中均不同程度地检测到水杨酸, 其它细胞系中未能检测到, 3#基因型(f、g、i)中未发现水杨酸; 3#基因型(f)中检测到对羟基甲酸(2.94mg/100g), 2#基因型的愈伤组织中均未发现, 说明基因型之间差异明显; 儿茶酸、丁香酸含量在不同类型的愈伤组织中没有规律性变化。邻苯二酚在经ABA、PEG处理后的愈伤组织(j)中很高(图 3a、图 3b), 为28.42 mg/100g, 是h的2.2倍, 是非胚性愈伤组织含量的1.9倍。
|
|

|
图 3 Fig. 3 |

|
图 4 Fig. 4 |
愈伤组织内激素含量见表 6, 由于激素含量极其微弱, BA、IAA、NAA在鲜样品1g时没有检测到。ZR在2#, 3#的硬质非胚性愈伤组织中, 都未检测到, 而软质非胚性愈伤组织中含量最高达237.4 ug/100g, 同一细胞系(a、b、c、d、e)中, ZR含量e为c的2.6倍; GA含量仍是软质非胚性愈伤组织中含量最高, 达189.9 μg/100g, 且e为c的3.9倍; 乙烯的含量d、e分别为c的2.8倍和1.8倍, 非胚性愈伤组织中含量高, 表明乙烯抑制体细胞胚的发生, 与Huang等[2]报道的乙烯对胚性愈伤组织的诱导及体细胞胚发生有拮抗作用结果一致; 不同基因型(2#, 3#)的愈伤组织内没有规律性的差异趋势; 同一基因型、不同细胞系, 如3B未发现ZR与GA, 而3C中二者含量均较高, 细胞系间差异明显; 经ABA处理后, ZR与GA的含量不高, 乙烯含量也不高。
|
|
落叶松胚性和非胚性愈伤组织内各种离子含量见表 7, 其中, 胚性愈伤组织中Co++的含量是非胚性愈伤组织的12倍, Cd++离子含量胚性是非胚性愈伤组织的1.4倍, 表明Co++、Cd++与体细胞胚关系密切, 其余6种金属离子含量差异不大; NH4+、NO3-的含量差异较大(图 5), 胚性愈伤组织中NH4+为4.69 g/kg, 非胚性愈伤组织中为9.01 g/kg, 相差2倍, NO3-的含量分别为0.157 g/kg和3.26 g/kg, 非胚性愈伤组织是胚性愈伤组织的21倍, 另外, 胚性愈伤组织中铵态氮与硝态氮的比值为29.9, 非胚性愈伤组织中铵态氮与硝态氮的比值为2.8, 胚性愈伤组织中铵态氮与硝态氮的比值是非胚性愈伤组织中的10倍以上, 表明不同的氮源类型对落叶松体细胞胚发生影响较大。
|
|

|
图 5 胚性愈伤组织与非胚性愈伤组织内离子浓度 Fig. 5 The ion concentration of embryogenic callus and non-embryogenic callus □胚性愈伤组织h; ■非胚性愈伤组织I. |
落叶松胚性愈伤组织中游离氨基酸的含量, 明显低于非胚性愈伤组织, 特别值得注意的是游离基酸分析中的精氨酸含量的差异, 非胚性愈伤组织中精氨酸为胚性愈伤组织的4倍, 杨和平在马唐体细胞胚发生的研究中也得到相似的结果, 马唐胚性愈伤组织中游离氨基酸含量少于非胚性愈伤组织, 而可溶性蛋白质含量却高于后者, 当胚胎发生受阻时, 细胞内游离氨基酸增加, 说明胚性蛋白质合成较旺盛, 而非胚性蛋白质合成较少。两者游离氨基酸的差异, 反映了他们之间在蛋白质代谢上的差异, 以致其分化能力截然不同(杨和平, 1991)。另外, 多胺促进体细胞胚的发生, 精氨酸为多胺合成前体, 落叶松非胚性愈伤组织中精氨酸含量高, 可能与多胺的合成及体细胞胚发生关系密切。许多报告也指出, 外源Arg的供应可以促进原生质体的DNA合成, 促进愈伤组织的胚胎发生。
淀粉作为植物体内最普遍的一类储藏物质, 其消长与组织分化及器官形成具有密切的关系。白杆非胚性愈伤组织细胞中, 始终无淀粉粒出现, 而胚性愈伤组织只要转到分化培养基便开始有淀粉积累, 心形胚时期淀粉积累达高峰, 证实淀粉是一种积极参与组织培养过程中、形态建成的活跃代谢物质(杨金玲等, 1998)。本试验中, 落叶松胚性愈伤组织经ABA及PEG诱导后, 愈伤组织的表面形成许多光滑圆球状的原胚, 这时期测定淀粉含量急剧上升为非胚性和未处理的18倍。结果表明, 淀粉和多糖的积累出现在重要发育转折时期, 是为新的发育阶段提供能源的物质基础。Thorpe等在烟草愈伤组织诱导芽的实验中发现, 淀粉积累的高峰出现在拟分生组织形成之前, 通过测定淀粉代谢中有关酶的活性, 表明, 淀粉的积累是活性增加的结果, 淀粉和游离糖可能是作为形态建成过程中迅速可利用的贮藏能源(Thorpe等, 1993)。
Riyosue等(1990)在未用任何激素的情况下, 用CoCl2, NiCl2, CdCl2, ZnCl2, CuCl2, 的MS培养基, 诱导了胡萝卜的体细胞胚胎的形成, 其中以CdCl2的效果最佳, 其效果顺序为CdCl2, NiCl2, CoCl2, CuCl2, ZnCl2。Co++、Zn++, Cu++, Mn++、等重金属离子具有重要的促进作用, 本试验落叶松的胚性愈伤组织中CO++的含量为非胚性愈伤组织的12倍。乙烯含量非胚性愈伤组织是胚性愈伤组织的2.8倍。有研究发现Co++、Ag+、Ni++等金属离子是乙烯合成的抑制剂, 乙烯可抑制体细胞胚胎发生, 多胺可促进体细胞胚胎的发生。最近Roustan (1989)的研究结果又表明, AgNO3并非抑制乙烯的合成, 而是由于Ag+的存在, 乙烯不能干扰多胺的合成, 却促使精氨酸脱羧酶活性增加45%~54%, 这些离子是通过促进多胺的合成而提高体细胞了胚胎发生频率。
许多资料表明, 氮源对体细胞胚胎发生有一定影响, 在枸杞体细胞胚发生培养基中, 随着铵态氮与硝态氮比例的增高, 体细胞胚胎发生能力逐渐提高, 当培养基中只有铵态氮时, 体细胞胚发生频率最高(崔凯荣, 1993)。在落叶松胚性与非胚性愈伤组织中, 铵态氮与硝态氮的比值两者相差10倍以上, 胚性愈伤组织中铵态氮与硝态氮的比值为29.9, 而非胚性愈伤组织中只为2.8。虽然目前尚难确定NH4+是否对体细胞胚发生起特异性的作用, 但普遍认为某种还原氮, 无论通过直接外加, 还是由硝酸盐通过体内转化, 对于产生高频率的体细胞胚是必不可少的(黄学林, 1995)。一些研究也认为还原态氮, 在胚的诱导分化中是必需的, 主要是外源氮和氮的代谢与体细胞胚胎发生中的发育调节基因的表达有关(Smith.DL., 1990)。
陈以峰, 周燮, 汤日圣, 等. 1998. 水稻体细胞培养中胚性细胞出现与IAA的关系. 植物学报, 40(5): 474-477. DOI:10.3321/j.issn:1672-9072.1998.05.016 |
徐九龙, 高东微, 叶文红, 等. 1998. MGBG对苜蓿愈伤组织生长、体细胞胚胎诱导及其乙烯生物合成的影响. 植物学报, 40(7): 635-641. DOI:10.3321/j.issn:1672-9072.1998.07.008 |
杨和平, 程井辰. 1991. 马唐胚性与非胚性愈伤组织生理变异的初步研究. 植物生理学通讯, (5): 337. |
杨金玲, 郭仲琛. 1998. 白杆体细胞胚胎发生的细胞组织学和淀粉积累动态的研究. 西北植物学报, (3): 335-338. DOI:10.3321/j.issn:1000-4025.1998.03.005 |
中国林业科学研究院分析中心编.现代实用仪器分析方法.北京: 中国林业出版社, 北京: 1994, 268、216~2189、238、252
|
Ammirato P V. 1974. The effects of abscisic acid on the development of somatic embryos from cells of caraway(Carum carvi L.). Bot.Gaz, 135: 328-337. DOI:10.1086/336769 |
Chalupa V. 1993. Micropropagation of larch (Larix decidua Mill.)by organ culture and the field growth of micropropagated trees. Lesnictvi (Prague), 39(12): 481-486. |
DumontBeboux N., Mazari A., Livingston N.J., Von Aderkas P., Becwar M.R., Percy R.E., Pond S.E. 1996. Water relations parameters and tissue development in somatic and zygotic embryos of three pinaceous conifers. American Journal of Botany, 83(8): 992-996. DOI:10.1002/j.1537-2197.1996.tb12795.x |
Ewald D, Kretzschmar U, Chen Y. 1997. Continuous Micropropagation of Juvenile Larch from Different Species Via Adventitious Bud Formation. Biologia Plantarum, 39(3): 321-329. DOI:10.1023/A:1000959621891 |
Ewald D, Kretzschmar U. 1996. The influence of micrografting in vitro on tissue culture behavior and vegetative propagation of old European larch trees. Plant Cell Tissue and Organ Culture, 44(3): 249-252. DOI:10.1007/BF00048531 |
Huang Y, Diner A M, Karnosky D F. 1991. Agrobacterium rhizogenesmediated genetic transformation and regeneration of a conifer:Larix decidua. In vitro cellular & developmental biology plant, 27P(4): 201-207. |
Jourdain I, Lelu M A, Label P. 1997. Hormonal changes during growth of somatic embryogenic masses in hybrid larch. Plant Physiology and Biochemistry (Paris), 35(9): 741-749. |
Kamadad H, Harada H. 1984. Changes in endogenous amino acid compositions during somatic embryogenesis in Daucus carota L. Plant & Cell physiol, 25: 27-38. |
Klimaszewska K. 1989. Plantlet development from immature zygotic embryosof hybrid larch through somatic embryogenesis. Plant science (shannon), 63(1): 95-104. DOI:10.1016/0168-9452(89)90105-2 |
Klimaszewska K, Devantier Y, Lachance D, et al. 1997. Charest PJ.Larix laricina (Tamarack):Somatic embryogenesis and genetic transformation. Canadian Journal of Forest Research, 27(4): 538-550. |
Kochba J, Spiegel-Roy P, Neumann H, Saad S. 1978. Stimulation of embryogenesis in citrus ovular callus by ABA, ethephon, CCC and alar and its suppression by GA3, Z. Pflanzenphysiol, 89: 427-432. DOI:10.1016/S0044-328X(78)80039-7 |
Korlach J, Zoglauer K. 1995. Developmental patterns during direct somatic embryogenesis in protoplast cultures of European larch (Larix decidua Mill.). Plant Cell Reports, 15(3-4): 242-247. DOI:10.1007/BF00193728 |
Lelu M A, Bastien C, Klimaszewska K, Ward C, Charest P J. 1994. An improved method for somatic plantlet production in hybrid larch(Larix X leptoeuropaea):Part 1.Somatic embryo maturation. Plant Cell Tissue and Organ Culture, 36(1): 107-115. DOI:10.1007/BF00048321 |
Lelu M A, Klimaszewska K, Charest P J. 1994. Somatic embryogenesis from immature and mature zygotic embryos and from cotyledons and needles of somatic plantlets of Larix. Canadian Journal of Forest Research, 24(14): 100-106. |
Levee V, Lelu M A, Jouanin L, Cornu D, Pilate G. 1997. Agrobacterium tumefaciens-mediated transformation of hybrid larch (Larix kaempferi × L. decidua)and transgenic plant regeneration. Plant Cell Report, 16: 680-685. DOI:10.1007/s002990050301 |
Phillips G C, Collins G B. 1981. Induction and development of somatic embryos from cell suspension cultures of soybean. Plant cell TissOrgan Cult., 1: 123-129. DOI:10.1007/BF02318911 |
Pitel J A, Yoo B Y, Klimaszewska K, Charest P J. 1992. Changes in enzyme activity and protein patterns during the maturation phase of somatic embryogenesis in hybrid larch (Larix X eurolepis). Canadian journal of forest research, 22(4): 553-560. DOI:10.1139/x92-073 |
Rajasekaran K, Hein M B, Vasil I K. 1987. Endogenous abscisic acid and indole-3-acetic acid and somatic embryogenesis in cultured leaf explants of pennisetum purpureum schum-Effects in vivo and in vitro of glyphosate, fluridone, and paclobutrazol. Plant Physiol, 84: 47-51. DOI:10.1104/pp.84.1.47 |
Tautorus T E, Fowke L C, Dunstan D I. 1991. Somatic embryogenesis in conifers. Canadian journal of botany, 69(9): 1873-1899. DOI:10.1139/b91-237 |
Thompson R G, Von aderkas P. 1992. Somatic embryogenesis and plant regeneration from immature embryos of western larch. Plant cell reports, 11(8): 379-385. DOI:10.1007/BF00234365 |
Zoglauer K, Dembny H, Behrendt U. 1992. Plant regeneration from protoplasts of Larix decidua L.by somatic embryogenesis. Wissenschaftliche Zeitschrift der Humboldt-Universitaet zu Berlin Reihe Mathematik-Naturwissenschaften, 41(3): 51-62. |
 2001, Vol. 37
2001, Vol. 37