文章信息
- 洪剑明, 贾慧君, 郑槐明.
- Hong Jianming, Jia Huijun, Zheng Huaiming.
- 水双相法分离泡桐幼苗根细胞质膜的研究
- STUDIES ON SEPARATING PLASMA MEMBRANE FROM ROOTS OF PAULOWNIA SEEDLING BY AQUEOUS TWO-PHASE PARTITIONING
- 林业科学, 2001, 37(1): 23-27.
- Scientia Silvae Sinicae, 2001, 37(1): 23-27.
-
文章历史
- 收稿日期:2000-03-16
-
作者相关文章
2. 中国林业科学研究院 北京 100091;
3. 中国林学会 北京 100091
2. The Research Institute of Forestry, CAF Beijing 100091;
3. The Chinese Society of Forestry Beijing 100091
水双相法分离植物细胞质膜是80年代后期以来逐渐成熟的一项研究技术。与传统的蔗糖密度梯度离心法根据膜囊泡的大小、密度分离的方法不同, 它是按照膜表面所带电荷的不同进行分离的, 避免了由于多种细胞器膜的大小、密度与质膜接近, 使分离出的质膜纯度不高的缺陷, 并且加快了分离速度, 更好地保持了膜囊泡的封闭性和膜蛋白的活性, 因而具有明显的优越性, 已在多种作物幼苗有关离子吸收、质膜氧化还原系统和质膜H+-ATPase的研究、跨膜信号传导等细胞生理和分子生物学研究上得到广泛地应用。(Sandstrom et al., 1987; Luster et al., 1989; Palmgren et al., 1990; 陈珈等, 1994; 洪剑明等, 1995、1999;Huang et al., 2000)但是运用此方法研究木本植物根细胞质膜的生理生化特性在国内外尚未见报道。本文详细介绍了经改进后的木本植物根细胞质膜的水双相分离纯化方法、产率和纯度鉴定结果。为今后研究苗木稳态营养优势的细胞和分子生物学机理奠定了基础。
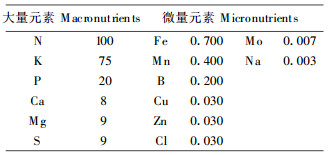
1 材料和方法 1.1 泡桐幼苗的培养毛泡桐(Paulownia tomentosa)种子采自河北省。经40 ℃温水催芽10 min, 室温浸种24 h, 种子均匀摆放在培养皿内的湿滤纸上萌发(室温约30 ℃, 光照)。约两周后, 挑选大小一致的实生苗在白瓷缸中开始预生长培养。白瓷缸内盛约2L培养液, 幼苗用泡沫置于白瓷缸盖孔中。培养液浓度为7.14 mmolN/L, 按毛泡桐幼苗最适营养物重量比例配制培养液母液(Jia Huijun et al., 1984), 列于表 1。大约一个月后, 再挑选生长一致的幼苗开始正式培养。生长过程中用调整、控制培养液pH和电导率的方法, 添加生长所需营养物质(贾慧君等, 1993)。由于质膜提取需根量较大, 培养期约2个月。预生长和正式培养均在中国林科院林研所普通温室进行, 为创造幼苗生长较适宜的条件, 用洒水保证室内湿度, 在玻璃顶上加盖竹帘降温, 有时还把瓷缸搬到遮荫处降温。
|
|
将幼根用蒸馏水漂洗后剪下通气悬浮于0.1 mmol/L的4 ℃硫酸钙溶液中1 h, 去除根表面菌类和杂质。按每g鲜重根加2 ~ 3 mL匀浆缓冲液。匀浆缓冲液成分:25 mmol/L TrisMes(pH7.8), 0.5 mol/L蔗糖(促进细胞质壁分离和维持渗透压), 1 mmol/L EDTA-Na2(螯合金属离子), 1%聚乙烯聚吡咯烷酮(PVPP), 1 mmol/L苯甲基磺酰氟化物(PMSF, 配成0.1 mol/L的异丙醇储液, 用时每100 mL匀浆液加1 mL, 抑制蛋白酶活性), 3 mmol/L二硫苏糖醇(DTT, 保护蛋白质的硫氢基), 5 mmol/L抗坏血酸。760 mm-Hg真空渗透30 s, 用高速匀浆器打磨4 ~ 5次, 每次6 ~ 8 s, 240目尼龙网过滤两次(因根中纤维素较多, 第1次可抽滤), 滤液10000×g离心10 min, 收集上清液。上清液120000×g离心20 min, 沉淀即含多种膜成分的粗膜制剂(M F, microsomal fraction)。
1.2.2 水双相系统的制备(1) 浓度约20%(W/W)的葡聚糖T-500储液的配制 取22 g葡聚糖T-500干粉(有少量吸湿), 加入78 mL双蒸水, 60 ℃以上水浴搅拌, 溶解后取5 g定容于25 mL容量瓶, 再加入到长度为y的恒温套管中, 25 ℃恒温水浴下测定旋光度, 并代入下列公式中计算出精确的浓度。公式为:{悬光仪读数×25(mL)/[199×x(g)×y(dm)]}×100%。其中x为所取待测液的精确克数, y为测定管长度(此实验中为2.2 dm)。(2)5×混合储备液的配制 按下列浓度的5倍配制:5 mmol/L磷酸钾缓冲液, 5 mmol/L KCl, 0.1 mmol/L EDTA-Na2, 用KOH或HCl调整pH至7.8。(3)水双相及上、下相储液的配制 按所需配制水双相的重量(此处视同体积)计算并称取蔗糖(浓度为250 mmol/L), 然后加入双蒸水和5×混合储备液, 振荡混匀并溶解; 最后加20%葡聚糖T-500储液和浓度为40% (W/W)的聚乙二醇(PEG)-4000储液, 温和混匀。直接用来分离纯化质膜的水双相其T-500和PEG-4000在计算称取储液量时应包括分离时加入粗膜的重量, 用来制备上、下相的水双相只需按所配制的量计算需加入的T-500和PEG-4000;所加入的5×混合储备液均按需配制水双相的1/5量计算; 加入双蒸水量为需配制水双相的重量减去以下各项之和, 即:蔗糖、T-500和PEG-4000储液、5×混合储备液的用量。用来制备上、下相的水双相混匀后倒入分液漏斗中, 于4 ℃冰箱内静置分相过夜, 次日分别收集上、下相备用(如无污染可在冰箱内保存数月)。
1.2.3 细胞质膜的分离和纯化粗膜沉淀用重悬浮缓冲液(0.25 mol/L蔗糖, 5 mmol/L磷酸钾缓冲液pH7.8, 5 mmol/L KCl, 1 mmol/L DTT, 1 mmol/L PMSF, 0.1 mmol/L EDTA-Na2)悬浮后, 精确定重至事先准备好的水双相液重量的1/3, 待M F完全均匀悬浮后加入到水双相系统中(水双相中除具有与重悬浮缓冲液相同的成分外, 与粗膜制剂混合后体系内还应分别含有6.0%~ 6.5%左右的葡聚糖T-500和聚乙二醇4000, 此时还应现用现加1 mmol/L DTT, 1 mmol/L PM SF), 上下颠倒充分摇匀, 100×g离心5 min。小心吸取90%的上相液(U1 upper phase 1), 加入到事先准备好的下相液中, 重新分离一次; 同时, 将吸出90% U1后的下相液(L1 lower phase 1)中加入事先准备好的上相液再回收(为提高质膜收率)。此时上相液(U2)为分离后的正面向外的质膜囊泡(指未将质膜朝向细胞质一侧翻转向外的一类囊泡。PM-ROV, plasma membrane right-out vesicles, 有时简称PM), 小心吸出90% U2; 同时, 将再回收后的上相液(U1')的90%吸出, 用事先准备好的下相液重新分离一次, 得到U2'; 小心吸出90% U2', 与U2混合后加入适量的重悬浮缓冲液(或特定的目的缓冲液), 120000×g离心20 min, 收集沉淀悬浮后即得到纯化的质膜囊泡, 可用于各种标记酶和反应的测定。
1.3 蛋白质含量的测定参照Brandford(1976)的方法, 测定时加入0.01%的TritonX-100。
1.4 各种标记酶的测定 1.4.1 VO4-3敏感的ATPase活性(PM)参照Sandstrom(1987)。pH6.5。Na3VO4浓度1 mmol/L。
1.4.2 NO3-1敏感的ATPase活性(液胞膜)参照1.3.1。pH7.5, NaNO3浓度50 m mol/L。
1.4.3 二磷酸次黄嘌呤酶(IDPase, 高尔基体)参照Green(1983)的方法。
1.4.4 乙醇脱氢酶(ADH)的测定(细胞质)参照Racker(1955)的方法。
1.4.5 细胞色素c还原酶的测定(内质网)参照Lord(1983)的方法。
1.4.6 细胞色素c氧化酶的测定(线粒体)参照Hodge(1974)的方法。
用于各项测定的膜囊泡可在pH6.5含5 mmol/L Tris-Mes, 0.25 mol/L蔗糖的保存缓冲液中-70 ℃保存。
1.5 质膜氧化还原活性的测定 1.5.1 铁氰化物还原酶(FCR)的测定在1 mL反应体系中先加入10 ug膜蛋白, 2 uL 5% TritonX- 100, 处理10 min后加入反应缓冲液:1 mmol/L K3Fe(CN)6, 0.25 mol/L蔗糖, 20 mmol/L Tris-Mes (pH7.0), 反应以加入100 umol/L的NADH启动, 30 ℃暗反应20 min, 转入冰浴终止反应。420 nm处比色测定K3Fe(CN)6量, 与对照相减即为被还原的K3Fe(CN)6量。空白不加膜、K3Fe(CN)6及NADH, 对照不加NADH, 其它条件相同。
1.5.2 EDTA-Fe3+还原酶的测定在1 mL反应体系中先加入5 ~ 10 ug膜蛋白, 1 ~ 2 uL 5% TritonX-100, 处理10 min后加入反应缓冲液:0.25 mol/L蔗糖, 20 mmol/L Tris-Mes(pH7.0), 5 mmol/L MgCl2, 500 umol/L EDTA-Fe3+, 500 umol/L BPDS(bathophenathrolinedisulfonic acid), 反应以加入200 umol/L的NADH启动, 30 ℃反应20 min, 转入冰浴终止反应。535 nm处比色测定EDTA-Fe3+与BPDS生成的粉红色产物。空白不加质膜, 其它条件相同。
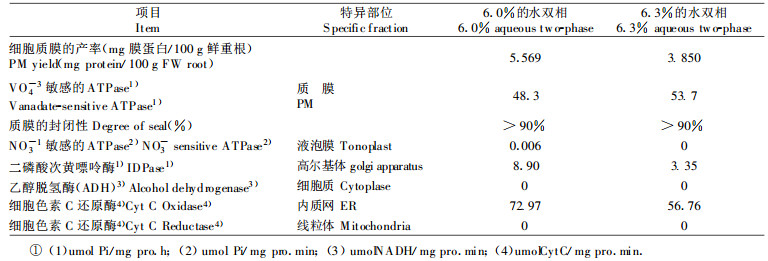
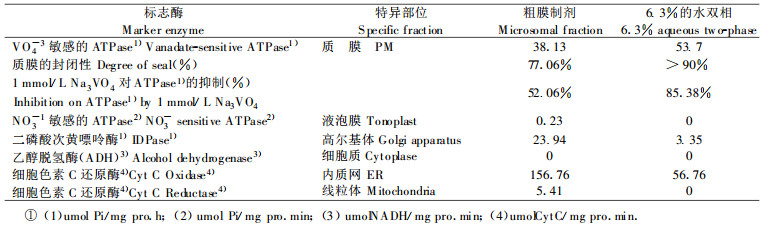
2 结果和分析 2.1 泡桐根细胞质膜的产率和纯度鉴定由于木本植物根培养时间长, 比培养1周左右即可取材的草本植物玉米新鲜根表面吸附的菌类和杂质多, 我们在用预冷的蒸馏水漂洗后, 将其放入0.1 mmol/L的4 ℃硫酸钙溶液中通气处理, 使根表面的菌类和杂质与硫酸钙形成絮状沉淀, 取出根再用蒸馏水漂洗后匀浆破碎细胞。根据木本植物根部木质化程度高, 根内木质素和纤维素多的特点, 我们在取材时尽可能选较为幼嫩的根, 并将匀浆次数由2 ~ 3次增至4 ~ 5次, 使根细胞充分破碎。参考有关文献草本植物水双相法分离采用的双相浓度选试范围为5.5%~ 7.0%, 一般在6.0%~ 6.5%(Hodges et al., 1986)。根据实验材料培养较为困难的实际情况和双相浓度越高, 质膜收率越低的特点, 及前期初试结果, 采用了6.0%和6.3%两种双相浓度分别进行质膜囊泡的分离和纯化。此外, 针对初试中发现泡桐根酚含量较高, 氧化强烈, 在取材和操作过程中根易褐变的情况, 我们在匀浆缓冲液中加入了抗氧化剂抗坏血酸和酚类的吸收和稳定剂PVPP, 有效地减少了根的氧化作用。鉴于木本植物根生长缓慢, 取材量少, 对以往第1次水双相分离后弃之不用的下相液用新的上相液进行了再回收, 使最终分离得到的质膜增加了约1/3, 进一步提高了质膜的收率。我们用30 g根分离出粗膜制剂后平均分成两份, 分别用6.0%的葡聚糖T-500(下相)、聚乙二醇4000(上相)和6.3%的葡聚糖T-500(下相)、聚乙二醇4000(上相)两种双相浓度分离纯化, 收集各自最终的上相液进行蛋白含量和质膜纯度的测定, 结果见表 2、表 3。
|
|
|
|
经分析比较表明, 使用6.3%的水双相系统分离纯化的质膜蛋白收率略低于6.0%的水双相系统分离纯化的质膜蛋白, 但质膜的纯度和封闭性等指标均高于6.0%的水双相系统分离纯化的质膜(质膜封闭性的计算方法为:加入TritonX-100测得的ATPase活性减去未加TritonX-100时的活性, 再除以加入TritonX-100测得的ATPase活性, 比值越大, 表明封闭性越高, >90%说明比值大于0.9);同时与未用水双相系统分离之前的粗膜制剂比较, 质膜的纯度大幅度上升, 其它各种膜成分的含量大幅度下降。质膜上具有较高的细胞色素C还原酶活性(56.76 μmol Cytc.mg-1Pro.min-1)的原因是质膜上存在CytP-450还原酶活性, 能还原Cytc, 因而能测出较高的细胞色素C还原酶活性(详见Larsson et al., 1987; Palmgren et al., 1990的结果和讨论); 相对于粗膜制剂156.76 μmol Cytc.mg-1Pro.min-1的值56.76只占其大小的约1/3, 说明粗膜组分中的细胞色素C还原酶成分已被除去大部分。因此, 6.3%的水双相系统分离纯化的质膜已基本达到了对草本植物质膜分离纯化的标准(Sandstrom et al., 1987; Ward et al., 1989; Palmgren et al., 1990), 适于进一步在亚细胞水平上研究稳态营养苗木根细胞质膜的物质运输和氧化还原等特性。在此基础上我们测定了用水双相法分离的根细胞质膜氧化还原活性, 结果见表 4。
|
|
经测定表明, 用6.3%的水双相系统分离纯化的根细胞质膜其氧化还原活性显著高于用6.0%的水双相系统分离纯化的质膜。由于二硫苏糖醇(DTT)对Fe3+的还原有影响, 我们在保存缓冲液中未使用该成分。对于两种氧化还原反应测定所需的质膜用量经比较确定, 铁氰化物还原酶活性测定以10 ug为宜, EDTA-Fe3+还原酶活性测定以5 ug为宜, 这样既能节省质膜的用量, 又能得到理想的结果。去污剂TritonX-100的用量对实验结果也有较大影响, 以TritonX-100 :膜蛋白=10 ~ 15:1(W/W)较为合适(我们使用的是10:1)。用于各项反应测定的质膜在分离纯化后最好分装成小管于-70 ℃(-20 ℃可保存1个月)保存, 避免反复冻融对膜蛋白活性的影响。
3 结论通过对所提取的泡桐幼苗根细胞质膜蛋白质含量、细胞器各项标记酶指标、以及质膜氧化还原活性的测定和比较分析:确定了6.3%的葡聚糖(Dextran)T-500和6.3%的聚乙二醇(PEG)4000为主组成的两相系统分离的泡桐根细胞质膜具有较高的收率、纯度和氧化还原活性, 质膜的封闭性大于90%, 其各项指标基本符合对细胞质膜进行生物学和生理生化功能研究的要求。在匀浆介质中添加抗坏血酸、加大聚乙烯聚吡咯烷酮的用量, 对第1次双相分离后下相液中剩余的质膜进行了再回收等对草本植物水双相法分离细胞质膜技术的改进, 适合于木本植物泡桐根细胞质膜的分离纯化。该方法的建立为在细胞和分子水平上研究林木根系对离子吸收机理与生长发育的关系打下了基础。
洪剑明, 等. 1995. 玉米根细胞质膜硝酸还原酶的研究. 植物学报, 37(12): 927-933. |
洪剑明, 等. 1999. 玉米根细胞质膜硝酸还原酶与EDTA-Fe3+还原酶活性的关系. 首都师范大学学报, 20(1): 61-65. |
贾慧君, 郑槐明. 1993. 兰考泡桐幼苗稳态矿质营养比较研究. 北京林业大学学报, 15(3): 12-17. DOI:10.3321/j.issn:1000-1522.1993.03.016 |
陈珈, 王建华. 1994. 玉米根细胞膜铁氰化钾还原酶. 植物生理学报, 20(1): 69-76. DOI:10.3321/j.issn:1671-3877.1994.01.009 |
Bradford M M. 1976. A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principles of proteindye binding. Anal.Biochem., 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Green J R.The golgi apparatus.In: Hall J L & Moore A L eds.Isolation of membranes and organelles from plant cell.London: Academic Press, 1983, 135~152
|
Hodges T K, Leonare D I. 1974. Purification of a plasma memb rane adenosinephosphatase from plant roots. Methods Enzymol., 32: 392-406. DOI:10.1016/0076-6879(74)32039-3 |
Hodges T K & M ills D.Isolation of plasma membrane.In: M ethods in enzymology.Academic Press Inc.1986, Vol.118: 41~54
|
Huang Qing-ni, Hong Jian-ming, et al. 2000. Effect of trypsin on plasma membrane bound ATPase and NADH-Fe3+ reductase. Plant Physiol. |
Jia Hui-jun, Ingestad T. 1984. Nutrient requirements and stress response of Populus simonii and Paulownia tomentosa. Physiol.Plant, 62(2): 117-124. |
Larsson C, Widell S, et al.Preparation of high-purity plasma memb ranes.In: Packer L & Douce R eds.M ethods in enzymology.Academic Press Inc.1987, 148: 559~568
|
Lord J M.Endoplasmic reticulum and ribosomes.In: Hall J L & M oore A L eds.Isolation of membranes and organelles from plant cell.London: Academic Press, 1983, 119~134
|
Luster D G, Buckhot T J. 1989. Purification and identification of a plasma memb rane association electron transport protein from Maize(Zea may L.) roots. Plant Physiol., 91: 1014-1019. DOI:10.1104/pp.91.3.1014 |
Palmgren M G, Askerlund P, et al. 1990. Sealed inside-out and right-side-out plasma membrane vesicles.Optimal conditions for formation and separation. Plant Physiol., 92: 871-880. DOI:10.1104/pp.92.4.871 |
Racker E.Alcohol dehydrogenase from baker' s yeast.In: Colowik S P & Kaplan N O eds.M ethods in enzymology.Academic Press Inc.New York.1955, 1: 500~503
|
Sandstrom R P, Deboer A H, et al. 1987. Latency of plasma membrane H+-ATPase in vesicles isolated by aqueous phase patitioning. Plant Physiol., 85: 693-698. DOI:10.1104/pp.85.3.693 |
Ward M R, Grimes H D, et al. 1989. Latent nitrate reductase activity is associated with the plasma membrane of corn Roots. Planta, 177: 470-475. DOI:10.1007/BF00392614 |
 2001, Vol. 37
2001, Vol. 37