文章信息
- 郝贵霞, 朱祯, 朱之悌.
- Hao Guixia, Zhu Zhen, Zhu Zhiti.
- 转CpTI基因毛白杨的获得
- OBTAINING OF COWPEA PROTEINASE INHIBITOR TRANSGENIC POPULUS TOMENTOSA
- 林业科学, 2000, 36(专刊1): 116-119.
- Scientia Silvae Sinicae, 2000, 36(专刊1): 116-119.
-
文章历史
- 收稿日期:1998-11-09
-
作者相关文章
2. 北京林业大学 北京 100083
2. Beijing Forestry University Beijing 100083
毛白杨是我国特有的树种, 与其他派别的杨树相比抗性较强, 品质优良, 生长迅速。但蛀干害虫桑天牛专门危害毛白杨, 造成了很大损失。生物技术的发展为害虫防治提供了一条崭新的途径, 人们寄希望于通过基因工程手段导入外源抗虫基因培育抗虫新品系。McCown (1991)将苏云金杆菌毒蛋白(B.t毒蛋白)导入银白杨×大齿杨, 获得一株转基因植株, 并对舞毒蛾幼虫有毒杀作用, 国内的研究者同样将B.t毒蛋白基因导入黑杨派树种获得抗虫转基因植株(陈颖, 1995; 田颖川, 1993; 王学聘, 1997), 但害虫易对B.t毒蛋白产生耐受性的问题不容忽视。豇豆蛋白酶抑制剂(Cowpea Trypsin Inhibitor, CpTI)属丝氨酸蛋白酶抑制剂, 是一种天然的抗虫物质(Hilder, 1987), 作用位点是胰蛋白酶的活性中心, 其杀虫机理在于抑制害虫必须的消化酶活性, 并通过神经系统的反馈, 使害虫产生厌食, 最终使害虫因缺乏必须氨基酸而非正常发育或死亡。与B.t毒蛋白相比, CpTI具有抗虫谱广, 对人畜无副作用以及害虫不易产生耐受性等优点。刘春明等分离克隆了CpTI基因, 已获得了转基因抗虫烟草、棉花等(刘春明, 1992; 1993; 王伟, 1998)
本文通过根农杆菌介导法首次成功地将经过修饰的CpTI基因转入毛白杨(Populus tomentosa Carr.), 获得了再生植株, 并对其进行了分子生物学鉴定。
1 材料和方法 1.1 菌种和质粒根农杆菌LBA4404, 携带质粒pBinΩSCK含豇豆胰蛋白酶抑制剂(CpTI)基因
1.2 毛白杨转材料毛白杨优良无性系1285易县雌株(Populus tomentosa)和毛新杨×毛白杨(P.to-mentosa×P.bolleana)×P.tomentosa杂种试管苗在附加和的培养基上继代。
1.3 农杆菌培养将根农杆菌pBinΩSCK划于含50mg/L利福霉素(rif)、50mg/L卡那霉素(km)的YEB平板上, 置于28℃恒温培养箱培养2d。从平板上挑取单菌落, 加入含rif (50mg/L)、km (50mg/L)的液体培养基中, 28℃180~200 r/min振荡培养过夜。次日早晨取0.8~1mL菌液加至20mL新鲜YEB培养基中, 不加抗生素, 加入20μL乙酰丁香酮, 使其终浓度为500mol/L继续振荡培养3~5h。菌液OD600约0.3~0.6左右, 可用于转化。
1.4 叶盘法转化杨树在无菌条件下, 取生长健壮的无菌苗叶片, 切成0.5cm×0.5cm~1.0cm×1.0cm, 预培养1~2d。然后在稀释的菌液中浸染10~20min。取出叶片切块, 用无菌滤纸吸干后, 转入覆有一层无菌滤纸的共培养培养基(MS附加6-BA、IAA、ZT各0.25mg/L)上于25℃下暗培养2~3d。转化叶片移入选择培养基(共培养培养基补加km30mg/L和头孢霉毒500mg/L)上, 暗培养7~10d后, 移至光照16h、温度25℃下培养。每次实验设2种对照, CK0为在相同条件下不接种菌液的外植体在不含抗生素的培养基上, CK1为在相同条件下不接种菌液的外植体在含抗生素的培养基上。将获得的转化芽切下和对照未转化芽同时接种在生根培养基(1/2MS附加IBA0.2mg/L、km50mg/L)上, 进行生根培养, 培养条件为光照16h、温度25℃。当转化植株长至5~10cm时移栽。
1.5 分子检测采用CTAB法提取转化植株和对照植株DNA, 进行PCR及PCR-Southern检测。PCR鉴定采用常规方法进行, 所使用引物为:
5'端引物:5'—AAAATGAAGAGCACCATCTTC 3'
3'端引物:5'—CTTACTCATCATCTTCATCC 3'
电泳检测扩增结果。将PCR产物的电泳胶切下转膜, 按Southern程序进行杂交。
2 结果与分析 2.1 毛白杨再生系统的建立为了保证植物遗传转化的成功, 就要有完整而有效的转化系统。实验首先研究了毛白杨叶片的分化能力, 结果发现分化能力较好的毛白杨无性系再生芽存在玻璃化现象, 不同无性系间玻璃化程度有一定差别, 其中以毛新杨×毛白杨最为严重, 高达80%以上。玻璃化苗幼芽透明, 呈水浸状, 脆弱易碎, 整株肿胀, 这种苗生根困难, 移栽很难成活。为了获得正常转化植株, 首先研究了影响毛白杨玻璃化的因素, 基本解决了再生芽玻璃化问题, 建立了简单高效的再生系统。
2.2 转化和转化植株的获得由于所构建的植物表达载体携带有新霉素磷酸转移酶(nptII)基因, 因此以卡那霉素为筛选试剂选择转化细胞。为了确定毛白杨对卡那霉素的本底抗性, 将均匀一致的叶切块分别接种于含0, 5, 10, 20, 30, 50, 70, 100mg/L km的分化培养基上, 每皿6个外植体, 进行了叶片对km抗性的临界浓度试验。培养50d后进行统计。结果表明, 低浓度的卡那霉素即抑制叶片产生不定芽。在不含km的对照培养基上, 96.6%的外植体产生大量丛生芽。在含km5mg/L和10mg/L的培养基上, 虽然产生少量不定芽, 20d左右这些芽变黄, 死亡。当km浓度大于20mg/L时, 叶片既不分化出芽也不产生愈伤。故km 20mg/L即可作为临界浓度选择转化细胞。本实验以30mg/L或50mg/L的卡那霉素筛选抗性芽。
通常未浸染的对照外植体(CK)接种在不含卡那霉素的培养基中, 暗培养10~12d后有小量淡黄色愈伤产生, 移至光下继续培养20~30d, 有大量健壮不定芽产生。而经过预培养细菌感染进行共培养和选择培养的外植体, 暗培养10~12d基本上没有愈伤产生, 叶片由深绿转成淡黄, 移至光下继续培养, 大多数外植体逐渐黄化死亡, 极少量外植体产生小量愈伤或不产生愈伤直接分化出小芽(图 1)。未经细菌感染的外植体在选择培养基上培养一段时间变黄死亡。
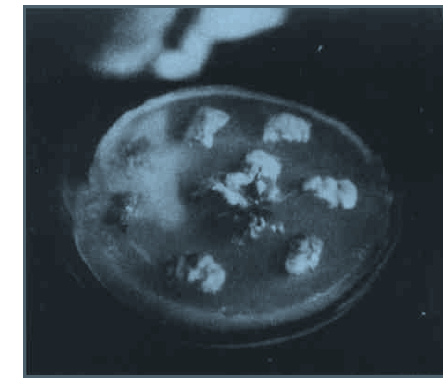
|
图 1 选择培养基上卡那霉素抗性芽的获得 Fig. 1 Obtained of transformed shoot 转化的毛白杨叶片切块在选择分化培养基(km 50mg/L)上, 培养5周分化出芽。 Transformed shoots formation from infected explants in the medium with 50 mg/L kanamycin. |
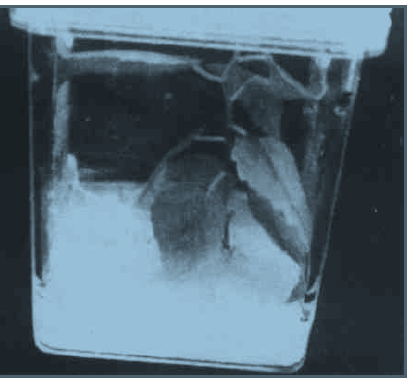
|
图 2 选择培养基上卡那霉素抗性芽生根 Fig. 2 Rooted of transformed shoot 在1/2MS附加km 50mg/L对照(左) 4周后变黄变白直至死亡; 转化芽(右)生根形成完整再生植株。 In the rooting medium with 50mg/L kanamycin the untransformed shoot turnedwhite and died (Left) while the transformed shoot rooted (Right) |
获得的抗性小芽连同外植体一起转至含km50mg/L的筛选培养基上筛选, 约10~15d待芽长至2~3cm时, 再切下移至含km50mg/L的生根培养基中。在第2次筛选中, 真正具卡那抗性的小芽可长大, 部分假阳性植株被淘汰。将对照植株和卡那抗性芽或枝芽接种于含有km50mg/L的同一GA7盒子中, 对照植株在选择压力下生长一段时间, 叶片逐渐变黄, 根本不能生根, 最后完全死亡, 而转化植株约左右生出根发育成完整的再生植株图有些抗性芽移至生根培养基中并不生根慢慢长大, 叶片略黄, 也不死亡, 在基部形成较多愈伤, 这种植株亦作为假阳性个体淘汰。
2.3 转化植株移栽生根植株生长很快, 1个月左右可长至7~8cm, 将这些植株编号, 切成数段进行快速繁殖, 来源于同一植株的切段编号相同, 这些植株长大后可移栽至花盆中。在实验中发现, 未经转化的对照植株, 无论是直接移栽到蛭石中还是营养土中, 都较容易成活, 成活率达90%以上。而转化植株的移栽则较为困难, 挑选生长健壮、根系发达的转化植株进行移栽, 无论是在蛭石中还是营养土中, 植株1周左右萎蔫死亡。经过实验, 先在1/10MS营养水中培养转化植株, 待其生出大量白色根后再进行移栽, 成活率可达70%以上。现已经将20个转化株系移栽成活。田颍川等(王伟, 1998)研究同样表明, 转抗虫基因的欧洲黑杨再生植株从培养瓶中转到土壤中的存活率只有25%~30%。转基因植株移栽成活率高低是得到大量转基因植株的一个重要环节, 提高其成活率是十分重要的。
2.4 转化植株PCR扩增和PCR-Southern杂交取转CpTI卡那抗性植株, 提取植物基因组DNA, 以质粒pBinΩSCK作阳性对照, 以未转基因植株作为阴性对照, 进行PCR扩增。结果如图 3、4所示, 未转化植株基因组未出现PCR扩增片段。转基因的植株经PCR扩增, 得到一条和预期长度一样大小的450bp的片段, 有的样品除目的带外, 还扩增出了非特异带, 而未转化植株基因组未出现PCR扩增片段, 3次重复结果一致。其原因可能是外源DNA插入过程中发生基因重组或多拷贝插入造成的。
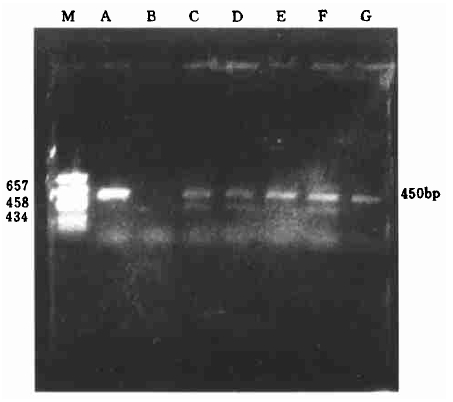
|
图 3 转豇豆胰蛋白酶抑制剂基因卡那霉素抗性植株PCR检测 Fig. 3 PCR assay of SCK gene in transgenic plants M pGEM-7zf (+) /Hae Ⅲ Marker; A 阳性对照pBinΩSCK质粒; B 阴性对照非转化植株; C—G kmr植株. M.pGEM-7zf (+)/Hae Ⅲ Marker; A pBinΩSCK plasmid DNA as positive control; B Utranformed plant sample as negative control; C-G:Transgenic plant samples. |
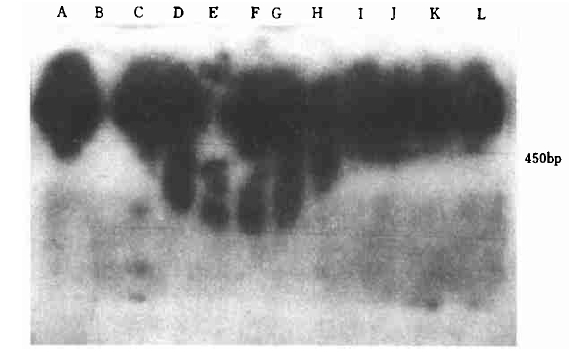
|
图 4 转豇豆胰蛋白酶抑制剂基因卡那霉素抗性植株PCR-Southern检测 Fig. 4 PCRSouthern assay of SCK gene in transgenic plants A.阳性对照pBinΩSCK质粒; B 阴性对照非转化植株; C—L kmr植株. A.pBinΩSCK plasmid DNA as positive control; B.Untransformed plant sample as negative control; C-L:Transgenic plant samples. |
为了进一步证明PCR扩增产物是目的基因片段, 将PCR扩增产物电泳后吸印于尼龙膜上, 以阳性质粒扩增产物为探针, 进行PCR-Southern杂交检测, 结果见图 3、4, CpTI转基因株的PCR阳性植株的PCR扩增产物目的带显示出较强信号, 非特异带没有显示杂交信号, 对照非转化植株没有显示信号, 说明CpTI基因已整合到杨树基因组中。
3 讨论本实验将经过修饰的CpTI基因导入毛白杨, 由于蛋白酶抑制剂抗虫谱广且害虫不易产生耐受性, 为获得不仅抗鳞翅目害虫同时也抗鞘翅目害虫的毛白杨打下了基础。实验经过严格筛选获得了大量转基因植株, 并发现转基因植株经过水培养一段时间再移栽至花盆, 大大提高了成活率, 不仅为进一步筛选抗虫效果较好的工程植株提供了条件, 也为其他转基因植物的移栽提供了借鉴。转基因杨树的抗虫鉴定目前正在进行之中结果将于另文报道取转。
陈颖, 韩一凡, 李玲, 等. 1995. 苏云金杆菌杀虫晶体蛋白基因转化美洲黑杨的研究. 林业科学, 31(2): 97-103. |
郝贵霞, 朱祯, 朱之悌. 1999. 毛白杨叶片组培再生芽的玻璃化问题探讨. 北京林业大学学报, 21(1): 68-71. DOI:10.3321/j.issn:1000-1522.1999.01.014 |
刘春明, 朱祯, 周兆斓, 等. 1993. 豇豆胰蛋白酶抑制剂在大肠杆菌中的克隆与表达. 生物工程学报, 9: 152-157. |
刘春明, 朱祯, 周兆斓, 等. 1992. 豇豆胰蛋白酶抑制剂抗虫转基因烟草的获得. 科学通报, 37(18): 1694-1697. DOI:10.3321/j.issn:0023-074X.1992.18.001 |
田颖川, 李太元, 莽克强, 等. 1993. 抗虫转基因欧洲黑杨的培育. 生物工程学报, 9(4): 291-297. DOI:10.3321/j.issn:1000-3061.1993.04.017 |
王学聘, 韩一凡, 戴莲韵, 等. 1997. 抗虫转基因欧美杨的培育. 林业科学, 33(1): 69-74. DOI:10.3321/j.issn:1001-7488.1997.01.010 |
王伟, 朱祯, 邓朝阳, 等. 1998. 陆地棉栽培品种新陆早1号转基因抗虫植株的获得. 高技术通讯, 8(5): 1-5. DOI:10.3321/j.issn:1002-0470.1998.05.001 |
Hilder V A, Gatehouse AM R, Sheerman S E, et al. 1987. A novel mechanism of insect resistance engineered into tobacco. Nature, 330: 160-163. DOI:10.1038/330160a0 |
MCCOWN B H, MCCABE D E, RUSSELL D R. 1991. Stable transformation of Populus and incorporation of pest resistance by electric discharge particle acceleration. Plant Cell Reports, 9: 590-594. |
 2000, Vol. 36
2000, Vol. 36
