文章信息
- 程水源, 顾曼如, 束怀瑞.
- Cheng Shuiyuan, Gu Manru, Shu Huairui.
- 银杏叶黄酮研究进展
- ADVANCES IN RESEARCH ON FLAVONOIDS IN GINKGO BILOBA LEAF
- 林业科学, 2000, 36(6): 110-115.
- Scientia Silvae Sinicae, 2000, 36(6): 110-115.
-
文章历史
- 收稿日期:1999-09-06
-
作者相关文章
2. 山东农业大学园艺系 泰安 271018
2. Shandong Agricultural U niversity Taian 271018
银杏是最重要的多功能树种之一, 它的药用价值更显突出, 其主要有效活性成分是黄酮类化合物和萜类内酯。到目前为止, 从银杏叶片分离出38种黄酮类物质, 已经明确结构的有20多种, 其中黄酮及其苷类28种, 双黄酮6种, 儿茶素4种(程水源等, 1998a; Andreas et al., 1992)。近年来关于银杏叶用栽培及品种选育、叶制剂研制与开发、提高叶黄酮含量、叶黄酮含量变化及其影响因子、黄酮形成的内部机制、黄酮体外有机合成及利用生物技术工厂化生产黄酮等(程水源等, 1998b, 1998a, b, c, d; 陈俊杰等, 1992; 陈学森等, 1997d; 房建军等, 1998; 姜玲等, 1998, 1999; 孙视等, 1997; 孙天恩等, 1998; Ben-Tal et al., 1997; Carolyn et al., 1994; 1996;Cheng et al., 1999; Curry, 1997; David et al., 1998; Ju et al., 1995; Larrigaudiere et al., 1996; Peter et al., 1998; Sze-Chung et al., 1998)方面的研究报道骤增, 笔者参考文献并结合自己的研究, 综述银杏叶黄酮的国内外研究进展。
1 银杏叶黄酮合成代谢途径对黄酮合成途径的研究由来已久, 但以银杏为试材进行研究至今仍未见报道。借助于其它植物的研究, 基本弄清了黄酮在生物体内的合成过程(杜金华等, 1997); 余迪求等, 1997; Carolyn et al., 1994; Edith et al.1973; Ju et al., 1995) (图 1)。黄酮类化合物由莽草酸酯和醋酸-丙二酸酯两条生物合成途径衍生而来, 最重要的步骤是在查尔酮合成酶催化下, 3分子的丙二酰-CoA和1分子的对香豆酰-CoA结合形成第1个具有C15架的黄酮类化合物——查尔酮, 查尔酮进一步衍生转化构成了各类黄酮化合物。通常来讲, 类黄酮泛指两个芳香环通过3碳链相互连接而成的一系列化合物, 包括黄酮类、黄酮醇类、花色素类等, 由于花色素类在光吸收上有其特点, 一般将其单独列为一类加以研究(鞠志国等, 1992; 1993), 因此本文所讨论的类黄酮物质是指除花色素外的一大类物质。
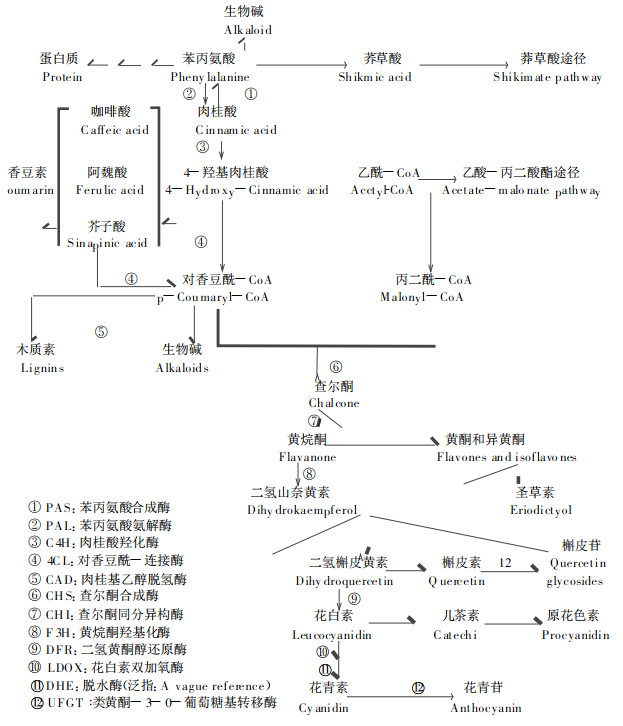
|
图 1 类黄酮生物体内合成代谢途径 Fig. 1 The synthetic and metabolic pathway of flavonoids in plant 参考Lancaster (1992), Forkman (1998), Ju (1995), Carolyn (1994), Edith (1973), 杜金华(1997), 余迪求(1997)等, 并经作者改良。Refert to Lancaster (1992), Forkman (1998), Ju (1995), Carolyn (1994), Edith (1973), Du (1997), Yu (1997) et al., and this pathway was developed by autho r. |
离体培养法合成和化学合成银杏叶黄酮也获得了可喜进展, 陈学森(1997a, d)、房建军(1998)、姜玲等(1999)利用组织培养技术, 诱导银杏叶离体培养产生愈伤组织, 在愈伤组织中发现有黄酮的积累, 并对离体培养的条件作了研究, 孙天恩等(1998)利用发根克隆及其培养技术, 在有黄酮积累的同时, 使银杏萜内酯含量几乎接近天然叶片, 陈俊杰等(1992)成功地化学合成了黄酮类化合物, 等等。
2 银杏叶黄酮合成代谢的因子 2.1 遗传因子银杏叶黄酮含量高低在很大程度上受遗传基因控制。陈学森(1997b)等通过对44个参比的银杏品种叶黄酮(8月份)含量进行测定发现, 最低含量的品种为尖底圆玲, 仅为0.95%, 最高含量的是泰山4号, 高达2.64%, 含量在1.4%~1.9%的品种占参试品种的68.4%, 反应了不同品种之间叶片黄酮含量的巨大差异和绝对多数品种叶黄酮含量又趋向的二重性。即使是同一品种, 由于遗传性别分化的不同, 也造成叶黄酮含量的差异。当然, 关于雌雄株间叶黄酮含量是否存在本质差异, 报道不一(陈学森等, 1997; 范怡梅等, 1998; 史继孔等, 1998)。晚熟品种叶黄酮含量比早熟品种高, 这可能与光合时间及光合产物积累有关(Keisuke et al., 1991)。
2.2 发育进程银杏叶黄酮含量受季节、树龄及叶片成熟度、结果与否等因子的影响。季节对叶黄酮含量的影响说法不一(程水源等, 1998b; 1999b, c; 陈秀珍, 1998; 陈学森等, 1997; 范怡梅等, 1998; 姜玲等, 1998; 史继孔等, 1998; 苑可武等, 1997; 杨柳等, 1997; 张秀全等, 1995; Carolyn et al., 1994; 1996;Hasler et al., 1993; Ju et al., 1995; Lobstein et al., 1991; Thomas et al., 1994), 但认定叶黄酮含量秋季最高的报道较多。考虑到叶产量、叶黄酮含量以及采叶与采时的关系等, 实际生产运用中秋季采叶也最受推崇。从理论上讲, 由于叶黄酮是次生代谢的结果, 它形成是以光合产物为基础, 以叶片衰老为前提, 所以叶黄酮含量秋季最高具有较高的可信度。不过, 有可能黄酮的合成有一个以上的高峰期, 如春季和秋季各1次, 到底哪一个时期高峰更高, 那需由内外条件综合决定。进一步研究证实:叶片分生组织活跃时, 叶黄酮合成较快, 但叶片本身合成能力有限, 在叶片停长接近衰老时又有一个较大的黄酮合成高峰(Thomas et al., 1994)。秋季叶片留在树上或采收后密封贮藏黄酮含量降低很少(程水源等, 1999b)。除此之外, 季节还影响叶黄酮种类及比例。Lobstein (1991)等研究认为, 山奈酚及其苷和白果黄素芽期含量高, 而黄酮醇苷和二氢黄酮分别在春叶和秋叶中含量较高, 国内学者苑可武等(1997)进一步证实和补充说明黄酮甙原在4月、5月和7月以山奈酚为主, 其它时期均以槲皮素为主, 异鼠李素比例一直很小。叶片成熟度与季节存在着较大的一致性, 但对1年多次采收或遇逆境时则不然, 由于叶片发育进程可能被促进或抑制, 所以叶黄酮种类比例与含量也会受到影响。从树龄上讲, 银杏叶黄酮含量随树龄增加呈递减趋势, 2年生银杏叶黄酮含量为2.84%, 800年生为1.00%, 前10年的总递减率为52.1%, 10年以后递减率分别为17.6% (10~20年), 0.9% (20~40年), 1.0% (40~800年) (杨柳等, 1997)。说明树龄超过20年, 银杏叶黄酮含量基本稳定。陈学森等(1997c)认为幼龄银杏叶黄酮含量有一个先上升后下降的过程, 实生苗和嫁接苗分别在3、4年生时含量最高。关于结果对叶黄酮含量的影响有两种截然相反的观点(陈学森等, 1997b, c; 陈秀珍, 1998) : (1)结果株叶黄酮比不结果株低; 2)结果株叶黄酮含量比不结果株高, 且二者之间的差距是从每年7月份开始拉大的。并有学者推测结果和树龄是通过对树体和叶片生长势的影响来调控叶黄酮含量的(陈学森等, 1997c)。
2.3 生态条件不同生态型银杏叶黄酮含量有差异, 即使是同一生态型, 不同年份叶片黄酮含量也不同, 但也有认为不同产地银杏叶黄酮含量及变化规律差异不明显(Osamu, 1988)。进一步的研究认为:不同产地的老树之间银杏叶黄酮含量差异不显著, 说明生态型的影响主要发生在银杏幼龄期(程水源等, 1999b; 杨柳等, 1997), 其中光、温对叶黄酮含量的影响最大。前人报道黑暗条件下无黄酮合成, 且黄酮合成与光密度和光质有关, 光强较低的白光+紫外光比光强大得多的白光更能促进黄酮的合成, 光照时间长短与黄酮合成无直接关系(程水源等, 1999b; Sze-Chung et al., 1998; Carolyn et al., 1994; Max, 1990; Osaum, 1988)。适当的低温和较大的温差有利于黄酮合成。深入的研究说明, 适当频率的高低温转换能诱导黄酮的合成, 低温不是促进黄酮合成的直接原因(Curry, 1997)。另有报道认为适当干旱有利于黄酮合成, 叶片含水量与黄酮含量呈负相关(Ben-Tal et al., 1997; Hasler et al., 1993)。最近孙视等(1997)报道影响银杏叶黄酮积累的重要生境因子是纬度、日照百分率、年降雨量和年平均温度, 并提出选择一定逆境胁迫的次适宜环境建立银杏采叶园, 有利于提高叶内黄酮含量。
2.4 栽培措施苗木繁殖方式对银杏叶黄酮含量影响较大, 实生苗比嫁接苗、萌蘖苗、扦插苗叶黄酮含量高, 认为这是由于实生苗生长势相对较强的缘故(陈学森等, 1997c; 史继孔等, 1998)。通过矮化整形重剪可以提高叶黄酮含量, 主要是因为保持枝龄年轻和增大了根冠比(Max, 1990)。土壤中过量的N肥尤其是银杏生长后期的过量N肥由于促进了蛋白质合成而降低了黄酮类物质含量, K肥的效果与N肥相反。另外, 增大栽植密度、1年多次采收、叶面配方施肥、喷布生长调节剂等栽培措施主要是通过影响银杏叶面积、叶厚薄、叶量等来提高产叶量, 但对叶黄酮相对含量的影响无具体的研究报道(程水源等, 1999c; 陈学森等, 1997b; 王义强, 1995; Pater, 1998)。
3 银杏叶黄酮合成代谢的调控机制 3.1 基因调节植物中花色苷(包括黄酮合成)的生物合成具有特定的时空调节机制。通过采用同位素示踪技术和突变体实验系统对其它植物的研究结果表明:花色苷的形成受两套基因控制, 即结构基因和调节基因, 结构基因编码催化从图示苯丙氨酸到花色苷形成的十几种酶, 这在不同植物中是相似的, 调节基因指调节结构基因活性的基因, 正是这类调节基因控制结构基因的时空表达, 决定黄酮类物质积累的时间和分布(原永兵等, 1995; Keisuke et al., 1991)。在金鱼草、矮牵牛等植物中黄酮合成的有关酶基因的克隆已成功(余迪求等, 1997)。银杏叶中未见调节基因的报道, 对结构基因编码的十几种酶的研究仅涉及PAL (姜玲等, 1998; 原永兵等, 1995)。
3.2 生理生化调节黄酮类化合物在生物体内合成代谢的起源为光合产物, 合成的前体是简单酚类物质, 其酚类物质的合成是从PAL催化苯丙氨酸脱氨反应开始的, 但在酚类物质向类黄酮的转化过程中同时存在多种成份的合成途径, 至少还包括花青苷、木质素、角质等(鞠志国等, 1992)。在黄酮类化合物合成代谢过程中, 以银杏叶、梨果皮、苹果皮、葡萄、燕麦初生叶、欧芹叶片、烟草和大豆等(姜玲等, 1998; 原永兵等, 1995; 鞠志国等, 1992; 1993;Carolyn et al., 1996; Edith et al., 1973; Elmaon et al., 1988; Eric et al., 1983; Joseph et al., 1985; Ju et al., 1995; Max, 1990; Osamu, 1988; Rose et al., 1996; Soon, 1979; Weely et al., 1983; Wolfgang et al., 1986)为试材, 其酶的研究也仅涉及到PAL、CHS、CHI、UFGT、4CL。有观点认为PAL是最关键的限速酶, 且为光诱导酶, CHI和UFGT有重要作用; 有观点认为CHS是限速酶, 其活性与光照有关, UFGT具有重要的作用; 还有观点认为4CL处于形成不同类型产物的转折点, 具有多种同工酶, 其作用和地位十分突出, 等等。许多报道认为PAL活性与叶黄酮合成积累正相关, 但也有PAL酶活性高时, 叶黄酮含量下降的报道, PAL只有在光下才与叶黄酮合成有关。关于PAL的作用机理有两种说法(Max, 1990; Soon, 1979) : (1)叶片黄酮合成的加快与PAL钝化系统的解除有关; (2)黄酮积累速度的增加是PAL浓度和活性增加直接作用的结果, 且PAL是通过光敏色素系统而最终起作用的, 红光促进叶黄酮合成, 远红光可抵消红光的作用。另外PAL的活性可以被反应产物如肉桂酸所抑制, 从而降低叶黄酮含量。CHS与黄酮合成的关系好象更紧密些, CHS的活性有时也需光的诱导, 但对CHS的作用机理方面的研究不如PAL成熟。对于CHI来讲, 有观点认为无需此酶, 黄酮的异构、转化照样自动进行, 但有CHI, 可以加速这个过程(Carolyn et al., 1996; Joseph et al., 1985; Max, 1990; Weely et al., 1983)。光合作用及光合产物与叶黄酮含量正相关, 但更多的报道是它们之间无直接关系, 有证据证实叶片中光合产物糖浓度的提高、叶干物质重的增加时并未见叶黄酮合成的加速和叶黄酮含量的增加, 相反有时糖浓度较低时, 可见叶黄酮的大量积累, 但离体培养时增加糖浓度, 有黄酮物质积累, 以葡萄糖效果最佳, 因此许多学者把较低的黄酮含量归结为黄酮合成前体的缺乏(原永兵等, 1995; 郑穗平等, 1998; Andrew et al., 1976; Eric et al., 1983; Max, 1990)。由于从光合初级产物到叶黄酮次生物质的形成过程的复杂性, 因此很难找到光合与叶黄酮合成和含量的直接关系是可以理解的。另外伴随叶绿素的降解, 黄酮含量上升(姜玲等, 1998; Ben-Tal et al., 1997; David et al., 1998; Pater, 1998)。
内源激素中乙烯、脱落酸促进黄酮形成, 而赤霉素效果相反, 生长素暂无定论(Andrew et al., 1976; Max, 1990; Satoru et al., 1991)。关于内源激素的作用机理大多与促进成熟和酶活性有关。许多报道证实乙烯释放峰与PAL活性峰一致, 乙烯是通过促进PAL活性, 促进黄酮合成的(Max, 1990), 但另有认为乙烯是通过促进成熟来提高黄酮含量, 即乙烯通过调节叶片发育起作用, 与黄酮生物体内的合成过程无直接关系, 这在无乙烯释放峰的苹果果实研究中得到支持, 即无乙烯释放峰, 只要果实成熟, 果皮中的黄酮类物质照样积累(Sylvia et al., 1988), 这说明了成熟比乙烯对黄酮合成可能更有用。赤霉素促进生长, 降低CHS活性, 进而抑制黄酮合成, 脱落酸的作用是通过拮抗赤霉素的活性而促进黄酮合成(Max, 1990; Satoru et al., 1991)。关于内源激素的作用效果和作用机理尚需进一步探讨。
4 提高银杏叶黄酮含量的途径提高银杏叶黄酮含量的途径有两条: (1)采用各种措施提高单位面积叶产量, 从而提高银杏叶黄酮总量; (2)通过栽培、育种、生物技术、生理生化、体外合成等提高银杏叶黄酮相对百分含量。两条途径各有利弊。具体来讲, 提高银杏叶产量途径很有可能降低了银杏叶黄酮的相对含量(孙视等, 1997; 王义强, 1995; Cheng et al., 1999; Sze-Chung et al., 1998); 在通过栽培措施提高银杏叶黄酮相对含量的研究中也遇到了同样的问题, 即叶产量与叶黄酮相对含量之间存在不一致的矛盾; 对于选育种途径, 二者也不能兼顾, 往往叶片丰产的, 叶黄酮相对含量并不高, 甚至较低, 而且所选优良品系叶产量, 尤其是叶黄酮相对含量受地域影响较大, 因此推广起来十分困难(程水源等, 1999b); 利用生物技术生产黄酮虽然取得了一定的成功, 但离实际应用尚有不少距离, 如银杏叶细胞培养易褐变, 繁殖系数小, 黄酮含量低, 在发根克隆及培养中, 虽然产物中萜内酯含量几乎接近于天然叶片, 但黄酮含量甚微, 也无法得知与药用整体效应相关的黄酮种类和比例如何; 体外合成的黄酮种类单一, 工艺复杂, 成本高, 药效也无法保证; 采用生理生化途径调控银杏叶黄酮相对百分含量不失为一种有效的方法, 生物合成途径研究是天然产物研究新的生长点, 对次生代谢生物合成途径及其催化酶的研究不仅具有理论意义, 而且可能通过添加廉价的化学合成前体以及增调限速酶的活性来大幅度提高目的次生代谢产物的产量, 或者通过堵塞次要代谢支路而增加目的产物的产量(常拯战等, 1998), 但此研究在银杏上刚刚起步, 许多工作有待进一步深入。同时, 随着分子生物学的发展, 基因克隆及遗传转化技术的进步, 利用生物技术生产黄酮的前景应是乐观的。另外, 围绕银杏叶产量和叶黄酮相对百分含量做文章, 力求找到最佳结合点, 从而提高银杏叶黄酮总量, 也不失为一条有效的途径。
程水源, 顾曼如, 束怀瑞. 1998a. 银杏叶化学成分与药用研究进展. 中草药, 29(增刊): 16-18. |
程水源, 顾曼如, 束怀瑞. 1998b. 银杏叶萜内酯含量变化规律与形成机理及调控.作物栽培生理研究. 北京: 中国农业科技出版社, 61-62.
|
程水源, 顾曼如, 束怀瑞. 1999a. 银杏叶系列产品的研究现状、存在问题和对策研究. 世界林业研究, 1: 22-25. |
程水源, 顾曼如, 束怀瑞. 1999b. 影响银杏叶黄酮的因子及其评价. 湖北农学院学报, 2: 110-112. |
程水源, 顾曼如, 束怀瑞. 1999c. 银杏文献矛盾分析. 植物学通报, 3: 313-317. |
程水源. 1999d. 银杏叶制剂质量控制研究. 中国商办工业, 7: 37-38. |
陈俊杰, 李裕林. 1992. 黄酮化合物的合成方法. 厦门大学学报, 31(6): 651-656. DOI:10.3321/j.issn:0438-0479.1992.06.017 |
陈秀珍. 1998. 银杏不同生长期总黄酮含量的测定. 广西植物, 8(4): 363-364. |
陈学森, 张艳敏, 董会. 1997a. 植酸在银杏组织培养中应用的研究. 天然产物与开发, 9(2): 24-27. |
陈学森, 张艳敏, 李健, 等. 1997. 叶用银杏资源评价及选优的研究. 园艺学报, 24(3): 215-219. DOI:10.3321/j.issn:0513-353X.1997.03.002 |
陈学森, 章文才, 邓秀新, 等. 1997c. 树龄及季节对银杏叶黄酮与萜内酯含量的影响. 果树科学, 14(4): 226-229. |
陈学森, 邓秀新, 章文才. 1997d. 银杏组织培养与黄酮生产的研究. 中国农业科学, 30(6): 55-60. |
杜金华, 张开利, 郭勇. 1997. 用植物细胞培养技术生产花色苷. 山东农业大学学报, 28(4): 511-517,522. |
房建军, 阙国宁. 1998. 银杏愈伤组织生长与黄酮积累的关系. 林业科学研究, 11(2): 124-129. DOI:10.3321/j.issn:1001-1498.1998.02.002 |
范怡梅, 王勇, 谭仁祥, 等. 1998. 银杏叶黄酮苷含量与生长季节和植物性别的相关性研究. 中国中药杂志, 23(5): 267-269. DOI:10.3321/j.issn:1001-5302.1998.05.005 |
胡蕙露. 1998. 银杏N+离子诱变相关育种效应的研究. 安徽农业大学学报, 25(3): 296-299. |
姜玲, 章文才, 马湘涛. 1998. 采收季节银杏叶片黄酮醇苷含量和生理变化的研究. 湖北农业科学, (4): 40-42. DOI:10.3969/j.issn.0439-8114.1998.04.015 |
姜玲, 章文才. 1999. 银杏悬浮细胞系的建立及其黄酮糖苷的产生. 果树科学, (2): 131-134. DOI:10.3969/j.issn.1009-9980.1999.02.011 |
孙视, 刘晚苟, 潘福生, 等. 1997. 生态条件对银杏叶黄酮积累的影响. 植物资源与环境, (3): 1-7. |
孙天恩, 李根宝. 1998. 银杏发根克隆及其培养技术研究. 中草药, 29(增刊): 25-28. |
常拯战, 果德安, 钟声, 等. 1998. 银杏树龄、性别、繁殖和采叶期对叶片中黄酮、内酯含量的影响. 经济林研究, 16(2): 3435. |
史继孔, 王发渝, 李荣春, 等. 1998. 银杏树龄、性别、繁殖和采叶期对叶片中黄酮、内酯含量的影响. 经济林研究, 16(2): 3435. |
王义强. 1995. 银杏枝叶生长规律与两次采叶试验研究. 经济林研究, 13(4): 20-22. |
余迪求, 李宝健. 1997. 花色素苷生物合成的遗传和发育控制. 植物生理讯, 33(1): 71-77. |
苑可武, 孟宪蕙, 徐文豪, 等. 1997. 银杏叶黄酮含量的季节变化. 中草药, 28(4): 211-212. DOI:10.3321/j.issn:0253-2670.1997.04.008 |
杨柳, 欧阳绍湘, 辜忠春, 等. 1997. 银杏生长中黄酮含量变化规律研究初报. 湖北林业科技, (6): 5-7. |
原永兵, 鞠志国, 刘成连等.苹果果皮红色形成的机制.园艺学年评, 北京:科学出版社, 1995(1): 121-129
|
郑穗平, 郭勇. 1998. 主要营养成分对悬浮培养玫瑰茄细胞生长和花青素合成的影响. 广西植物, 18(1): 70-74. |
张秀全, 蒲风玲, 潘桂珍, 等. 1995. 银杏在不同月份的水分和总黄酮含量测定. 中国中药杂志, 20(2): 723-724. |
鞠志国, 原永兵, 刘成连, 等. 1992. 苹果果皮中酚类物质合成规律的研究. 莱阳农学院学报, 9(3): 222-225. |
鞠志国, 刘成连, 原永兵, 等. 1993. 莱阳茌梨酚类物质合成的调节及其对果实品质的影响. 中国农业科学, 26(4): 44-48. |
Andreas H, et al. 1992. Complex flavonol glycosides from the leaves of Ginkgo biloba. Phytochemistry, 31(4): 1391-1394. |
Andrew P, Michael G M. 1976. Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose, nitrate, and abscisic acid. Plant Physiol, (58): 468-472. |
Arthur C E, Willian F K. 1983. Soybean isoflavones: effect of environment and variety on composition. J Agric Food Chem., (31): 394-396. |
Ben-Tal Y, King R W. 1997. Envionmental factors involved in colouration of flowers of Kangaroo Paw. Scientia Horticulturae, (72): 35-48. |
Carolyn E L, et al. 1994. Developmental changes in the concentration and composition of flavonids in skin of a red and green appl ecultivar. J. Sci. FoodAgri., (64): 155-161. |
Carolyn E L, et al. 1996. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivators. J. Sci. FoodA gric., 71: 313-320. DOI:10.1002/(SICI)1097-0010(199607)71:3<313::AID-JSFA586>3.0.CO;2-N |
Cheng S Y et al. Studieson methods of enhancing flavonoids content of leaf in Ginkgo biloba. U. S. Chinese Health and Hygiene Journal, 1999.8: 216-217
|
Curry E A. 1997. Temperatures for optimum anthocyanin accumulation in appletissue. J. Hort. Sci., 72(5): 723-729. DOI:10.1080/14620316.1997.11515564 |
Edith L C, Neil Towers G H. 1973. Phenylal anineammonia lyase. Phytochemistry, (12): 961-973. |
David H L, et al. 1998. Flavonoid and carotenoid pigments in flower tissue of sandersonia aurantiaca(Hook.). Scientia Horticulturae, 72: 179-192. DOI:10.1016/S0304-4238(97)00124-6 |
Eric G C, Lerry W M. 1983. Karmpferol glycosides and enzymes of flavonol biosynthesis in leaves of a soybean strain with low photosyntheticrates. Plant Physiol., (77): 877-881. |
Elmaon S, et al. 1988. Insitu localization of light-induces chalcone synthase mRNA, chalcone synthase, and flavonoid end products in epidermal cells of parsley leaves. Proc. Natl. Acad. Sci. USA, (85): 2989-2993. |
Hasler A, Meier B. 1993. Ginkgo biloba-content of flavonoids and terpenes from leaves during the harvest time and from full extracts determined by chromatographic and biological methods. Planta Med, (59): 632. |
Joseph N M, et al. 1985. Spontaneous and enzymic rearrangement of naringenin chalcone to flavanone. Phytochemistry, 24(10): 2267-2269. DOI:10.1016/S0031-9422(00)83023-X |
Ju Z G, et al. 1995. Activitives of chalcone systhase and UDPG al: flavonoid-3-0-glycosyl transferase in relation to anthocyanin synthesis in apple. Scientia Horticulturae, 63: 175-185. DOI:10.1016/0304-4238(95)00807-6 |
Keisuke K, et al. 1991. Low isoflavone content in some early maturing cultivators, so-called"Summer-typeSoybeans"(Glycinemax(L)errill). Japan J Breed, (41): 651-654. |
Larrigaudiere C, Pinto E. 1996. Differential effects of ethephon and seniphos on color development of'Starking Delicious'apple. J. Amer. Soc. Hort. Sci., 121(4): 746-750. DOI:10.21273/JASHS.121.4.746 |
Lobstein A, et al. 1991. Seasonal varitations of the flavonoiol content from Ginkgo biloba leaves. Planta Med, (57): 430-433. |
Max C S. 1990. External control of anthocyanin formation in apple. Scientia Horticulturae, (42): 181-218. |
Osamu A. 1988. Photoregulation of anthocyanin synthesis in apple fruit under UV-B and red light. Plant Cell Physiol., 29(8): 1385-1389. |
Peter F R, et al. 1998. Chlorophylls, carotenoids and anthocyanin concentration in the skin of'Gala' apples during matu ration and the influence of foliar applications of nitrogen and magnesium. J. Sci. Food Agric., (76): 63-71. |
Rose A et al.Purifcation and characterization of glycosy ltrans ferases involved in anthocyanin biosynthesis in cell-suspension cultures of Daucuscarota L.Planta, 1996(198): 397-403
|
Satoru K, et al. 1991. Comparison of 1-aminocyclopane-carboxylic acid, abscisic acid and anthocyanin content of some apple cultivators during fruitgrow th and matu ration. J.Japan.Soc.Hort.Sci., 60(3): 505-511. DOI:10.2503/jjshs.60.505 |
Soon C T. 1979. Relationships and interactions betw een phenylalanine ammonia-lyase, phenylalanine ammonia-lyase inactivating system, and anthocyanin in apples. J.Amer.Soc.Hort.Sci., 104(5): 581-586. |
Sylvia M B, Richard C U. 1998. PAL and ethylene content during maturation of red and "Golden delicious" apple. Phytochemistry, 27(4): 1001-1003. |
Sze-chung C L, et al. 1998. Reduction of ligh t-induced anthocyanin accumulation in inoculated sorghum mesolotyls. Plant physiol, 116: 979-989. DOI:10.1104/pp.116.3.979 |
Thomas V, Paul G G. 1994. Accumlation of flavonoids during leaf development in Cistus laurifolius. Phytochemistry, 36(3): 591-597. |
Weely S V, et al. 1983. Chalcone isomerase in flowers of mutants of Petunia hybrida. Planta, (159): 226-230. |
Wolfgang K, et al. 1986. The role of chalcone synthase in the regulation of flavonoid biosyn thesis in developing oat primary leaves. Archives of Biochemistry and Biophysics, 250(4): 364-372. |
 2000, Vol. 36
2000, Vol. 36
