文章信息
- 殷幼平, 曹月青, 何正波, 董亚敏.
- Yin Youping, Cao Yueqing, He Zhengbo, Dong Yamin.
- 桑粒肩天牛3种纤维素消化酶的分布
- ORIGIN AND DISTRIBUTION OF THREE DIGESTIVE ENZYMES IN THE BROWN MULBERRY LONGHORN BORER APRIONA GERMARI (HOPE), (COLEOPTERA:CERAMBYCIDAE)
- 林业科学, 2000, 36(6): 82-85.
- Scientia Silvae Sinicae, 2000, 36(6): 82-85.
-
文章历史
- 收稿日期:1999-11-09
-
作者相关文章
桑粒肩天牛属天牛科沟胫天牛亚科, 是桑树及许多经济林木的重要害虫。其幼虫钻蛀并生活于活的树干中, 依靠肠道中的各种纤维素酶、半纤维素酶的协同作用分解食物中的纤维素、半纤维素。通常认为, 生物的纤维素酶由3类酶组成:内切葡聚糖酶(Endo-β-1, 4-glucanase CX酶)可作用于无定形纤维素链内的任何部位, 产生纤维寡糖和葡萄糖; 纤维二糖水解酶(Cellobiohydrolase CBH酶)从纤维素链的非还原端打断β-1, 4-糖苷键, 切下纤维二糖; β-1, 4-葡萄糖苷酶(β-1, 4-glucosidase)可水解纤维二糖和寡糖, 产生葡萄糖。
一直以来, 人们都认为昆虫是依靠其肠道内的共生生物消化利用纤维素(Cleveland, 1924; 1934; Matin, 1983; 1987; 1991; Stryer, 1988)。80年代以来, 不少的研究者发现, 许多取食并消化纤维素食物的昆虫其肠道内并没有有效的消化利用纤维素的共生生物, 它们可以分泌内源性纤维素水解酶独立的或在共生生物酶的配合下消化利用纤维素(Inoue et al., 1996; Scrivener et al., 1989; 1992a; 1992b; 1997; 1998; Schulz et al., 1986; Slaytor, 1992, 1997; Tokuda et al., 1997; Watanabe et al., 1996)。在昆虫消化纤维素的研究中, 迄今为止研究较多的是白蚁、蟑螂及天牛。低等白蚁如Reticulitermes speratus主要依靠其后肠中共生生物及自身肠道分泌的纤维素酶消化食物中的纤维素成分, 而高等白蚁主要依靠肠道分泌的内源性纤维素酶消化纤维素(Inoue et al., 1997; Slaytor et al., 1992; 1997)。目前已有白蚁纤维素酶在肠道内定位的报道(Inoue et al., 1997; Hirofumi et al., 1997; Tokuda et al., 1997), 蟑螂的纤维素酶存在部位也有一些研究(Scrivener et al., 1989; Slaytor, 1992; Zhang et al., 1993), 而天牛的纤维素酶分布, 只有少数学者做过一些工作(Mishra et al., 1978; Williams et al., 1978), 但都没有准确定位。本文首次报道了桑粒肩天牛纤维素酶在肠道内的分布, 从另一个侧面证实桑粒肩天牛纤维素酶主要来源是内源性的, 为进一步研究天牛消化纤维素的机制奠定基础, 为天牛的生物防治提供理论依据。
1 材料与方法 1.1 材料 1.1.1 桑粒肩天牛(Apriona germari (Hope))幼虫采于西南农业大学校园内桑树, 供试虫均为中等大小, 体长4~5 cm。试验前使其饥饿1 d, 排空肠道中的食物残渣。
1.1.2 主要化学试剂羧甲基纤维素钠(CMC-Na), 水杨苷(Salicin)为国产实验试剂; 对—硝基苯—纤维二糖苷(ρ-nitrophenyl-β-D-cellobioside)购于Sigma公司, 其它试剂为国产分析纯。
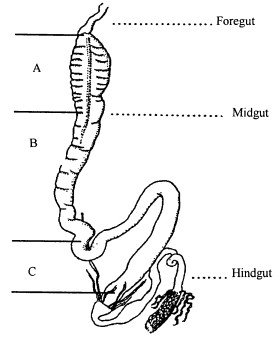
1.2 方法 1.2.1 切片的制备参照T.Inoue等(1997)的方法略有改动。冰浴下解剖桑天牛, 小心取其唾腺和肠道, 将唾腺放于0.5 mL 0.1 M pH5.5乙酸-乙酸钠缓冲液中, 剪碎抽提, 直接测定其酶活; 肠道包埋于乙酸-乙酸钠缓冲液配制的0.5%琼脂中, -20℃冷冻凝固, 分前肠、前中肠、中中肠、后中肠、后肠几部分(见图 2)分别进行冰冻切片, 切片厚度10 μ。每管150片, 装于1.5 mL离心管中, 加入1 mL上述缓冲液, 混匀用于酶活性测定。
|
图 2 桑天牛幼虫消化道 Fig. 2 Alimentary canal of the Apriona germari (Hope) A前中肠Fore-midgut; B中中肠Mid-midgut; C后中肠Hind-midgut |
CX酶以1%CMC-Na为底物, CBH酶以0.5 mM对—硝基苯—纤维二糖苷为底物, 葡萄糖苷酶以1%水杨苷为底物, 所有底物均用上述缓冲液配制。每种底物各取0.5 mL, 分别加入切片混合液100 μL (唾腺混合液加50 μL), 37℃水浴反应1 h。CX酶、糖苷酶反应后, 用Somogi-Nelson微量法(Tokuda G et al., 1997)测定所产生的还原糖, 以每小时产生1 μmol还原糖为一个酶活力单位, 分别计算CX酶、糖苷酶活性; CBH酶反应后以1 mL0.6M Na2Co3终止反应, 加3.4 mL乙酸缓冲液, 410 nm测光吸收, 以每小时产生0.1 μmol对-硝基苯为一个酶活力单位。对照设置:唾腺混合液50 μL, 其余切片混合液100 μL, 沸水浴15 min灭活后再加入不同底物, 其余测定过程相同。每1种酶设1对照。实验重复3次。
2 结果与讨论 2.1 结果桑天牛内切-β-1, 4-葡聚糖(CX), 纤维二糖水解酶(CBH), β-1, 4-葡萄糖苷酶活性主要存在肠道中, 唾腺中没有检测到酶活性, 各种酶活在肠道中的分布如图 1。从图中可以看出, 3种酶主要存在于前中肠, 中中肠也有一部分酶活性, 后中肠酶活性很低, 后肠酶活性几乎为零, 各部分酶活所占比例如表 1。

|
图 1 桑粒肩天牛3种酶在肠道中的分布下载原图 Fig. 1 Distribution of three enzymes in the alimentary canal of Apriona germari (Hope) —○—内切-β-1, 4-葡聚糖Endo-β-1, 4-glucanase, —△—纤维二糖水解酶Cellobiohydrolase, —■—β-1, 4-葡萄糖苷酶β-1, 4-glucoside. 1~2号前肠, 3~6号前中肠, 7~11号中中肠, 12~15号后中肠, 16~22号后肠. 1~2 foregut, 3~6 anterior-midgut, 7~11 mid-midgut, 12~15 hind-midgut, 16~22 hindgut. |
|
|
关于天牛消化纤维素的机理, 一直存在不同的看法, 许多学者研究发现天牛具有内源性消化酶, 认为天牛具有分解木质中碳水化合物的生理生化基础, 能分泌消化酶, 不依赖于肠道中的共生物, 而具有分泌作用的细胞主要存在于中肠前段(Zhang et al., 1993)。另一些学者却认为天牛消化纤维素也同低等白蚁一样, 是由于共生生物的作用, 或是由于随食物摄入真菌纤维素酶(Tokuda et al., 1997)。
从实验结果看, 桑粒肩天牛中肠的纤维素酶活性占总酶活性95%以上, 唾腺中没有检测到酶活性, 说明桑粒肩天牛对纤维素的消化主要发生在中肠, 后肠、直肠中酶活性几乎为零, 排除了后肠共生物分泌消化酶的可能。而一般认为昆虫中肠中共生生物是很少的(Slaytor, 1992)。从桑粒肩天牛的唾腺和消化道形态(图 2)来看也可得到同样的结论。不同生活环境及食物成分的差异使得昆虫消化道形态以及各部分长度比例不一。由于天牛幼虫以钻蛀为害, 其食物来源不成问题, 但食物中主要成分是不易消化的纤维素和半纤维素, 与此生活环境相适应, 桑粒肩天牛中肠占了消化道总长度的3/4, 中肠前端膨大, 使食物有充分的时间与消化酶作用; 前肠仅为简单的食物通道, 极短, 约为其消化道总长的1/20;后肠也仅为简单的细管, 没有特殊的共生菌囊等结构(Williams et al., 1978); 天牛的唾腺很细, 为直径仅有0.1~0.2 mm的细管, 长度为2~3 cm, 不象白蚁的膨大到可以作为消化酶的重要储存和分泌结构, 所以天牛消化酶主要应存在于中肠, 实验结果也证实了这一点。
从桑天牛组织学上看, 其前肠肠腔很细, 成为具有强大肌肉及发达内膜的食道, 引导坚硬的木质纤维食物进入中肠; 中肠前段肠腔大, 肠壁较薄, 柱状真皮细胞具有很强的分泌活性, 中中肠有一些杆状成熟细胞, 具有分泌作用, 而后中肠已很少分泌物存在(Zhang et al., 1993)。与其结构相吻合, 酶活性主要存在于前中肠, 中中肠有一部分酶活性, 后中肠酶活性则大大降低, 消化酶的这种分布从另一侧面证明了天牛纤维消化酶主要是天牛自身分泌的。
殷幼平. 1987. 天牛的解剖形态及其在天牛分类上的意义. 昆虫分类分学, 9(4): 313-320. |
殷幼平. 1986. 天牛消化道的组织学研究. 西南农业大学学报, 8(3): 111-121. |
Hirofumi watanabe, et al. 1997. Site of secretion and properties of endogenous Endo-β-1, 4-glucanase components from Reticuliterme ssperatus (Kolbe), a Japanese subterranean termite. Insect Biochem. Molec. Biol., 27: 305-313. DOI:10.1016/S0965-1748(97)00003-9 |
Inoue T, Murashima K, Azuma J I, et al. 1997. Cellulose and xylan utilisation in the lower termite Reticu litermes speratus. J. Insect Physiol, 43: 235-242. DOI:10.1016/S0022-1910(96)00097-2 |
Jeromej Kukor, Cowan D, Martin M.The role of ingested fungal enzymes in cellulose digestion in the larvae of Cerambycid beetles. 1988. Physiol. zool, 61(4): 364-371. |
Scriverner A M, Watanabe H, Noda H. 1997. Diet and carbohy drate digestion in the yellow-spotted longicom beetle Psacothea hilaris. J. Insect physiol., 44: 1039-1052. |
Scrivener A M, Slaytor M, Rose H A. 1989. Symbiont-independent digestion of cellulose and starch in Panesthia cribrata saussure, an Australian wood eatin gcockroach. J. Insect Physiol, 35: 935-941. DOI:10.1016/0022-1910(89)90016-4 |
Slaytor M. 1992. Cellulose digestion in termites and cockroaches: what role do symbionts play? Comp. Biochem. Physiol, 103B: 775-84. |
Suresh Chandra Mishra, Singh P. 1978. Polysacchari de digestive enzymes in the larva of Stromatium barvatum (Fabr), a dry wood borer (Coleoptera :Cerambycidae) Materialu. Organism, 13: 115-122. |
Tokuda G, Watanabe H, Matsumoto T, Noda H. 1997. Cellulose digestion in the wood-eating higher termite, Nasutitermes takasagoensis(Shiraki): distribution of cellulose and properties of Endo-β-1, 4-glucanase. Zoological Science, 14: 83-93. DOI:10.2108/zsj.14.83 |
Williams J, Villaroya H, Petek F. 1978. A-Glucosidases Ⅱ, Ⅲ and Ⅳ from seeds of Trifolium repens. Biochem. J., 175: 1069-1077. DOI:10.1042/bj1751069 |
Zhang J, Scrivener A M, Slaytor M, Rose H A. 1993. Diet and carbohydrase activities in three cockroaches, Calolampra elegans Roth and Princis, Geoscapheus dilatatus Saussure and Panesthia cribrata Saussre. Comp. Biochem. Physiol., 104A: 155-161. |
 2000, Vol. 36
2000, Vol. 36

