文章信息
- 冯建灿, 张玉洁, 谭运德, 张文杰.
- Feng Jiancan, Zhang Yujie, Tan Yunde, Zhang Wenjie.
- 喜树与喜树碱开发利用进展
- THE DEVELOPMENT IN RESEARCH ON CAMPTOTHECA ACUMINATA AND UTILIZATION OF CAMPTOTHECIN
- 林业科学, 2000, 36(5): 100-108.
- Scientia Silvae Sinicae, 2000, 36(5): 100-108.
-
文章历史
- 收稿日期:1999-03-30
-
作者相关文章
2. 河南省林业技术推广站 郑州 450008
2. Forestry Technique Extending Station of Henan Province Zhengzhou 450008
喜树(Camptotheca acuminata Decne.)属珙桐科(Nyssaceae)旱莲属植物。落叶乔木。分布于我国长江流域及西南各省和印度部分地区, 台湾、广西、河南等也有栽培。1966年美国的Monroe E.Wall从喜树的皮中分离出喜树碱(Camptothecin, CPT), 经肿瘤试验证明这种色氨酸-萜烯类生物碱具有抗癌活性(Wall, 1966), 从而引起了人们的广泛关注。70年代初用CPT进行人体胃肠癌的实验性治疗, 对部分病人的症状有所缓解。由于CPT的毒性和令人难以忍受的副作用如恶心、呕吐, 以及制成水溶性的钠盐后抗癌活性降低等原因, 使试验受阻, CPT的研究由此进入低潮阶段。1985年, Y. H. Hsiang发现CPT能阻断拓朴异构酶Ⅰ(topoisomerase Ⅰ, topo Ⅰ)的合成(Hsiang, 1985), topo Ⅰ是一种与细胞分裂密切相关的一种酶, 阻断这种酶的产生即可阻止癌细胞的生长, 说明CPT的作用靶是topo Ⅰ而不是拓朴异构酶Ⅱ(topo Ⅱ), 这正是CPT独特的抗癌机理(Hsiang, 1988)。这一发现掀起了喜树与CPT研究的新高潮。自1985年以来, 尤其是进入90年代后, 美国、日本、加拿大和英国等国家积极投入大量的人力、物力进行喜树研究和CPT的开发。使喜树成为红豆杉之后第2个重要的木本抗癌药用植物, 已成为世界性热门研究课题。
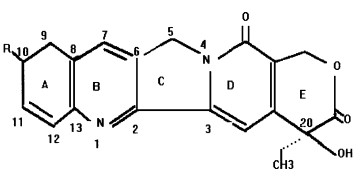
1 喜树所含的生物活性成分喜树体内化学成分十分复杂, 但具有生物活性的成分是生物碱。Wall等1966年首次从喜树皮中分离出一种新生物碱, 并将其定名为CPT, 其分子式为C20H16O4N2, 熔点为264 ~ 267 ℃(Wall, 1966), 结构式如图 1(McPhail, 1968)。
|
图 1 喜树碱结构图 Fig. 1 Molecular structure of camptothecin 喜树碱(Camptothecin):R=H; 10 -羟基—喜树碱(10-OH-Camptothecin):R=OH |
此后逐步从喜树中分离出了10-羟基喜树碱(10- hydroxycamptothecin, 10-OH-CPT), 分子式为C20H16 O5N2, 熔点为168 ~ 170 ℃、甲氧基喜树碱(methoxycamptothecin)分子式为C21H28O5N2, 熔点为254 ~ 255 ℃(Wani, 1969), 10-甲氧基喜树碱(10-methoxycamptothecin)、11-甲氧基喜树碱、(林隆泽等, 1977; 1977a;1979), 1982年又从果中分离出11-羟基喜树碱(11-hydroxy-camptothecin), 喜树次碱(C9H11ON) (林隆泽等, 1982)和脱氧喜树碱, 分子式为C20H16O3N2, 熔点为258 ~ 274 ℃(罗厚蔚, 1975; 林隆泽等, 1977; 1977a;1979)。
至此, 已从喜树中分离出20多种化学成分, 其中CPT及其类似物有8种, 它们的共同点是拥有5个环。
2 CPT在喜树树体内的分布 2.1 不同器官中CPT含量与分布规律喜树各器官中喜树碱的含量存在着较大差异, 不同学者的研究结果也不一致, 这可能是由于采样时间、部位、分析方法等引起的差异。过去一直认为果实中CPT含量最高, 次为根皮、树根及树皮, 而树枝含量较低(全国中草药编写组, 1975), 多在0.01 %~ 0.04 %之间(熊文愈, 1993)。1年生枝CPT含量为0.042 %(干基)(Liu, 1996), 根含量为0.051 %, 木质原料含量为0.05 %(Buta, 1978), 但没有指明是否包括根部。近年来的研究结果表明组织越幼嫩, CPT的含量越高; 枝(叶)龄越小, 含量越高; 皮部较木质含量高。这将导致原料生产的重大变革, 可以通过工厂化生产大量的幼嫩枝梢, 为提取CPT提供大量、高CPT含量的原料。从生长点到第8片叶组成的叶尖的CPT平均含量达0.19 %, 是整个地上部分植物材料平均含量0.044 %的4倍(Liu et al., 1998)。嫩叶中CPT的含量高达0.4 %, 是种子中含量的1.5倍、树皮中含量的2.5倍, 随着叶片的逐步长大、成熟, CPT的含量剧烈下降(Melin, 1994)。
器官中CPT含量从高到低的变化依次是枝顶端的1 ~ 3片叶、种子、根皮、4 ~ 6片叶和茎尖(Lopez-Meyer, 1994)、枝皮、茎皮、木质部。
2.2 CPT在树体内部的分布规律CPT在喜树不同器官中的含量不同, 但不同组织和器官之间在CPT含量上存在着一定的相关关系。如果侧枝中CPT含量较高, 茎中CPT含量也较高。存在这种正相关关系的还有根和茎、根和枝之间; 但叶片与其它器官、树皮和木质部间的正相关没有达到显著水平; 在同一生长季节内, 幼嫩组织与老组织间在CPT含量之间相关关系不显著(Liu, 1996)。枝龄不同, 其中CPT含量也不相同。4年生以前的幼树, 枝龄与CPT含量呈负相关, 即当年生枝包括2级、3级与4级侧枝中CPT的含量较2年生、3年生枝的含量高。4年生之后, 不同年龄的枝条在CPT含量上差别不大(Liu et al., 1998)。叶片在枝条上着生的位置不同, CPT含量差异也十分显著。从枝条的生长点到枝基部, 叶片中CPT的含量急剧下降, 第1片叶中CPT的含量为0.27 %(干基), 分别为第3、5、7、9和第11片叶的1.5、2.6、4.3、5.2和6.3倍。树龄不同叶片中CPT含量亦不相同, 随着树龄的增大叶片中CPT的含量迅速下降, 2年生树上的叶片中CPT的含量是3年生树上叶片含量的2倍、是4年生的16倍(Liu et al., 1998)。
2.3 环境因子对树体内CPT含量的影响目前对环境因子对喜树中CPT含量影响的研究较少, 不同程度的渍水和遮荫对幼苗不同器官中CPT含量的影响完全不同。与全光照对比, 重度遮荫(27 %光照)可导致叶片中CPT含量的提高, 对茎中CPT含量没有影响, 可以导致侧根CPT含量下降, 轻度遮荫(67 %光照)反而使CPT在侧根中积累。渍水胁迫对叶片和茎中CPT含量没有影响但可增加CPT在侧根中的积累(Liu et al., 1997)。从4月到10月, 叶片中CPT含量随着季节的变化而直线下降, 下降速率达11 %。枝条中CPT的含量亦是如此, 但下降速率明显小于叶片(Liu et al., 1998), 这从另一方面反映出环境因素对喜树中CPT含量的影响。增施氮磷钾复合肥可促进喜树苗的生长, 但高生长率并没有出现伴随的喜树碱含量的升高, 甚至出现下降(Liu et al., 1999)。喜树碱为含氮化合物, 一般认为增施氮肥可以提高色氨酸的含量, 进而增加喜树碱合成所需要的可能前体。更精确的无机及有机氮肥试验目前正在进行, 以确定氮对喜树生长、喜树碱含量及其之间关系的影响。
2.4 采后贮藏与处理方法对原料中CPT含量影响贮藏不当能造成果实中CPT的损失。新采集的果实与贮藏1年以上果实相比, 前者CPT含量比后者高1倍以上(上海药物研究所植化室, 1975)。干燥方法对原料中CPT的含量也有显著影响。在气干、烘干和冷冻干燥3种处理方法中, 经冷冻干燥的原料中CPT含量高, 气干与烘干之间的差异不显著。以叶片为例, 与冷冻干燥相比, 气干和烘干可造成叶片中27 %的CPT损失(Liu et al., 1998)。这可能是由于液氮冷冻能迅速终止原料中的各种生理生化活动, 使组织中的化学成分得以保存, 而气干或烘干则会引起组织中的物质向其它形式转化。
2.5 含有CPT及其类似物的其它植物由于CPT及其类似物的独特抗癌活性, 加之喜树中CPT的含量较低, 且喜树基本上分布在中国, 人们希望能发现含量高的新资源。到目前为止已从3个不同的科中找到含CPT和甲氧基喜树碱的3种植物。分别是夹竹桃科(Apocynaceae)狗牙花属的海木狗牙花(Ervatamia heyneana T. Cooke)。茶茱萸科(Icacinaceae)假柴龙树属臭假柴龙树(臭马比木)(Nothapodytes foetida)。以及茜草科(Rubiaceae)蛇根草属的硬毛蛇根草(Ophiorrhiza mungos L.)。
3 CPT及其类似物的提取、分离与生产工艺CPT及类似物的提取与分离主要是利用这些物质不溶于水而溶于乙醇、氯仿等有机剂等方面的特性, 通过渗漉使其溶于这些溶剂中, 此后回收溶剂、结晶即可得到最终产品。
3.1 渗漉提取与萃取分离渗漉是常用的提取方法。首先是将经过粉碎原料用乙醇或石油醚渗漉, 然后将渗漉液减压浓缩, 再用氯仿提取, 蒸干氯仿即得CPT的粗提物。粗提物用甲醇-氯仿(1:1V/V)混合液溶解后, 在水浴上进行回流, 此后回收甲醇-氯仿混合液至结晶析出为止, 将结晶滤出、干燥即可得CPT精制品(林启寿, 1977)。
3.2 柱层析提取与分离柱状层析法的基本过程是先用氯仿提取, 再向提取液中加工业乙醇, 后用乙酸乙酯提取, 经常压浓缩, 即得提取液。将提取液进行柱层析, 洗脱液为含2 %、4 %甲醇的氯仿, 含2 %甲醇溶剂部分析出为CPT, 含4 %甲醇部分析出的淡黄色棱柱状晶体, 为10-OH-CPT, 得率为十万分之一(上海药物研究所植化室喜树组, 1975)。
3.3 树脂吸附提取将喜树果粉用80 %乙醇在室温下浸泡24h, 用AB-8树脂对喜树碱进行吸附, 27 ℃, 1mol/L盐离子浓度pH为8的水相为最佳上柱吸附条件; 解吸附剂为pH3的氯仿—乙醇混合溶剂(张红等, 1995)。以上3种方法相比柱层析法和树脂吸附所得产品的纯度高、得率稍低, 步骤繁琐; 而重结晶法所得产品的纯度稍低, 颜色较深, 但步骤简单, 回收率高, 后处理方便。
3.4 CPT生产工艺目前对喜树碱的生产工艺研究较少。CPT的生产工艺中的溶剂浓度、料液比例、浓缩、萃取次数是影响提取效率的主要因素。由于CPT的耐热性和耐光性较差, 关键是所有浓缩工序要在减压下进行, 生产中还必须严格避光操作, 浓缩、烘干等工序的温度不宜超过60 ℃。采用这种工艺, 以果实为原料的收得率0.02 %, 根的收得率为0.08 %(张正香等, 1993)。CPT成品的主要质量指标有: CPT含量> 92 %, 干燥失重 < 0.5 %, 熔点259 ℃~ 263 ℃, 其中最主要指标是含量(张正香等, 1993)。CPT含量的测定方法有分光光度计法(上海市卫生局, 1980; 张清民等, 1991)、荧光法(卢本芳, 1983)、红外法(杨树德, 1979)、高效液相色谱法(HPLC)(姚培潢, 1994; 涂文升, 1995)4种。以高效液相色谱法先进、方便、准确, 它是目前大家所公认的CPT及类似物分析方法。荧光法也有一些应用。
4 喜树人工栽培由于天然CPT为左旋, 目前尚没有人工合成得到左旋CPT类似物, CPT及类似物一直是靠从喜树中分离获得(顾得辛, 1995)。如何才能从喜树中获得更多的喜树碱及类似物的也受到人们的关注。
4.1 基础研究喜树研究在我国一直没有受到重视, 因此研究水平还比较低。主要有以下几方面内容:
(1) 苗期生长: 1年生苗木的高生长可分为出苗期、生长初期、生长盛期和生长后期。初期根生物量所占比例较大; 叶的比例在8月以前持续上升, 9月开始下降; 茎的生物量则在9月份所占比例最大(傅松玲, 1992)。(2)苗期光合作用与蒸腾作用变化规律: 1年生播种苗净光合速率的日变化在7 ~ 9月为双峰曲线, 即分别在中午前后出现两次高峰; 5、6、10月份为单峰。蒸腾速率的日变化一般呈单峰曲线, 与气温、照度变化一致(傅松玲, 1992)。(3)光和水胁迫对叶绿素和生物量的影响:通过6周的遮荫, 叶片的叶绿素荧光值显著高于没有遮荫叶片的叶绿素荧光值。水胁迫可使全光照和轻度遮光叶片的叶绿素荧光值迅速下降, 同时也使遮荫产生的高叶绿素荧光值消失。积水胁迫使叶片生物量显著降低, 而遮荫则能明显增加茎的生物量。在全光照或轻度遮荫(67 %光照)情况下, 水胁迫能使根生物量明显减少, 而在重度遮荫下(27 %光照)水胁迫则不能使根生物量明显减少(Liu et al., 1997)。(4)营养动态:叶片中N、P、K的含量也随生长季节的推移发生明显的变化。在生长初期N的浓度不断提高, 到6月下旬达到最大, 此后迅速下降, 8月下旬以后有所上升, 9月下旬以后又出现下降趋势直到落叶(傅松玲, 1992)。(5)花的特性:喜树的花均为两性花, 所有花的雄芯发育正常; 雌蕊发育形态可分为正常发育、中间型、败育等3种情况, 凡正常发育的雌蕊均可正常授精; 中间型雌蕊界于发育和败育之间; 败育雌蕊不能授粉(张恩汉, 1983)。这与以前将花序分雌、雄两种, 花的性别为“单性同株”或称“杂性花”, 即同一总状花序或花枝上有3种性别不同的花的结果不一致。喜树花芽分为花原基分化、花萼花瓣原基分化、雄蕊原基分化、心皮原基分化和雌雄蕊形成等5个分化过程。(6)种源及苗期生物量:周国模等对采自全国的28个喜树种源的苗期生物量进行了研究, 从中选出江西、南昌等4个生物量较大的种源, 并对苗高、地径和叶片生物量与总生物量之间的关系进行了研究(周国模等, 1999)。在不同种源的苗期试验中发现, 种源伴随有喜树碱含量的差异(Liu et al., 1998)。种源试验进一步证实了种源间喜树碱含量的显著差异(Liu et al., 1999), 为以后选择优良种源或无性系提供了依据。
4.2 栽培技术对于喜树人工栽培技术缺乏系统的研究, 在一些与此有关的书籍中对其种子处理、育苗、造林方式、造林密度等技术有简单的记载(中国树木志编写委员会, 1981)1)。对喜树的生物学特性、生态学特性、定向培育技术等方面的研究还较为少见。我国浙江、河南、黑龙江和美国的路易斯安娜州等地开始进行喜树药用林定向栽培和相应的栽培管理技术研究, 但尚无研究结果报道。
1) 浙江林学院翻印.喜树栽培技术及用途(内部资料), 1996。
危害喜树的主要害虫有角胸叶蝉、大青叶蝉、小绿叶蝉、喜树枣叶蝉(张务民等, 1990; 肖康林, 1990)、淡色缘脊叶蝉(黄学恒等, 1993)和喜树毒蛾(龚其锦等, 1993)。在对这些害虫的形态特征、生物学特性包括生活史和生长习性、天敌研究的基础上编制了分种检索表, 并提出了化学防治、生物防治、灯光诱杀和人工捕杀等防治办法。肖康林(1990)发现小绿叶蝉早期危害大春作物, 到7月份大春作物逐渐成熟, 而此时正是小绿叶蝉的繁殖高峰, 需要大量营养, 便开始取食喜树等林木的嫩梢, 8 ~ 9月份是危害高峰。可采用40 %氧化乐果1200倍液喷杀防止小绿叶蝉上树危害, 或用80 %~ 85 %氧化乐果注干进行防治。
4.3 采叶技术由于喜树幼嫩叶片中CPT含量高, 且随着生长的进行, 组织中CPT含量急剧下降, 但同时生物量却不断增大, 据此可进行多次采叶。在温室条件下以每间隔6周采叶1次获得的CPT产量最高(Vincent et al., 1997), 需要指出的是他们的试验苗木仅24株。
4.4 组织培养喜树组织培养的基本过程与其它树种一样, 首先是培养芽, 将从苗龄20 ~ 30 d的小苗上切下的嫩芽经BA(1.74 μmol)浸泡48 h, 在B5半固体培养基上可新形成大量芽; 其次是诱导根, 即从芽丛中分离出单个芽, 然后在B5培养基中加低浓度的IBA(4.9 μmol/L)诱导生根, 生根率达82 %, 最短的根诱导期为18d。最后可将繁育成功的苗木移入温室中培育, 微繁殖苗移入土壤的成活率在90 %以上(Jain et al., 1996)。在喜树组织培养中, 光照和温度及生长调节物质对愈伤组织的生长和发育、不定芽和不定根的产生、代谢产物的积累等都有不同程度的促进或抑制作用。喜树叶片在离体培养过程中, 光质、温度与2, 4-D浓度对其脱分化率有显著影响, 适宜的光质为蓝光和黄光, 其次为绿光和黑暗, 红光与白光条件下的脱分化率最低; 同时还发现蓝光有利于促进喜树叶片愈伤组织中可溶蛋白质的合成, 而红光有利于促进POD和SOD活性的提高。最适宜的叶片脱分化的温度为25 ℃, 2 mg/L为2, 4-D最佳浓度, 其次为4、1、0.5 mg/L(赵洁等, 1992)。
5 喜树悬浮培养利用离体培养的生物技术是生产CPT及其类似物的又一重要途径。它具有弥补喜树资源匮乏、保护野生资源及不受自然条件限制、产物较易分离等优点。
5.1 悬浮培养技术悬浮培养的第1步是诱导愈伤组织, 以茎作为外植体时, 诱导愈伤组织的最佳培养基为MS培养基, 加2, 4-D 0.1 mg/L, 激动素(Kinetin, KT)0. 1 mg/L, NAA 0. 1 mg/L。悬浮培养则以MS培养基加上KT 3 mg/L, 2, 4-D 0.1 mg/L和GA3 0.05 mg/L为宜。培养基中最佳碳源为3 %蔗糖, 3 %的葡萄糖和可溶性淀粉也有相近的效果。外植体的大小是决定悬浮培养细胞开始生长的关键因子, 但提高接种细胞量, 并不一定能提高最终的产量, 接种量以2 mg/mL(以细胞干重计)为佳(Kuniaki, 1974)。(注, 从参考文献的图上读出数据。)分别使用0.115 mmol/L的色氨酸和苯丙氨酸可促进细胞生长, 0.05 %的酶水解酪蛋白较其它的氨基酸混合物如胨(peptone)、酵母提取物(yeast extract)和酸水解酪蛋白(acidhydrolyzed casein)能更好地促进细胞的生长。尽管色氨酸是CPT的可能前体, 但增加培养基中的色氨酸, 并没有使细胞中CPT含量增加。
悬浮培养中培养基的最佳pH值为4.30, 对于初始pH较高的培养基, 细胞很难生长, 最终培养基的pH向酸方向降低。培养过程中的光照强度以20 Lux为好, 波长以520 ±40 nm的红光对细胞的生长有极大的促进作用, 培养温度以30 ℃, 摇床转速以184 r/min为最佳(Kuniaki, 1974)。
5.2 悬浮培养中CPT分离与纯化方法利用Miracloth过滤器从培养基中将细胞分离出来, 用足量的去离子水洗净后进行真空冷冻干燥, 再经95 %乙醇回流、超速离心、最后经硅胶柱层析, 得到的白色小颗粒即为纯化的CPT, 细胞中CPT的含量为2.54 ×10-4 %, 低于接种所用原植物5 ×10-3 %的含量(Kuniaki, 1974)。
6 CPT的人工合成与药物开发 6.1 CPT及其类似物的人工合成自CPT被证实具有抗肿瘤活性以来, 便开始了CPT及其类似物人工合成的研究工作。美国北卡州(North Carlolina)三角研究所(RTI), 以Wall博士为首的研究组, 近30年来一直从事CPT及其类似物的合成、结构与活性等方面的研究, 对CPT的开发研究起着重要的作用(Wall, 1980)。早在70年代初期, Stork和Tang根据CPT具有五元环的结构特点, 分别以吡咯烷酮和比环酮酸为原料, 先通过经典的Friedlander缩合反应建立A、B环, 然后在现成的D环位置上连接构造E环的适当碳原子, 经环合、氧化两步, 制得(±)-喜树碱(Grigg, 1990)。Wani等对喜树A、C、D、E环的结构进行了初步修饰, 提出E环的d-羟基内酯部分是保持抗肿瘤活性的必需结构(Wani, 1980)。这样以吡啶酮为原料先合成D、E环, 得到重要的三环衍生物, 再与N-(O-氨基苄叉基)-P-甲苯胺进行Friedlander的缩合反应, 生成20-支氧CPT, 再进一步氧化成CPT。
关于CPT及其类似物的合成方面的综述文章较多(郭舜民, 1994; 顾德辛, 1995; 耿玉琴, 1995; 张清民等, 1990; 小川一诚, 1995), 这里就不再详细叙述。
在喜树碱的化学结构中, A、B环的平面性是拟制DNA局部异构酶Ⅰ的重要因素, E内酯环是活性的必需基团(Wani, 1980), C14位上的空间要求也直接影响内在活性(郭舜民, 1994)。因此在合成上不仅要考虑引入的取代基, 同时要考虑环系与取代基之间的关系, 并注意取代基的性质。这种结构与治疗效果之间的关系有待于今后进一步研究。
6.2 药物开发由于CPT的毒副作用, 人们开发出了许多CPT的类似物或衍生物, 以及这些衍生物的衍生物。美国RTI的研究人员将其分为3代。第1代为喜树中天然的8种CPT类似物。目前正在研究和有限制地临床应用的为第2代, 主要有topotecan, irinotecan (CPT-11), 9-nitrocam ptothecin (9NC), 9- aminocamptothecin(9AC), 和GG211(GI147211c)几种。第3代是RTI声称要开发的新产品。Topotecan是美国史克公司发现的一种水溶性衍生物, 于1996年5月得到美国食品和药品管理委员会(FDA)的批准用来治疗卵巢癌, Topotecan已经以“Hycamtin”为商标投入市场, 同时也得到了巴西和委内瑞拉的应用许可。Irrinotecan(CPT-11)是一种水溶性半合成CPT衍生物, 由日本的Yakult Honsha Company开发, 于1996年6月获得美国FDA的批准, 在美国则获准用于结肠癌, 商品名为Camptosar(http://www.rti.org)。在日本已被准许用于卵巢癌, 在欧洲准用于非小细胞肺癌和卵巢癌。同时也被法国、西班牙、英国及欧洲的其它地区批准作为二线治癌药(McDonald, 1997; 小川一诚, 1995)。9NC, 是一种不溶于水的CPT衍生物(McDonald, 1997), 美国的FDA于1996年9月授权德克萨斯州休斯顿的圣约瑟福医院(St. Joseph Hospital in Houston, Texas)的斯特林癌症研究基金会(Stehlin Foundation for Cancer Research)独家拥有9NC(9-Nitrocamptothecin)经营权, 用来治疗前列腺癌。9-AC, 即9-氨基喜树碱, 由RTI开发, IDEC制药公司获得许可进行卵巢癌、结肠癌、肺癌、胃癌和白血病的试验性治疗。GG211是一种水溶性CPT衍生物, 由Glaxo, Inc.公司开发, 已进入Ⅱ期临床试验(McDonald, 1997)。由于10- OH-CPT的毒性小, 如果能将毒副作用较大的CPT转化为10-OC-CPT, 也是解决CPT毒性的一种有效途径, 朱关平成功地用T-36霉菌菌株将CPT转化为10-OH-CPT, 转化率达50 %, 已于1985年申请专利(CN 85-1-00520-A, 1985)。
我国在60 ~ 70年代曾对许多种类的中草药进行过筛选(雷海鹏等, 1963), 于70年代成立了全国喜树研究协作组, 在湖北黄石市召开了“抗癌药物羟基CPT鉴定会”(1975), 也进行了大量的药理和临床研究, 证实CPT对肝癌、胃癌、肠癌、膀胱癌和白血病等有一定疗效, 但也有较大副作用(上海药物研究所药理研究室, 1975), 此后由于种种原因无论是CPT还是10-OH-CPT的研究都没有得到进一步的发展。近年来, 在药理、临床和栽培上开始有少量报道, 但与国际形势相比, 速度非常缓慢, 在中国专利(http://www.patent.com.cn)中仅检索出35条与喜树碱有关的内容, 且许多专利权人不是中国人。
7 CPT及其类似物的应用 7.1 CPT及其类似物的医疗作用研究国内外对CPT及其类似物的药理作用进行了大量的研究, 结果表明这类药物具有抗肿癌、抗病毒(可能的治疗艾滋病能力)和治疗皮肤病3方面的作用。
7.1.1 抗肿瘤CPT及其类似物抗恶性肿瘤研究从70年代开始, 虽然中间有所停顿, 仍取得了巨大的成就(刘寿山主编:中药文献研究(1962 ~ 1974)。动物试验表明CPT对小鼠L615白血病、吉田肉瘤、肉瘤-180、肉瘤-37及艾氏腹水癌等肿瘤均有一定的抑制作用。其中对小鼠白血病及大鼠吉田肉瘤的疗效较为显著(Perdne, 1968; Hartwell, 1969)。前期临床试验表明, CPT及其类似物对膀胱癌、脑癌、乳癌、宫颈癌、结肠癌、神经腹质瘤、何杰金氏病(淋巴网状细胞瘤)、白血病、肺癌、淋巴瘤、黑色素瘤、卵巢癌、胰腺癌、儿科癌症、前列腺癌和肝癌等都有不同程度的疗效(郭新娜等, 1994; 严济邦等, 1980;McDonald, 1997)。周军(1991)等对CPT和10-OH-CPT抗肿瘤活性和毒性进行比较, 认为10-OH-CPT较CPT的毒性小、“等毒性”抗肿瘤活性强。林国础等对这种经转化得到的羟基CPT进行了临床应用, 发现其在治疗涎腺肿瘤上与天然羟基CPT的疗效及副作用相似(林国础, 1994)。国内外众多学者对CPT及其类似物的抗肿瘤活性及作用机制、药代动力学、临床应用、与其它抗肿瘤药物的联合使用(张永恒等, 1996)、毒性反应和使用方法都进行了大量研究(Mi et al., 1994), 这里不再详细论述。
7.1.2 CPT及其类似物与HIV/艾滋病(AIDS)作为Topo Ⅰ抑制剂的CPT及其类似物的研究已经完成或即将完成, 科学家们的注意力已逐步转向这些物质的抗病毒性能, 特别是与HIV有关的艾滋病领域(McDnoald, 1997)。以色列Ben-Gurion大学的Priel和其同事发现DNA拓扑异构酶Ⅰ在HIV复制中非常活跃(Priel, 1989), 低剂量的CPT能阻断被感染细胞(急性和慢性)HIV-1的复制(Priel, 1991)。CPT类药物不仅对HIV-1有效, 而且对其它与艾滋病有关的病毒也有效(James, 1997)。美国史克公司研究者认为Topotecan和其它用来抗HIV病毒的CPT类似物的毒性太大, 但试验表明抗HIV所需的剂量要小于治疗癌症所需的剂量(James, 1997)。
7.1.3 治疗其它疾病喜树碱的二甲基亚砜溶液治疗银屑病(psoriasis), 疗效快、使用方便(四川皮肤病研究所牛皮癣防治研究小组, 1973; 焦敬荣等, 1974), 且无副作用。针剂治疗的有效率达75.7 %, 但有些有头晕、膀胱炎等副作用。临床应用表明, CPT有希望成为一种抑制青光眼滤过性手术后瘢痕形成的药物(郭茜茹等, 1995)。
7.2 其它应用CPT被认为是一种光化学活性成分。浓度为1 ×10-4 mol/L的CPT溶液能阻碍烟草和玉米的生长, 但对大豆和高梁生长没有表现出影响(Buta et al., 1976)。
8 展望癌症已成为严重危害人类生命健康、且难以治愈的病症之一。据世界卫生组织估计, 全世界每年约有500 ×104人因患各种恶性肿瘤而死亡。仅美国每年诊断出130 ×104例癌症。同时还有许多爱滋病患者或HIV携带者, 据美国疾病控制中心估计美国约有65 ~ 90 ×104HIV携带者。由此看来, 对喜树碱及其类似物等具有抗肿瘤和抗病毒活性的物质进行研究具有重要意义。大规模地商业合成CPT及其类似物是不切合实际的(Li et al., 1994), 唯一可行的CPT来源是可再生的喜树资源。按每年治疗30 ×104癌症患者计算, 需要约200 ×104株幼年喜树。中国是喜树碱的主要生产者, 出口到美国的价格为3.5 ×104 $/kg(Anonymous, 1996)。几十年来, 广大科技工作者对喜树和喜树碱进行了比较深入的研究, 取得了可喜的研究成果, 为治疗危害人类健康的一大类顽疾———癌症做出了一定的贡献, 但仍有许多方面的研究尚没有涉及或研究的不够深入和系统, 直接影响着喜树的经济价值和喜树碱医疗价值的发挥。
8.1 喜树研究与原料生产 8.1.1 喜树基础研究从目前的研究情况和国内外的研究趋势来看, CPT及类似物主要是靠从喜树中分离获得。而CPT是喜树中的一种天然次生代谢产物, 其产量必将受到喜树生长发育和环境因素的影响, 而过去人们一直着力于提取和产品的开发, 随着以CPT市场的扩大, 生产CPT及其类似物所需的原料将成为这一产业的基础。尽管有少量与有关喜树和原料生产的研究, 但与CPT的研究开发不相适应。今后应以CPT及其类似物的代谢为核心, 开展如下几方面的研究工作, 为原料生产提供理论基础。(1)喜树基础生理代谢研究。主要包括光合、呼吸及水分和矿质营养代谢的基本规律。特别是与CPT代谢有关的N代谢研究。(2)环境因子对喜树生长发育、基础生理代谢的影响及相互关系。因为CPT是一种吲哚类生物碱(indole alkaloid), 为喜树的次生代谢产物, 一般认为它的作用是植物体抵御不良环境条件的产物。因此开展胁迫生理的研究, 将有助于为获得高含量的原料提供理论基础。(3)以CPT为核心的喜树次生代谢规律及其与基础生理代谢之间的关系。从目前植物生理研究的情况来看, 次生代谢生理的研究远远滞后于基础生理的研究, 因此对CPT合成的途径、调控(化学、物理和生理)、运输转移和积累与分解都有待进行深入的研究。CPT这种具有极高经济价值的次生代谢产物的研究同样具有较高的理论价值。(4)高CPT含量无性系和种源选育。喜树广泛分布于长江流域, 近年来各地都有引种, 应在种源选择的基础上进行无性系选择, 尽快为生产提供高CPT含量的优良喜树种源或无性系。
8.1.2 原料生产与采集由于过去一直是从成年喜树上采集果实或根皮, 目前的研究结果已经证明喜树嫩叶中CPT的含量是种子中CPT含量的1.5倍、树皮中含量的2.5倍。随着叶子的逐步长大、成熟, CPT的含量剧烈下降。这为喜树原料和生产奠定了基础, 即喜树原料生产应以获取尽可能多的幼嫩叶片为目的。因此应在对喜树的生长发育规律、繁殖技术、常规栽培技术研究的基础上, 积极开展喜树药用林定向培育和工厂化栽培技术研究, 主要包括高密度多次采叶技术、无土栽培技术、多次采根技术, 实现高含量与高产量有机结合, 为CPT提取提供充足的原料。
8.1.3 CPT工厂化生产技术研究这方面的研究报道较少, 应借鉴其它物种的细胞工程技术, 进一步开展喜树的愈伤组织培养、悬浮培养技术、高含量细胞系筛选和CPT分离提纯技术研究。
8.2 CPT研究与产品开发 8.2.1 CPT研究CPT通过嵌合抑制DNA拓扑异构酶Ⅰ的独特作用机理和CPT结构中E内酯环易遭破坏导致抗癌活性降低等研究结果, 使喜树碱研究与开发进入了一个新时代。国内外学者通过对CPT结构的修饰合成了大量的活性衍生物, 其中一部分已经应用于临床。应继续开展CPT的构效(结构与活性、效能)关系研究, 在此基础上研究CPT的结构修饰和产物的合成。广泛开展CPT药学、药理学、药代动力学等方面的研究。
8.2.2 产品开发在上述研究的基础上开发抗癌、防癌、治癌和治疗爱滋病的成品药, 造福人类。自从CPT独特的抗癌机理发现以来, 喜树和CPT的研究掀起了新的一轮高潮, 世界和各国纷纷投入大量的人力、物力和财力对其进行研究和开发, 随着研究的深入、现代科学技术的发展, 喜树和CPT的研究将会为人类的生活带来巨大的变化。
傅松玲. 1992. 喜树1年生播种苗年生长规律的探讨. 安徽林业科技, (2): 13-15. |
耿宝琴. 1995. 紫杉醇类与喜树碱类的研究进展. 实用肿瘤杂志, 10(4): 199-201. |
龚其锦, 林邦超, 等. 1993. 喜树黄毒蛾生物学特性及其防治初步研究. 福建林学院学报, 13(4): 407-413. |
顾德辛. 1995. 抗肿瘤药喜树碱及其类似物的研究开发. 中国医药情报, 1(6): 340-344. |
顾关云, 唐宗俭. 1980. 抗肿瘤生物碱喜树碱的几种资源植物. 中草药, 11(10): 476-479. |
郭茜茹, 李舒茵, 等. 1995. 喜树碱抑制滤过光泡瘢痕化的临床研究. 眼科研究, 13(4): 262-264. |
郭舜民. 1994. 喜树碱类似物的研究进展. 国外医学, 药学分册, 21(5): 270-273. |
郭新娜, 赵彼得, 等. 1994. 羟基喜树碱膀胱灌注合并高频透热治疗膀胱癌近期疗效观察. 军医进修学院院报, 15(3): 182. |
黄学恒, 林坤华, 等. 1993. 淡色缘脊叶蝉生物学特性及防治. 林业科技通讯, (1): 22-24. |
江苏新医学院编.中药大辞典.上海: 上海科学技术出版社, 1975, 1347
|
焦敬荣, 李习舜. 1974. 喜树碱二甲基砜溶液治疗银屑病的疗效观察. 中华医学杂志, 54(4): 208-210. |
林国础, 陈延昌, 等. 1994. 生长转化羟基喜树碱治疗口腔颌面涎腺腺源性上皮癌的临庆观察. 华西口腔医学杂志, 12(1): 51-52. |
林隆泽, 宋纯清, 徐任生. 1979. 抗癌植物喜树化学成分研究.Ⅲ. 化学学报, 37: 203. |
林隆泽, 宋纯清, 徐任生. 1982. 抗癌植物喜树化学成分研究.Ⅳ.11-羟基喜树碱化学成分的分离鉴定. 化学学报, 40(1): 85-88. |
林隆泽, 赵志远, 徐任生. 1977. 抗癌植物喜树化学成分研究.Ⅰ.喜树根的化学成分. 化学学报, 35: 227. |
林启寿. 1977. 中草药成分化学. 北京: 科学出版社, 719-720.
|
林颐然, 黄畋. 1982. 喜树酊治疗银屑病的临床观察及实验研究. 中华皮肤科杂志, 15(4): 210-212. |
罗厚蔚. 1975. 从喜树果中分离出一种微量生物碱-去氧喜树碱. 草药通讯, (1): 25-26. |
全国中草药汇编编写组.全国中草药汇编.上册.北京: 人民卫生出版社, 1975, 817~818
|
上海市卫生局. 1980. 上海市药品标准(下册). 上海: 上海科学技术出版社, 274.
|
上海药物研究所药理研究室. 1975. 喜树抗癌作用的实验研究. 中华医学杂志, 55: 274. |
上海药物研究所植化室喜树组. 1975. 喜树果中抗癌有效成分喜树碱与10-羟基喜树碱. 中草药通讯, (5): 17-18. |
四川省皮肤病防治研究所牛皮癣防治研究小组. 1973. 喜树碱治疗银屑病33全例的疗效观察报告. 四川中草药通讯, (2): 7-8. |
涂文升, 刘宗河. 1995. 抗癌药物喜树碱的高效液相色谱测定. 广西医科大学学报, 12(2): 240-242. |
无名氏. 1977. 抗癌药10-羟基喜树碱鉴定会在黄石市召开. 中草药通讯, 8: 31. |
小川一诚(著), 张化(译).癌的治疗—实体瘤的化疗.日本医学介绍, 1995, 16(5): 217~219
|
肖康琳. 1990. 绿叶蝉转株危害喜树的发生规律与防治. 四川林业科技, 11(1): 56-58. |
熊文愈, 汪计珠, 石同岱, 等. 1983. 木本药用植物栽培. 上海: 上海科技教育出版社, 465.
|
徐任生, 赵志远, 林隆泽. 1977a. 抗癌植物喜树化学成分的研究.Ⅱ.喜树果中的化学成分. 化学学报, 35: 193. |
姚培潢. 1994. HPLC测定喜树碱的含量. 中国药学杂志, 29(3): 165-166. |
张恩汉, 刘桂英. 1983. 喜树花芽分化及其性别. 中草药, 14(2): 38-40, 47. |
张红, 王永耀, 等. 1995. 大孔吸附树脂提取喜树碱的研究. 离子交换与吸附, 12(2): 145-150. DOI:10.3321/j.issn:1001-5493.1995.02.004 |
张清民, 王东凯, 等. 1990. 喜树碱类似物抗癌活性的研究进展. 沈阳药学院学报, 7(7): 297-302. |
张清民, 王鹏, 等. 1991. 三波长分光光度法测定喜树碱多相脂质体中喜树碱的含量. 沈阳药学院学报, 8(1): 48-50. |
张务民, 周祖基. 1990. 为害喜树几种叶蝉的识别. 四川林业科技, 11(1): 45-46. |
张正香. 1993. 抗癌药物喜树碱生产工艺研究. 中国野生植物资源, (1): 1-4. |
赵洁. 1992. 光质和温度与2, 4-D组合对喜树叶片脱分化的效应. 华中师范大学学报(自然科学版), 26(4): 482-486. |
中国科学院上海医物研究所. 1978. 10-羟基喜树抗癌作用的研究. 中华医学杂志, (1): 598-602. |
中国树木志编委会.中国主要树种造林技术.新1版.北京: 中国林业出版社, 1981, 中国专利, http://www.patant.com.cn
|
周国模, 吴家胜, 应叶青, 等. 1999. 喜树种源苗期生物量研究. 林业科学研究, 12(4): 386-391. DOI:10.3321/j.issn:1001-1498.1999.04.010 |
周军, 樊亦军, 等. 1991. 喜树碱(喜树碱)与10-羟基喜树碱(H喜树碱)的抗肿瘤活性与毒性比较. 癌症, 10(3): 198-201. |
朱关平, 等. 1978. 生物转化喜树碱为10-羟基喜树碱的研究. 科学通报, 23: 761. |
Anonymous. Researchers grow ing cancer-fighting rees on plantation. Cancer Biotechnology Weekly, 1996, March 25, 9~11
|
Anonymous. FDA approves Stehlin Foundation anticancer drug. Cancer Weekly Plus, 1996, Oct. 21, 22~24
|
Buta J C, Joseph F W. 1976. Cam ptothecin, a selective plant growth regulator. J. Agric. Food Chem., 24(5): 1085-1086. DOI:10.1021/jf60207a016 |
Fallo R C et al.喜树碱的抗肿瘤作用. J. Nat. Cancer Inst. 1971, 46 : 789见刘寿山主编: 中药文献研究(1962~1974)
|
Gofflieb J A et al.喜树碱的初步临床与药理研究, Proc. Am. Assoc. Cancer Res., 1970, 11 : 121见刘寿山主编: 中药文献研究(1962~1974)
|
Hsigang Y, Liu L F. Identification of M ammalian DNA topoisomerase I as an intracellular target of the anticancer d rug camptothecin. Cancer Research, 1988(48): 1722~1726 http://www.pslgroup.com/dg950914.htm.
|
http://www.rti.org.Bristol-Meyers Squibb and Research Triangle Institute Announce R&D Agreement. 1997, http://wwwicic.nic.nih
|
Jain A K, Nessler C L. 1996. Clonal propagation of Camptotheca acuminata through shoot bud culture. Plant Cell Tissue and Organ Culture, 44: 229-233. DOI:10.1007/BF00048528 |
James J S. Topotecan, CPT-11(irinotecan), camptothecin, and other topoisomerase Ⅰ inhibitors. AIDS Treatment News 1997. in : www.immunet.org/atn/QX19701.html.
|
Kuniaki Sakato, Masanaru Misawa. 1974. Effects of chemical and physical on growth of Camptotheca acuminata cell culture. Agr. Bio. Chem., 38(3): 491-497. DOI:10.1080/00021369.1974.10861199 |
Kuniaki Sakato, Masanaru Misawa. 1974a. Isolation and identification of camptothecin from cells of Camptotheca acuminata suspension culture. Agr. Bio. Chem., 38(1): 217-218. DOI:10.1080/00021369.1974.10861136 |
Liu Z, Adams J C, Viator H P, et al. 1999. Influence of soil fertilization, plant spacing, and coppicing on growth, stomatal conductance, abscisic acid, and camptothecin levels in Camptotheca acuminata seedlings. Physiologia Plantarum, 105: 402-408. DOI:10.1034/j.1399-3054.1999.105303.x |
Liu Z, Carpenter S B, et al. 1997. Camptothecin production in Camptotheca acuminata seedlings in response to shading and flooding. Can. J. Bot., 75(2): 368-373. DOI:10.1139/b97-039 |
Liu Z, Carpenter S B, Bourgeois W J, et al. 1998. Variations in the secondary metabolite camptothecin in relation to tissue age and season in Camptotheca acuminata. Tree Physiology, 18: 265-270. DOI:10.1093/treephys/18.4.265 |
Liu Z, John Adams. 1996. Camptothecin yield and distribution within Camptotheca acuminata trees cultivated in Louisiana. Can. J. Bot., 74: 360-365. DOI:10.1139/b96-045 |
Liu Z, Zhou G, Xu S, et al. 1999. Medicinal plants from China-researchers look at growth and CPT concentrations in 18 seed sources. Louisiana Agriculture, 42(3): 26-27. |
Lopez-Meyer M, Nessler C L, Mcknight T D. 1994. Sites of accumulation of the antitumor alkaloid Camptothecin in Camptptheca acuminata. Planta Med., 60: 558-560. DOI:10.1055/s-2006-959571 |
McDonald C. Camptotheca acuminata : China's 'Tree of Joy' Offers Hope in the U. S. (Draft report), 1997
|
Mi Z, Thomas G. B.. 1995. Marked interspecices variations concerning the interactions of cam ptothecin with serum albumins :A frequency-domain fluorescence spectroscopic study. Biochemistry, 33(42): 12540-12545. |
Priel E S, Show alter D, et al. 1991. Inhibition of human-immunodeficiency-virus(HIV-1)replication in vitro by noncytotoxicdoses of cam ptothecin, a topoisomerase-Ⅰ inhibitor. AIDS Research and Human Retroviruses, 7(1): 65-72. DOI:10.1089/aid.1991.7.65 |
Priel E, Yosef O, et al. 1989. Detection of a novel DNA topoisomerase Ⅰ activity associated with human immunodeficiency virus (HIV) and other retrovirus particles. International Conference on Aids, 5: 586. |
Sandler A S, Kaplan L. 1996. AIDS lymphoma. Current Opinion inoncology, 8: 377-385. DOI:10.1097/00001622-199609000-00008 |
Vincent R M, Melina Lopez-Meyer, Thomas D M, et al. 1997. Sustained Harvest of Camptothecin from the Leaves of Camptotheca acuminata. J. Nat. Prod., 60: 618-619. DOI:10.1021/np9700228 |
Wall M E et al. Strueture activity relationship of plant antiumor agents related to camptothecin and quassinoids 1980 : Intenational Research congress on Medicinal Plant Researcn
|
Wall M E, Wani W C, et al. 1966. Plant antitumor agent Ⅰ. The isolation and stucture of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminata. J. Amer.Chem. Soc., 88: 3888-3890. DOI:10.1021/ja00968a057 |
Wall M E. 4th International Symposium on Biochemistry and Physiology of Alkaloids. 1969 : 77~87
|
Wani M C, Ronman P E, et al. 1980. Sythensis and biological activity of cam ptothecin analogues. J. Med. Chem., 23(5): 554-560. DOI:10.1021/jm00179a016 |
Wani M C, Wall M E. 1969. Plant antitumor agents. Ⅱ. The structure of two new alkaloids from Camptotheca acuminata. J. Org. Chem., 34(5): 1364-1367. DOI:10.1021/jo01257a036 |
 2000, Vol. 36
2000, Vol. 36
