文章信息
- 房建军, 韩一凡.
- Fang Jianjun, Han Yifan.
- 植物化学抗虫性的遗传学研究进展
- GENETICS OF SECONDARY METABOLITES AND PEST RESISTANCE OF PLANT
- 林业科学, 2000, 36(5): 92-99.
- Scientia Silvae Sinicae, 2000, 36(5): 92-99.
-
文章历史
- 收稿日期:1999-05-07
-
作者相关文章
植物在长期的进化过程中已经形成了一定抵抗不良环境的能力, 其中抵抗昆虫破坏的能力被称之为抗虫性。抗虫性这一性状有的属质量性状, 有的属数量性状, 已有很多专著加以论述(Smith, 1989; Dhan, 1986)。植物之所以抗虫, 有其物质基础。植物抗虫性的基础归为生物化学基础和形态学基础两大类。其中植物的生物化学特性是抗虫性的一类重要基础, 因为它不但直接影响昆虫的食物营养与可消化性、昆虫取食定向性、栖居和产卵, 还间接影响其它特征。Fraenkel (1959)就提出植物抗虫性不是植物的基本营养差异造成的, 植物对昆虫的抗性是基于植物组织内存在的特异次生物质。Kennedy (1965)对这一理论进行了修正, 认为营养成分也是决定昆虫食性的一种因素。
早在1951年, Painter的重要著作Insect Resistance in Crop Plant中就记述了Roach在1937年就有了对苹果绵蚜(Eriosma lanigerum)不同感虫性苹果品种化学分析的初步尝试。由于40年代化学杀虫剂的出现, 植物抗虫性的工作受到搁置。70~80年代, 对植物次生代谢物的研究成为昆虫化学生态的研究重点。较重要的研究在主要的农作物上, 如玉米(Zea mays)中配基2, 4二羟基-7甲氧基-2H-1, 4苯并恶唑啉-3酮(2, 4-dihydroxy-7-methoxy-2H-1, 4-benzoxazin-3 (4H) -one, DIMBOA, 俗称丁布)是第一代欧洲玉米螟(Ostrinia nubilalis)幼虫的主要忌避剂和取食抑制剂(Klun et al., 1967)。棉子酚(gossypol)是一些棉花害虫例如豆芫菁(Epicauta spp.)的抑制因素(Abou-Donia, 1989)。欧洲油菜(Brassica napus)中芥子油苷(glucosinolates)与萝卜蚜(Lipaphis erysimi)产卵力负相关(Malik, 1983)。马铃薯(Solanum Spp.)中的生物碱(alkaloids)对马铃薯甲虫(Leptinotarsa decemlineata)和蚕豆微叶蝉(Empoasca fabae)有抗性(Harborne, 1988;Sanford, 1990)。山核桃(Carya spp.)中的胡桃酮(juglone)是波纹棘胫小蠹(Scolytus multistriatus)的忌避剂(Gilbert, 1967)。Harborne (1982)综合报道了已明确其化学结构的植物次生物质超过12000种, 以生物碱、萜类和黄酮类物质为主。
1 植物次生代谢产物的种内变异是受遗传控制的半个多世纪以来, 很多研究者致力于植物次生代谢产物的遗传学研究, 得出一些有价值的成果。但总起来讲, 这种研究报道较少, 且主要是以重要的经济作物为研究对象。
实际上, 遗传学产生以前, 植物化学变化的遗传特性就已被人们认识到。尽管孟德尔可能没有意识到构成花色的植物化学基础, 但他在植物遗传学的开创性研究中已经应用了这一点。众所周知, 对于豌豆(Pisum sativum), 花色的遗传方式是以孟德尔方式遗传的, 如红花豌豆与白花豌豆杂交, 按分离规律, 子代中产生一定比例的几种个体。直到1978年, Waller和Nowacki才深入研究发现形成豌豆花色的花色素苷的遗传方式是显性遗传方式。同其它性状一样, 植物化学性状也是质量性状或数量性状。质量性状通常受到寡基因(少数主基因)控制; 数量性状受多基因(多个微效基因)控制。用基因表达的术语说, 在单基因位点, 性状可能是显性、隐性或加性。早期的研究多注重质量性状, 因为相对而言质量性状的研究容易些:数量性状杂交产生的子代呈连续的变异, 不容易象质量性状那样进行归类; 质量性状可一次杂交便可得到结果, 数量性状则不然, 除非这些性状呈加性遗传; 质量性状不易受环境影响, 对于数量性状, 微小的环境影响可能掩盖了由于遗传因素带来的表型差异。
通常, 只有化学性状同昆虫行为有关联, 才能称得上化学抗虫性。一个很好的例证是在玉米对欧洲玉米螟的抗性中, 化学物质变异同抗虫性的相互关联是直接而明确的。早在1957年, 人们就曾怀疑玉米对欧洲玉米螟的抗性是由于化学物质引起的, 很可能是氧肟酸(如:DIMBOA)以及它的衍生物。至少一个品系的玉米, 氧肟酸浓度是单个显性基因bx控制的; 在另外一个自交系内, 属数量遗传, 受到2~5个位点控制(Dunn et al., 1981)。依据变异, 氧肟酸的水平受到环境因素包括光强、温度、铁离子和氮浓度等的影响。用人工食物混合植物组织进行虫试, 氧肟酸的前体MBOA (6-甲氧基-苯并恶唑啉酮)的浓度不但与幼虫死亡率有关, 还能减少产卵力(Niemeyer, 1988)。在田间试验, 自交系玉米的叶片对一代玉米螟抗性与氧肟酸的水平相关(Klun et al., 1968)。在某些品种中, 当植物年龄增大, 氧肟酸水平下降, 抗性随之下降。研究者着手了一系列高含量DIMBOA的自交系的选择。
棉子酚(gossypol)存在于棉花的色素腺内, 人工接虫证明对几种昆虫有毒性, 如烟芽夜蛾(Heliothis virescens)和美洲棉铃虫(H.zea) (Maxwell, 1965)。Singh (1972)发现花芽中棉酚的含量由起累加作用的多个基因控制, 广义遗传力h2=0.73-0.86。White (1982)认为棉酚、缩合单宁、黄酮花色素甙类均由起累加作用的基因所控制。另一个典型的例子是番茄中存在的次生代谢产物, 详见下文。
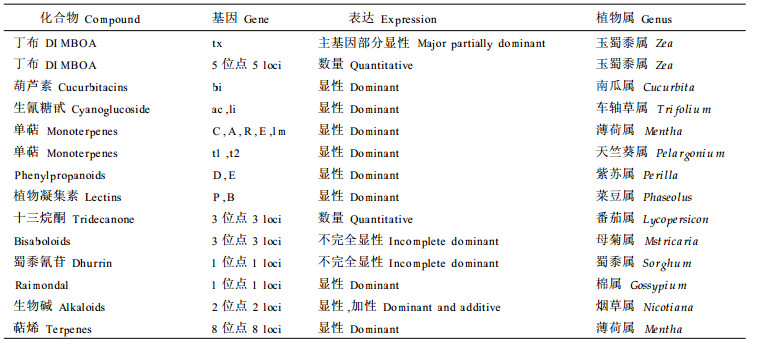
表 1列出远未详尽的植物次生代谢物的简单的遗传方式汇编(Berenbaum et al., 1992)。生物碱产生的遗传特点可看作典型的次生代谢的基因表达方式。如在羽扇豆属(Lupinus)中, 至少18个基因位点暂定为可影响某特定的生物碱产生, 表现为生物碱的有或无。在L.albus中两个位点决定合成的减少。而L.primus中可减少90 %, L.tertius可减少98 %。而在烟草中生物碱的产生却不同。高浓度生物碱的产生是受隐性基因控制的(Waller et al., 1978)。由此可见, 植物次生代谢物的产生具很强的种属特异性, 即使是同一物质, 其遗传方式也随植物种、品种的不同而不同。
|
|
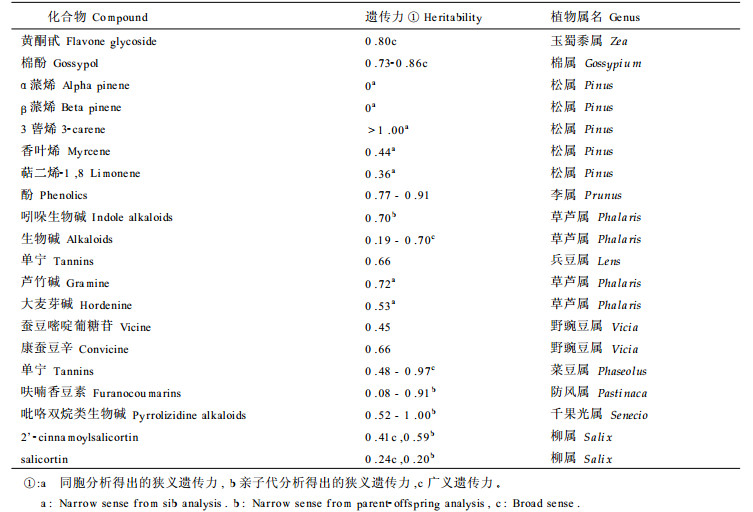
其实, 真正符合孟德尔方式遗传的植物次生代谢物, 与其说是规律不如说是例外。次生代谢物产生是整个合成途径中大量酶协同作用的结果。参与合成的所有基因必须在整个路径中协同作用才能得到产物。而且合成体系之外的酶本身可能对次生代谢的表型产生重要影响; 基因表达产物涉及到酶的结合、转运、在贮藏器官内积累等等, 都可能造成次生代谢产物在可观测到的数量上的变化。鉴于单基因经常只表明某产物的有或无, 而数量性状经常反映多个基因的共同作用, 因此此类研究更顷向于数量遗传研究方法。遗传力是对表型中遗传分量的估计, 广义遗传力包括所有遗传因素, 包括加性的和非加性的(显性的和上位的)效应, 而狭义遗传力是只对加性效应影响的估计。表 2列出了一些化合物的遗传力(Berenbaum, 1992; Orians, 1996; Nichols-Orians, 1993; Henson, 1984; Singh, 1972), 尽管遗传分量可从0~1范围内变化, 许多化合物变异水平已超过50%, 表明遗传因素在次生代谢表型上的重大影响。
|
|
实际上, 植物经诱导产生的化学抗性并未被人们很好认识, 上述化学物质的测定均是组成型物质的含量。很多文献记载了植食动物对某些特定化合物的诱导作用(Karban et al., 1989)。如表 3中列出了一些诱导产生的化学物质。在对欧洲防风(Pastinaca sativa)中, 这种诱导性的遗传基础已被证实。Zangerl和Berenbaum (1990)发现两群体叶片中组成型与诱导型的呋喃香豆素水平的遗传力差异很大。
|
|
人们很早便想到测定抗性材料中的化学成分, 找到对昆虫起毒负作用的物质, 但很多次生代谢产物不仅含量少, 且化学性质不稳定。在化学测定的实施中, 要经过繁杂的分离、提纯过程, 这样往往造成测定的结果与活体植物相差甚远。如早期认为玉米抗一代欧洲玉米螟与MBOA (6-甲氧基-苯并恶唑啉酮)有关, 后来才证实它是丁布(DIMBOA)的分解产物, 而真正起作用的丁布是不稳定的化学物质, 鉴定工作十分复杂, 无法应用于实践(Klun, 1967)。在杨柳科植物酚甙类物质的研究中也遇到类似的情况(Bryant, 1987; Lindroth, 1997), 本来完整的酚甙salicortin, tremulacin才对昆虫有作用, 但它们本身易于分解, 尤其是在水的环境中更使分解加速, 早期的测定通过复杂的前处理, 测定到的物质均为其分解产物水杨甙、儿茶酚等, 故不能说明问题。
由于基因的多效性、连锁或上位效应, 化学特性同昆虫行为的表型关系可能会隐藏真正的抗性机制。例如:葫芦素是葫芦科等一些植物中产生的一种非常苦的三萜类化合物, 在黄瓜(Cucumis sativa)中, 苦味的产生受到主基因bi的控制, 尽管苦味的程度与葫芦素C的浓度密切相关, DaCosta (1971)等报导苦味与对二斑叶螨(Tetranychus urticae)的抗性有关。对抗性的选择可引起葫芦素含量的显著上升。但后来的报导证实bi基因与植物受伤害的指标相关, 但与感虫性和产卵不相关。作者认为bi基因可能还与未知的基因连锁(DePonti, 1980)。
既然很多实例说明次生代谢产物的确存在可遗传的变异, 这些次生代谢产物对昆虫又有负作用, 昆虫又不能完全适应这些物质, 为什么以化学特性为基础的研究报道并不是非常多呢?因为次生代谢产物的产生受到诸多限制。首先, 次生代谢是从主代谢分支而来, 多种途径与主代谢纵横交错, 有些物质本身对维持生命又非必需, 必然会受到主代谢的控制。一条合成途径的变化必然会影响另一条途径。如苯丙氨酸解氨酶(PAL), 它不仅是合成黄酮、木质素、水杨酸等的中间酶, 还在芳香族氨基酸代谢中起重要作用, 成为连接主次代谢的纽带(Bennett, 1994), 一条途径产生变化, 必然带动其它途径。其次, 多种物质来源于一个共同的前体, 存在竟争底物的现象。如苯丙氨酸同时是类黄黄酮、花色素苷、木质素、香豆素、水杨酸、儿茶酚、水杨醇、植物抗毒素的前体, 一种产物增多另一种势必会减少。第3, 还有能量的限制, 如在烟草中, 选择高产, 则生物碱含量低; 选择高生物碱, 而产量下降(Matzinger et al., 1972)。第4, 植物次生代谢产物中的一部分是植物生命活动所不需要的, 甚至是有害的。自毒作用是次生代谢产物数量上的一个潜在束缚。然而, 植物本身也有一些机制来减少自毒作用的危险, 其最主要的机制可能是用于贮藏这些有毒物质的特异的细胞、组织和器官。这些贮藏结构包括腺毛、树脂道、乳汁管等。这些结构的大小、数量受到发育结段和构建自身的碳水化合物的限制。因此, 决定结构本身大小和数量的遗传因素本身就是一种限制。例如:萜只限于树脂道和腺毛中, 棉子酚主要分布在棉酚色素腺中, 这也许是植物自身保护的一种机制, 最少量的化合物可被隔离, 不致于自身受害。这些组织或器官的大小、数量受遗传因素控制, Mehlenbacher (1984)发现番茄杂种中A型腺毛和B型腺毛密度的遗传力为h2=0.32, 0.22。欧洲防风(Pastinaca sativa)的呋喃香豆素只限于种子油管(oil tubes)中, 种子内油管的数量与大小的遗传力为h2=0.494, 0.498, 5种呋喃香豆素的含量与器官的大小成正比(Zangerl et al., 1989)。
2 植物化学抗性的复杂性化学因素对昆虫可起的作用主要有二:一是引起对昆虫的忌避或抑制其取食(排趋作用或拒虫作用), 二是对昆虫生长或繁殖产生不利影响或促其死亡(抗生作用)。这些化学因素包括:存在的各种次生物质, 引起昆虫的不良感觉反应, 或中毒; 昆虫所需的营养成分缺乏或含量过低; 某些成分不利于昆虫对食物的消化利用, 例如对昆虫消化道蛋白酶活性有抑制作用的抗酶性物质。植物含有某些能避免或减轻昆虫或其他动物为害的化学因素, 是在长期演化历程中形成的, 昆虫种类繁多, 适应性强, 因此, 一类或一种化学防御因素, 只能对特定种类的昆虫有效(周明 , 1991)。芥子油苷(glucosinolates)对薯卜蚜(Lipaphis erysimi)有抗性, 而油菜兰叶甲(Psylliodes chrysocephala)却只取食含有芥子油苷的油菜(Bartlet, 1992); 生氰苷(cyanogenic)对木薯根蛀虫(Cyrtomenus bergi)有抗性, 但亚热带粘虫(Spodoptera eridania)却取食含生氰苷的植物且生长良好(Brattsen, 1983); 欧洲赤松(Pinus sylvestris)的α蒎烯(Alpha pinene)对纵坑切梢小蠹(Blastophagus piniperda)有忌避作用, 但对南方松小蠹(Dendroctonus frontalis)却有引诱作用(Payne, 1970); 棉酚能阻止豆芫菁(Epicauta spp.)取食, 但对棉铃象(Anthonomus grandis)则有刺激取食作用。Lindroth等在1985~1993年所作的研究更耐人寻味, 他们发现一种北美黑条黄凤蝶的两个亚种(Papilio glaucus canadensis和Papilio glaucus glaucus)对美洲山杨(Populus tremuloides)的取食情况差异很大, 前者可进食树叶生长良好, 后者却生长不良, 进一步虫试表明:酚甙salicortin和tremulacin对Papilio glaucus canadensis的存活、生长、食物消化无影响, 而对于Papilio glaucus glaucus的这些指标有影响。由此看来, 植物的化学抗虫性是非常复杂的, 某特定的物质只对特定的虫种(亚种)起作用, 可见抗性的专一性与复杂性(Lindroth 1988; Scriber 1993)。
, 1991)。芥子油苷(glucosinolates)对薯卜蚜(Lipaphis erysimi)有抗性, 而油菜兰叶甲(Psylliodes chrysocephala)却只取食含有芥子油苷的油菜(Bartlet, 1992); 生氰苷(cyanogenic)对木薯根蛀虫(Cyrtomenus bergi)有抗性, 但亚热带粘虫(Spodoptera eridania)却取食含生氰苷的植物且生长良好(Brattsen, 1983); 欧洲赤松(Pinus sylvestris)的α蒎烯(Alpha pinene)对纵坑切梢小蠹(Blastophagus piniperda)有忌避作用, 但对南方松小蠹(Dendroctonus frontalis)却有引诱作用(Payne, 1970); 棉酚能阻止豆芫菁(Epicauta spp.)取食, 但对棉铃象(Anthonomus grandis)则有刺激取食作用。Lindroth等在1985~1993年所作的研究更耐人寻味, 他们发现一种北美黑条黄凤蝶的两个亚种(Papilio glaucus canadensis和Papilio glaucus glaucus)对美洲山杨(Populus tremuloides)的取食情况差异很大, 前者可进食树叶生长良好, 后者却生长不良, 进一步虫试表明:酚甙salicortin和tremulacin对Papilio glaucus canadensis的存活、生长、食物消化无影响, 而对于Papilio glaucus glaucus的这些指标有影响。由此看来, 植物的化学抗虫性是非常复杂的, 某特定的物质只对特定的虫种(亚种)起作用, 可见抗性的专一性与复杂性(Lindroth 1988; Scriber 1993)。
常规育种的理论基础是数量遗传学, 传统的数量遗传学是把控制数量性状的多个基因作为一个整体进行研究。由于多基因作用和环境因子的影响, 许多重要的农作物性状都表现连续的变异。控制这些性状的基因的作用大小和方式各不同且相互作用。过去, 数量遗传学家用生物统计的方法计算后代平均值以估算控制这些数量性状的基因作用是一种“黑箱”式的研究。这一方法的局限性在于没有得到各基因分离的效应值而只是得到它们的效应的和, 并受到一系列统计模型的约束。随着不同植物RFLP图谱的建立, 数量性状基因定位(Quantitative Trait Locus, QTL)在遗传学研究的应用也日益增多, 许多重要作物、林木都已进行了图谱构建。给一度处于瓶颈的数量遗传学研究注入了活力。
数量性状基因位点(QTL)作图是对复杂抗虫性状进行研究的有效方法。QTL作图可以描述特异抗虫基因位点的作用, 估计具有部分抗性的基因位点的专化性, 分析抗虫基因与植物发育以及环境之间的互作, 以及抗虫数量基因与抗虫质量性状基因位点之间的关系等。
在抗虫品种培养中, 为使某品种增强抗虫性, 常用的方法是以此品种作轮回亲本, 以具备抗虫基因的另一品种为基因供体, 多次回交, 从而使轮回亲本的基因中不仅具有优良的所需栽培性状, 而且具抗虫基因。然而在回交育种过程中, 由于基因间的连锁, 一些不利的基因也会随之引入, 即所谓基因累赘(gene drag)。经典遗传育种研究无法鉴别出单个数量基因以及与之有关的染色体片段, 更难确定数量基因座位在染色体上的位置及与其它基因的关系。采用DNA分子标记的数量基因定位, 将影响数量性状的多个基因找出, 将其定位于染色体上, 并最终确定与之有关的DNA序列。然后杂交或回交将不同基因转到同一品种中。近几年, 分子标记和QTL技术也已应用于抗虫性状研究。玉米对欧洲玉米螟的抗性、水稻对白背飞虱(Sogatella furcifera)的抗性、马铃薯对马铃薯甲虫(Leptinotarsa decemlineata)的抗性、大豆抗棉铃虫(Helicoverpa zea)等以树木为材料进行抗虫性状数量基因定位的研究尚无报道(Schon, 1993; Ishii, 1994; Bonierbale, 1994; 1996;Rector, 1996)。
由于QTL的引入, 对于由于化学物质介导的抗虫性也有了新的认识。人们通常认为番茄(Lycopersicon esculentum)的腺毛状体(glandular trichomes, 以下简称腺毛)与抗植食动物有关, 如二斑叶螨(Tetranychus urticae)的生殖力与Ⅵ型腺毛的密度负相关(Stoner et al., 1968), 通过对蚜虫、粉虱、螨、叶甲的纠缠和阻挠, 腺毛的粘渗出物不言而喻地与抗性有关, Williams (1980)年鉴定了Ⅵ型腺毛中的2-十三烷酮(2-tridecanone, 2-TD), 它是番茄对几种昆虫的抗生性物质。野生番茄(Lycopersicon hirsutum)叶片的氯仿提取物对两个目的一些昆虫的产生毒性(鳞翅目:烟草天蛾Manduca sexta, 玉米穗虫Heliothis zea, 同翅目:番茄蠹蛾Keiferia lycopersicella, 扁豆蚜Aphis craccivora, 棉桃蚜Myzus persicae), 当把叶表面的腺毛渗出物去除, 毒性大大下降(Kenndy et al., 1979)。最后直接生物测定证实2-TD对玉米穗虫和马铃薯甲虫有毒性(Kenndy et al., 1983)。Zamir (1984)报道野生番茄与2-十三烷酮水平有关的5个标记位点至少在4个不同的染色体上。Nienhuis (1987)通过L.hirsutum与L.esculentum杂交, 发现2-TD的表达至少3个基因起作用。Maliepaard.等1995年进行QTLs基因定位, 发现F2代两个与温室粉虱(Trialeurodes vaporaiorum)产卵率有关的位点Tv-1和Tv-2分别在1号和12号染色体上。影响Ⅵ型腺毛密度的位点(TriVI-1)定位于1号染色体上。
一种叶上长有腺毛的野生马铃薯(Solanum berthaultii)对研究马铃薯抗虫性非常有用。Radcliffe (1968)发现此种能抗蚜虫和叶蝉。Tingey (1982)把不同马铃薯受害水平的差异归因于腺毛的种类和着生密度。Bonierbale (1994)等将此野生种与普通种杂交, 然后培养回交后代, 用RFLPs进行QTLs基因定位, 使用同一材料把腺毛密度、多酚氧化酶、A型和B型腺毛产生的蔗糖酯、酶促褐变应、马铃薯甲虫活体检测食物消耗、产卵率、不同日照长度下发茎率等进行定位。力求深入了解抗虫机制。结果表明在回交后代5号染色体上TG379区域B型腺毛密度、蔗糖酯水平等性状与食叶量有关, 而1号染色体Tv-1区域与产卵率有关。
QTL定位也作出与一般认识近乎相反的结论。在野生番茄上还长有一种Ⅵ型腺毛, Ⅵ型腺毛分泌的葡酯(glucose ester)与马铃薯蚜(Macrosiphum euphorbiae)抗性有关, 据长期观察, 抗虫性与Ⅳ型腺毛的密度正相关。在Maliepaard (1995)上述定位工作中, 影响Ⅳ型腺毛密度的两位点(TriIV-1和TriIV-2)分别定位于5、9号染色体上。这一结论不支持Ⅳ型腺毛密度与抗虫有关的结论。
利用QTL图谱研究抗虫性状是对传统数量遗传学研究方法的一大突破, 修正了传统数量遗传学的一些不恰当的假说和结论, 促进了对植物的抗虫性的深入了解。用分子标记鉴定和定位数量性状在许多植物中很有效, 高密度的分子连锁图和作图技术可确定多基因控制的复杂数量性状中单个基因的作用, 因此对于重要的数量性状来说, 分子标记辅助的选择是可行的。与DNA分子标记相关的选择可提高育种计划的效率, 减少育种所需时间。分子标记有关的技术不但可加速重要基因从野生种向良种的引入, 还具有增加育种准确性和效率。然而, 只有当分子和生化遗传学同传统的育种计划相结合时许多重要数量性状的改良才能成为现实。
欧洲和北美对杨柳科植物体内的次生物质进行了比较深入的研究, 研究表明, 杨柳科植物中的特异化学物质是酚甙类化学物质。酚甙在整个科中分布广泛, 且在种类和含量上具备差异显著的多态性, 现已鉴定约20种。在酚甙类物质中以salicortin, tremulacin为多。已有报道酚甙对鳞翅目和鞘翅目一些昆虫的生长发育有负作用:鳞翅目大杨卷叶蛾(Choristoneura conflictana), 舞毒蛾(Lymantriidae dispar), 鞘翅目黑杨叶甲(Chrysomela scripta)和欧山杨叶甲(C.tremulae)等(Bryant, 1987; Lindroth, 1990; Barbara, 1992; Picard, 1994)。多年的研究表明, 对昆虫有作用的物质是完整的甙, 而非其分解产物; 以往国内对酚类物质的研究均以酚甙的分解产物为测定对象, 如:没食子酸、儿茶酸、邻苯二酚、香豆酸、阿魏酸等, 故难以阐明问题。为深入研究杨树的抗虫机理, 我们采用数量基因定位(QTL)的方式, 力图将杨树的抗虫性状和酚甙类次生代谢产物的种类与含量定位于遗传图谱上, 这对于研究植物次生代谢产物的产生及与昆虫的关系都将会有深远的意义。林科院林研所杨树抗虫课题组经过十多年的努力, 通过对天牛反应不同的美洲黑杨进行种内杂交, 从后代中均选育出高抗的无性系, 表型较其亲本和其它杨树明显抗云斑天牛(Batocera horsfieldi), 在大田条件进行抗虫筛选的基础上, 经过人工接虫也取得较好效果(韩一凡, 1997; 卞学瑜, 1995; 胡建军, 1998; 孙丽艳, 1995)。所用材料的图谱遗传图谱已于1998年构建, 其具体情况是:包括198个AFLP标记的19个的连锁群, 图谱总距为2927cM (Wu, 2000), 现正进行化学物质与抗虫性定位工作。
总之, 以分子标记、QTL基因定位为先导的数量性状的鉴定和定位技术, 对于引入抗性基因, 加速育种进程, 增加育种的准确性, 提高育种效率, 都有其独到的作用。它是当今生命科学的新成果, 代表着以后的发展趋势。
卞学瑜, 韩一凡, 杨明珍, 淡克德.不同杨树无性系对云斑天牛抗性差异机理的研究.杨树研究进展.北京: 中国林业出版社, 1995, 97 -102
|
F. G.马克斯维尔等著.翟凤林等译.植物抗虫育种.北京: 农业出版社, 1985
|
韩一凡. 1997. 美洲黑杨南抗1号、2号新品种选育. 林业科技开发, 3: 18-20. |
胡建军, 赵自成, 苗世龙, 等. 1998. 杨树人工接虫方法的研究. 林业科学研究, 11(6): 574-580. DOI:10.3321/j.issn:1001-1498.1998.06.003 |
钦俊德著.昆虫与植物的关系.北京科学出版社, 1987
|
孙丽艳, 韩一凡. 1995. 对云斑天牛有不同抗性的杨树品种中化学物质的分析. 林业科学, 31(4): 338-345. |
周明 |
Abou-Donia M B. Gossypol. In. Cheeke P R ed. Toxicants of plant origin, volume Ⅳ, phenolics. 1989, Boca Raton: CRC Press, 2-22
|
Baldwin I T. 1988. Short-term damage-induced increase in tobacco alkaloids protect plant. Oecologia(Berlin), 75: 367-370. DOI:10.1007/BF00376939 |
Barbara R B, et al. 1993. Clonal and leaf age variation in Populus phenolic glycosides; implications for host selection by Chrysomela scripta (Coleoptera: Chrysomelidae). Environmental Entomology: 397-403. |
Bartlet E, Williams I H, Blight M M, Hick A J. Response of the oilseed rape pests Ceutorhynchus assimilis and Psylliodes chrysocephala to a mixture of isothiocyanares. In: Menken S B J, Visser J H, Harrewijn P eds. Proceedings of the 8 th international symposium on insectplant relationships. Dordrecht: Kluw er Academic Publishers, 1992, 103-104
|
Bennett R N, Wallsgrove R M. 1994. Secondsry metabolites in plant defense mechanism s. New Phytol, 127: 617-633. DOI:10.1111/j.1469-8137.1994.tb02968.x |
Berenbaum M R and Zangerl A R. Genetics of scondary metabolism and herbivore resistance in plants. Herbivores: their interactions with secondary plant metabliter. San Diego: Academic Press, 415-438
|
Bonierbale M W, Plaisted R L, Pineda O, Tanksley S D. 1994. QTL analysis of trichome-mediated insect resistance in potato. Theor Appl Genet, 87: 973-987. DOI:10.1007/BF00225792 |
Brattsen L B, Samuelian J H, Long K Y, Kincaid S A, Evants C K. 1983. Cyanide as a feeding stimulant for the southern armyworm, Spodoptera eridania. Ecological Entomology, 8: 125-132. DOI:10.1111/j.1365-2311.1983.tb00490.x |
Bryant J P. 1987. Effect of nitrogen fertilization upon the secondary chemistry and nutritionnal value of quaking aspen(Populus tremuloides Michx) leaves for the large aspen tortrix (Choristonem conflictana (walker)). Oecologia, 73: 513-517. DOI:10.1007/BF00379408 |
Calson J. 1994. Tree genome research at the university of British Columbia. Dendrom, 1: 10-11. |
Clausen T P, Reichardt P B, Bryant J P, Werner K P, Frisby K. 1989. Chemical model for short-term induction in quaking aspen (Populus tremuloides)foliage against herbivores. J. Chem. Ecol., 15: 2335-2346. DOI:10.1007/BF01012085 |
DaCosta C P, Jones C M. 1971. Cucumber beetle resistance ancmite susceptibility controlled by the bitter gene in Cucumis salivus L.. Science, 172: 1145-1146. DOI:10.1126/science.172.3988.1145 |
De Ponti O M B, Garretsten F. 1980. Resistance in Cucumis sativus L. to Tetranychus urticae Koch. 7. The inheritance of resistance and bitterness and the relation betw een these charcters. Euphytica, 29: 513-523. DOI:10.1007/BF00023197 |
Dhan Pal singh. Breeding for resistece to diseases and insect pest. Springer-Verlag Berlin Heidelberg, 1986
|
Dunn G M, Long B J, Routley D G. 1981. Inheritance of cyclic hydroxamates in Zea may L.. Can. J. Plant Sci., 61: 538-593. |
Fraenkel G. 1959. The raison detere of secondary plant substances. Science, 129: 1466-1470. DOI:10.1126/science.129.3361.1466 |
Gilbert B L, Baker J E, Norris D M. 1967. Juglone (5-hydroxy-1, 4-naphthoquinone)from Carya ovata, a deterrent to feeding by Scolytus multistriatus. J. Insect Physiol, 13: 1453-1459. DOI:10.1016/0022-1910(67)90170-9 |
Harborne J B. Introduction to Ecological Biochemistry. Acad. Press, 2nd ed. 1982
|
Haukioja E, Niemala P, Siren S. 1985. Foliage phenols and nitrogen in relation to growth, insect damage, and ability to recover after defoliation, in the mountain birch Betula pubescens sp. tortuosa. Oecologia, 65: 214-222. DOI:10.1007/BF00379220 |
Henson A. R., Zuber M. S., Darrah L. L., Barry D. D., et al. 1984. Evaluation of an antibiotic factor in maize silks as means of corn earworm (Lepidoptera: Noctuidae) Suppression. J. Econ. Entomol., 77(2): 487-490. DOI:10.1093/jee/77.2.487 |
Ishii T., Brak D S, Multani D S, Khush G S. 1994. Molecular tagging of genes for brown planthopper resistance and earliness introgressed from Oryza australiensis into cultivated rice, O. sativa. Genome, 37: 217-221. DOI:10.1139/g94-030 |
Karban R, Myers J H. 1989. Annu. Rev. Ecol. syst., 20: 331-348. DOI:10.1146/annurev.es.20.110189.001555 |
Kennedy G G, and Dimock M B. In "Pesticide chemistry: human welfare and the environment, " pp. 123-128. International congress of pesticide chemistry, Pergamon Press, Elmford, New York, 1983
|
Kennedy G G, Yamamato R T. 1979. A toxic factor causing resistance in wild tomato to the tobacco hornworm and some other insects. Entomol. Exp. Appl., 26: 121-126. DOI:10.1111/j.1570-7458.1979.tb02906.x |
Kennedy J S. 1965. M echanism of host plant selection. Ann. Appl. Biol., 56: 317-322. DOI:10.1111/j.1744-7348.1965.tb01242.x |
Klun J A, Robinson J F. 1969. Concentration of two 1, 4-benzoxazinones in dent corn at various stages of development of the plant and its relation to resistance of the host plant to the European corn borer. J. Econ. Entomol., 62: 214-220. DOI:10.1093/jee/62.1.214 |
Klun J A, Tipton C L, Brindley T A. 1967. 2, 4-dihydoxy-7-methoxy-1, 4-benzoxazin-3-one (DIMBOA), an active agent in the resistance of maize to the European corn borer. J. Econ. Entomol, 60: 1529-1533. DOI:10.1093/jee/60.6.1529 |
Lammerink J, MacGibbon D B, Wallace A R. 1984. Effect of the cabbage aphid (Brevicoryne brassicae)on total glucosinolate in the seed of oilseed rape. New Zealand Journal of Agricultural Research, 27: 89-92. DOI:10.1080/00288233.1984.10425735 |
Lawson D M, Lunde C F, Mutschler M A. 1998. Marker-assisted transfer of acylsugar-mediated pest resistance from the wild tomato, Lycopersicon pennellii, to the cultivated tomato, Lycopersicon esculentum. Molecular Breeding, 3: 307-317. |
Lindroth R L, et al. 1990. Responses of the gypsy moth (Lepidoptera:Lymantrudac)to tremulacin, an aspen phenolic glycoside. Environmental Entomology, 19(4): 842-847. DOI:10.1093/ee/19.4.842 |
Lindroth R L, Scriber J M, Hsia M T S.. 1988. Chemical ecology of the tiger swallowtail:mediation of host use by phenolic glycosides. Ecology, 69(3): 814-822. DOI:10.2307/1941031 |
Lindroth R L. 1988. Chemical ecology of the tiger swallowtail:mediation of host use by phenolic glycosides. Ecology, 69(3): 814-822. DOI:10.2307/1941031 |
Lindroth R L. 1997. Clonal variation in foliar chemistry of aspen:effects on gypsy moths and forest tent caterpillars. Oecolgia, 111(1): 99-108. DOI:10.1007/s004420050213 |
Maliepaard C C, Melchinger A E, Guthrie W D, Woodman W L. 1995. Mapping of QTLs for gandular trichome densities and Trialeurodes vaporariorum (greenhouse whitefly)resistance in an F2 from Lycopersicon esculentum Lycopersicon esculentum hirsutum f. glabratum. Heredity, 75: 425-433. DOI:10.1038/hdy.1995.155 |
Malik R S, Anand I J, Srinivasachar D. 1983. Effects of glucosinolates in relation to aphid (Lipaphis erysimi)fecundity in crucifers. International Journal of Tropical Agriculture, 1: 273-278. |
Matzinger D F, Mann T J, Cockerham C C. 1972. Recurrent family selection and correlated response in Nicotiana tabacum L. I.. 'Dixie Bright 244' X'coker 139'. Crop Sci., 12(1): 40-43. |
Maxwell F G, Lafever H N, Jenkins J N. 1965. Blister beetler on glandless cotton. Journal of Economic Entomology, 58: 792-798. DOI:10.1093/jee/58.4.792 |
Mehlenbacher S A, Plasisted R L, Tingey W W. 1984. Heritability of trichom density and droplet size in interspecific potato hybrids and relationship to aphid resistance. Crop Sci., 24: 320-322. DOI:10.2135/cropsci1984.0011183X002400020026x |
Nichols-Orians C M, Fritz R S, Clausen T P. 1993. The genetic basis for variation in the concentration of phenolic glycosides in Salix sericea:clonal variation and sex-based differences. Biochemical Systematics and Ecology, 21: 5, 535-542. |
Niemeyer H M. 1988. Hydroxamic acids (4-hydroxy-1, 4-benzoxazin-3-ones), defence chemicals in the graminese. Phytochemistry, 27: 3349-3358. DOI:10.1016/0031-9422(88)80731-3 |
Nienhuis J, Helentjaris T, Slocum M, Ruggero B, Schaefer A. 1987. Restriction fragment length polymorphism analysis of loci associated with insect resistance in tomato. Crop Sci., 27: 797-803. DOI:10.2135/cropsci1987.0011183X002700040039x |
Orians C M, Roche B, Fritz R S. 1996. The genetic basis for variation in the concentration of phenolic glycosides in Salix sericea: an analysis of heritability. Biochemical Systematics and Ecology, 24(7/8): 719-724. |
Payne T L. 1970. Electrophysrological investigat ions on response to pheromones in bark beetles. Contrib. Boyce Thompson Inst., 24: 275-282. |
Picard S, et al. 1994. Short time induction defense of a leuce poplar clone (P. tremula×P. tremuloides)against Chrysomela tremulae-propagation and evolution. A cta Horticulyurae, 381: 540-543. |
Rector B G, et al. 1998. Identifi cation of molecular markers linked to quantitative trait loci for soybean resistance to corn earworm. Theor Appl Genet, 96(6-7): 786-790. DOI:10.1007/s001220050803 |
Sanford L L, Deahl K L, Sinden S L, Ladd T L. 1990. Foliar solanidine glycoside levels in Solanum tuberosum populat ions select ed for potato leafhopper resistance. A merican Potato Journal, 67: 461-466. DOI:10.1007/BF03044513 |
Schon C C, Lee M, Melchinger A E, et al. 1993. M apping and characerization of quantitative traitloci affecting resistance against second generation European corn borer in maize with the aid of RFLPs. Heredity, 70: 648-659. DOI:10.1038/hdy.1993.93 |
Scriber J M, Lindroth R L, Nitao J. 1989. Differential toxicity of a phenolic glycoside from quaking aspen to Paplio glaucus butterly subspecies, hybrids and back crosses. Oecologia (Berlin), 81(2): 186-191. DOI:10.1007/BF00379804 |
Singh I D, Weaver S J. 1972. Studies on the heritability of gossypol in leaves and flower buds of Gossypium. Crop Sci., 12: 294-287. DOI:10.2135/cropsci1972.0011183X001200030012x |
Smith C M. "plant Resistance to insect. " Wiley, New York. 1989
|
Stoner A K, Frank J A, Gentie A G. 1968. The relationship of glandular hairs on tomatoes to spider mite resistance. Proc. Am. Hort. Sci., 93: 532-538. |
Tallamy D W. 1985. Squash beetle feeding behavior:an adaptation against induced cucurbit defenses. Ecology, 66: 1574-1579. DOI:10.2307/1938019 |
Tingey W M. Techniques for evaluating plant resistance to insect. In: Miller J R, Miller T A (eds)Insect-Plant Int eractions, pp. 251-284. Springer-Verlag, New York, 1986
|
Waller G R, Nowacki E K.. 1978. Alkaloid Biology and Metabolism in Plants. New York: Plenum Press.
|
White W H, Jenkins J N, Parrott W J, McCarty J C, et al. 1982. Generati on mean analyses of various alleochemics in cotton. Crop Sci, 22: 1046-1049. DOI:10.2135/cropsci1982.0011183X002200050036x |
Williams W G, Kennedy G G, Tamamoto R T, et al. 1980. 2-Tridecanone: a naturally occurring insecticide from the wild tomato Lycopersicon hirsutumf. Glabratum. Science, 207: 888-889. |
Wu R L, Han Y F, Hu J J, Fang J J, et al. 2000. An integrated genetic map of Populus deltoides based on amplified fragment length polymorphisms. Theor Appl Genet, 100(8): 1249-1256. DOI:10.1007/s001220051431 |
Yencho-G-C. 1986. Molecular markers locate genes for resistance to the Colorado potato beetle, Leptinotarsa decemlineata, in hybirid Solanum tuberosm x S. Berthaultii potato progenies. Entomologi a Experim entalis et Applicata, 81(2): 141-154. |
Zamir D, Selila ben-david T, Rudich J, Juvik J A. 1984. Frequency distributions and linkage relationships of 2-trdecadone in interspecific segregating generations of tomato. Euphytica, 33: 481-488. DOI:10.1007/BF00021148 |
Zangerk A R, Berenbaum M R. 1990. Furanocoumarin induction in wild parsnip:genetics and population variation. Ecology, 71: 1933-1940. DOI:10.2307/1937601 |
Zangerl A R, Bereenbaum M R, Levine E. 1989. Genetic control of seed chemistry and morphology in wild parsnip (Pastinaca sativa) J. Heredity, 80: 404-407. DOI:10.1093/oxfordjournals.jhered.a110885 |
 2000, Vol. 36
2000, Vol. 36