文章信息
- 李明亮, 韩一凡.
- Li Mingliang, Han Yifan.
- 乙烯在植物生长发育和抗病反应中的作用及其生物合成的反义抑制
- EFFECT OF ETHYLENE ON THE GROWTH AND DEVELOPMENT OF PLANTS AND INHIBITION OF ITS BIOSYNTHESIS BY ANTISENSE RNA
- 林业科学, 2000, 36(4): 77-84.
- Scientia Silvae Sinicae, 2000, 36(4): 77-84.
-
文章历史
- 收稿日期:1999-07-12
-
作者相关文章
乙烯(ethylene)已被公认为是1种植物激素(Kosugi et al., 1997; Yang et al., 1984; Mattoo et al., 1991; Abeles et al., 1992; Nickell, 1982)。迄今为止, 已发现的植物激素分5大类, 即生长素类、赤霉素类、细胞分裂素类、乙烯和脱落酸(Moore, 1979)。
乙烯广泛地存在于植物器官组织中, 如根、茎、叶、花、果实和种子, 在正成熟的果实组织中更多。组织中的乙烯正常含量是非常低的, 一般在0.01~10 nL·g-1·h-1范围内(潘瑞炽等, 1987)。
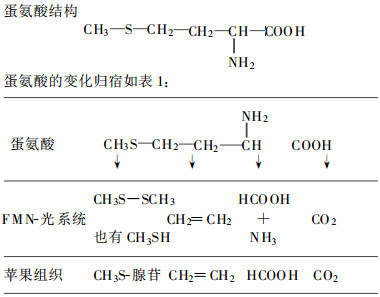
1.2 乙烯的生物合成及影响其生物合成的因素蛋氨酸(Met)作为乙烯生物合成的前体是由Liberman于1966年首次在苹果上证实的(Yang et al., 1984)。1979年, Adams和Yang利用乙烯生物合成过程中需氧这1特性, 在苹果切片上加L-MetO-14C, 追踪碳的代谢, 发现在形成多种中间产物后形成乙烯。用这种方法巧妙地证明了乙烯生物合成的直接前体是ACC(1-氨基环丙烷-1-羧酸), 并推断出乙烯的生物合成途径。
从上表可知, 在光和黄素单核苷酸的催化下, 蛋氨酸的C-1转变为CO2, C-2转变为甲酸; C-3和C-4转变为乙烯, S原子则保留在植物组织中。
|
Yang和Hoffman (1984)根据他们的研究结果(Adams et al., 1979; Yang et al., 1984)推断出, 在高等植物体内由蛋氨酸生成乙烯(反应①、②、③)及其循环反应如下:

|
从上面的反应可看出, 反应是通过S-腺苷蛋氨酸(SAM)、5-甲硫基腺苷(MTA)、5-甲硫基核糖(MTR)、1-磷酸-5-甲硫基核糖(MTR-1-P)和4-甲硫基丁酮酸(KMB)等中间产物, 形成一个环(YANG循环)。SAM转变为1-氨基环丙烷-1-羧酸(ACC)是在ACC合酶催化下完成的。在有氧条件下, ACC在ACC氧化酶的催化下形成乙烯。ACC合酶和ACC氧化酶是乙烯生物合成过程中的两个关键酶(Yu, 1979; Mattoo et al., 1991; Yang et al., 1984)。
植物组织中乙烯的合成是受严密的代谢进程控制的, 外界诱导因子也能启动这一反应。植物内源乙烯的合成速度随着植物的生长发育进程会发生明显的变化, 而且在不同植物间存在着较大的差异。根据乙烯生成量的多少和性质可以划分为微量乙烯(系统-Ⅰ乙烯)和大量乙烯(系统-Ⅱ乙烯) (Mcmurchie et al., 1972)。根据果实和花卉内乙烯大量生成与否, 人们把植物分为跃变型和非跃变型2大类。例如, Halevy(1986)根据植物在开花衰老过程中花瓣内乙烯大量生成与否, 将花卉植物划分为跃变型和非跃变型两大类。迄今为止已报道的跃变型花卉有香石竹、满天星、香豌豆、补血草、金鱼草、蝴蝶兰等, 概括起来包括兰科、石竹科、锦葵科等科植物。这类植物的开花和衰老与乙烯关系密切; 非跃变型花卉有菊花、石刁柏、千里红等, 概括起来包括百合科、天南星科等科的植物。这类花卉的开花和衰老通常对乙烯不敏感(Hyodo, 1989)。跃变型花卉在跃变前期只产生微量乙烯, 即系统-Ⅰ乙烯。当系统-Ⅰ产生的乙烯达到一定程度时, 诱导系统-Ⅱ开始产生乙烯, 启动整个衰老过程。非跃变型花卉在正常开花和衰老进程中只生成微量乙烯, 即系统-Ⅰ乙烯, 但是在遇到各种胁迫时, 也会产生系统-Ⅱ乙烯, 进而影响开花衰老进程。
影响乙烯合成的因素很多, 除内部因素外还有许多外部因素, 现已报道的能够诱导乙烯合成的外部因素有:外源乙烯、生长素、细胞分裂素+生长素、Ca+++细胞分裂素、机械损伤、病原体侵染、果实成熟、及胁迫因子(热害、冷害、旱害、涝害、盐害、Cd++、Li+和紫外线等)(Abeles, 1973; Solemos et al., 1976; Day et al., 1978; Yang et al., 1984; Gude et al., 1985; Marssen et al., 1986; Yip et al., 1989; Theologis, 1992; McIntosh, 1994); 乙烯生物合成及其生理作用的抑制剂有:氨氧乙酸(AOA)、氨氧乙烯基甘氨酸(AVG) (Yang et al., 1984)、水杨酸(SA) (Leslie et al., 1988)、降冰片二烯(NBD) (Wang et al., 1989)、重氮基环五二烯(DACP) (Sisler et al., 1986; Serek et al., 1994; Serek, 1994)、Co++(刘愚, 1986b)和Ag+(Veen et al., 1982; 高俊平, 1994)等。氨氧乙酸、氨氧乙烯基甘氨酸是ACC合成酶的抑制剂; Co++和水杨酸为ACC氧化酶的抑制剂; 降冰片二烯、重氮基环五二烯和Ag+则是乙烯作用抑制剂。用这些乙烯抑制剂处理香石竹、满天星、香豌豆等跃变型切花, 能抑制乙烯生物合成或拮抗乙烯作用, 同时也延缓切花的衰老进程(Guiltinan et al., 1994)。表明乙烯的代谢不仅受基因的调节, 而且也受外部条件的影响。
2 乙烯在植物体内的生理作用 2.1 乙烯在植物生长发育中的作用实验结果表明, 乙烯在植物体内的作用方式在于它能调节RNA和蛋白质的合成, 并能够调节细胞质膜的透性(潘瑞炽, 1982)。同时, 乙烯在其生物合成过程中能进行自我正、负反馈调节(Vendrell et al., 1971; Zeroni et al., 1976; Aharoni et al., 1979; Suttle et al., 1980; Riov et al., 1982; Yoshii et al., 1982; Hyodo et al., 1985; Liu et al., 1985; Inaba et al., 1986; Wang et al., 1989; Kende, 1993)。
在植物的生长发育过程中, 乙烯能够促进果实的成熟、促进离层的形成和植物器官的脱落、加速植物的衰老、促进次生物质的排泌、使黄化幼苗顶端钩展开、抑制幼苗伸长、促进根的形成, 并与植物的性别分化和植物幼苗上胚轴的负向地性生长等功能有密切关系。当乙烯和生长素同时作用植物时其效果更为显著(Lieberman, 1979; 潘瑞炽, 1982; Yang et al., 1984)。
2.1.1 果实的催熟幼嫩果实中的乙烯含量极微。随着果实的成熟, 乙烯合成加速, 与此同时, 由于乙烯增加细胞膜的透性, 使呼吸作用加速, 引起果实的果肉内有机物的强烈转化, 最后达到可食程度。乙烯催熟果实已在生产上广泛应用, 如番茄、柑桔、香蕉、柿子、草莓等果实的催熟。
2.1.2 促进脱落和衰老乙烯最早被人注意的一个作用, 是空气中乙烯浓度相当低时, 植物叶片和果实即可脱落。实际上, 在自然的脱落过程中, 也有乙烯参与。用乙烯利处理棉花叶, 有加速离层的形成、叶片的衰老(变黄)和脱落的作用, 老叶表现更为明显。浓度高时, 幼叶也会脱落。在其浓度合适时, 不影响功能叶片及幼叶的生长, 而只加速老叶脱落。生产上可喷施浓度适当的乙烯利促使棉花老叶脱落, 以改善棉茎部通风透光条件。有人用1, 000 mg/kg乙烯利水溶液喷在葡萄上, 很快引起落叶而果实不掉, 可提高收获时的工作效率。在果树栽培中, 在盛花和末花期, 用240~480 mg/kg的乙烯利喷施梨, 可达到疏果的效果。
2.1.3 促进次生物质排出橡胶树乳胶的排泌受乙烯的影响。实验证明, 无论是乙烯利的水剂或油剂处理, 都能使乳胶的产量第2 d即上升。总干胶产量可增加20 %~40 %以上(上海植物生理研究所激素研究室, 1975)。这种处理措施已在我国南方橡胶园中普遍采用。此外, 乙烯也能增加漆树、松树和印度紫檀等重要木本经济作物的次生物质的产量。有人还用乙烯利进行了刺激安息香产脂的试验, 处理后的产脂量可增大7~9倍, 有的达10倍以上。
2.1.4 促进菠萝开花和增加黄瓜雌花人们早就知道乙烯可以促使菠萝开花。实验指出, 100~250 mg/kg乙烯利处理黄瓜幼苗, 可使幼苗早期产生雌花, 雌花数成倍增加(Rudich et al., 1972; Rudich et al.1976; Kamachi et al., 1997; 李曙轩 et al., 1979; Mathooko, 1998)。
2.1.5 引起黄化苗的三重反应乙烯可抑制黄化豌豆幼苗上胚轴的伸长生长; 促进其加粗生长; 上胚轴负向地性生长特性丧失, 而横向生长。这3种反应称为“三重反应”, 是植物对乙烯的一种特殊反应。
除上述作用之外, 乙烯还能做作为信使物质参与植物的胁迫反应, 并能提高植物的抗逆性(Abeles, 1973; Solemos et al., 1976; Day et al., 1978; Yang et al., 1984; Gude et al., 1985; Marssen et al., 1986; Yip et al., 1989; Theologis, 1992; McIntosh, 1994)。这也是当前研究的热点。
由于乙烯是气体, 在生产上应用很不方便。现已发现乙烯可以从乙烯利(2-氯乙基膦酸)的液体化合物中产生。乙烯利无毒、无味, 而且它价格低廉, 又便于储存和使用, 是一种理想的乙烯释放剂。目前在生产上普遍使用, 特别是在果实催熟过程中被广泛应用。例如, 冬季塑料大棚中的番茄和草莓等果实的催熟通常使用乙烯利进行处理。
乙烯利在pH值高于4. 1时进行分解。由于植物体内的pH通常高于4. 1, 乙烯利的水溶液在进入组织后, 将被分解, 释放出乙烯气体。其反应如下:

|
近年来的研究发现, 许多物质参与植物的抗病原反应, 这些物质包括:植物抗毒素、抗菌蛋白、几丁酶、葡聚糖酶、酯酶、蛋白酶、磷脂酶、脂氧合酶、核酸酶、过氧化物酶、酚氧化酶、木质素、纤维素、富含羟基脯氨酸和甘氨酸的糖蛋白、酚多糖、黑色素、水杨酸、茉莉酸、乙烯、多肽、寡多糖、过氧化氢和活性氧类物质(Choi et al., 1996; Kue et al., 1997), 其中最受人们重视的是乙烯。大量的实验结果表明, 植物在受到病原菌侵染后其乙烯的释放量明显增加, 乙烯在植物的抗病反应中起着重要的作用(Boll, 1990; Bashan, 1994; Bailey et al., 1995; Choi et al., 1996; Dugassa et al., 1996; Leon et al., 1996; Popp et al., 1996; Chang et al., 1997; Buechter et al., 1997; Aloni et al., 1998; Knoester et al., 1998; Buell et al., 1998)。有人则更明确地指出, 乙烯是植物防御反应的报警信号物质并参与防御反应(Arnaud et al., 1998)。Song(1998)用Trifluralin处理棉花可提高其抗镰刀菌(Fosarium oxysporum)的抗病能力, 而抗病能力的提高与乙烯含量的降低成正相关。Cooper等(1998)将反义ACC氧化酶基因转化番茄, 其果实的乙烯释放量明显降低, 而果实抗病菌(Colletotrichum gloesporioides)侵染能力明显提高, 比对照提高25倍, 这一实验结果更为有力地证明番茄果实乙烯含量的降低能提高其抗病能力。也有不同的报道, Lund(1998)发现番茄感镰刀菌后乙烯大量产生, 而番茄的抗病能力的提高是和番茄对乙烯敏感性降低的缘故, 并非是乙烯合成的降低所致; Lautow (1995)在拟南芥抗单孢菌的实验中则发现拟南芥抗菌性的获得需要水杨酸, 而不是乙烯。目前关于乙烯在植物抗病反应中的作用机理虽然尚不清楚, 但所获得的实验结果已足以证明乙烯在植物抗病反应中起着十分重要的作用, 这一观点已成为人们的一种共识。至于少数不同的报道结果, 则可能是由于不同类型的植物其代谢途径不同所致。然而, 关于乙烯在植物抗病反应中的作用机理需要进一步的研究。
3 控制乙烯生物合成的基因工程策略及其展望 3.1 反义基因技术的原理和特点所谓反义基因技术, 是将特定基因的DNA片段反向连结在一启动子上, 然后转化植物, 使之形成转基因植物。这种转基因植物能够产生与该基因的mRNA互补的RNA链——反义RNA。其结果使植物中相应的mRNA水平大大降低, 使该基因的作用受到部分抑制或完全抑制。反义基因技术的应用, 为研究基因的表达及其功能调控提供了有效的方法, 同时也开辟了一种快速有效、专一性极强的育种新途径。
反义RNA是原核生物中广泛存在的一种调节因子, 对转座子活性、质粒复制、细菌或噬菌体基因表达及噬菌体发育过程中起调节作用(James, 1992; Ronato, 1992)。迄今, 尚未在真核生物中发现天然存在的反义RNA, 植物上利用的反义基因技术调节植物基因表达是依赖于原核生物有反义RNA调节理论发展起来的。
反义RNA可以抑制原核细胞和真核细胞的内源基因、病毒基因、质粒和可移动因子的表达。微注射的反义RNA、天然的或构建的反义基因的转录产物均能专一性地起抑制作用(宋俊岐等, 1997)。一般认为反义RNA与靶RNA具有特异互补性, 通过碱基配对结合的方式在复制、转录、翻译等过程中起负调节作用, 然而详细机理尚不清楚。一种可能是反义RNA直接结合在靶RNA的核糖体结合区及起始密码处, 影响核糖体与mRNA的结合, 从而阻断mRNA的翻译过程。在真核生物中, 反义RNA可存在于细胞质区域, 主要抑制mRNA的翻译过程。也有报道反义RNA存在于细胞核内, 可能直接影响转录或转录后的加工和向细胞质的转运。还有一种推测, 反义RNA与靶RNA结合形成杂交结构后容易被酶识别而降解。概括起来, 可能几种机制同时存在, 或者在不同体系中存在不同的作用机制。反义基因技术的特点如下: (1)反义基因可以高度专一地调节某一特定基因的表达。反义基因的不同区段抑制效果不同, 抑制程度理论上从0 %到100 %, 这不同于基因的完全致死抑制, 因此可以从转基因个体中筛选到所需的基因型。(2)转化到植物中的反义基因其作用类似遗传上的缺陷体, 表现为显性, 所以被转化的植物材料不必为纯合体, 从而避免了二倍体内等位基因的显隐性干扰。(3)利用反义基因不必了解其靶基因所编码的蛋白质结构, 可省去对基因产物的研究工作。(4)反义基因整合到植物的基因中, 可独立表达和稳定遗传, 后代的遗传符合孟德尔规律。(5)反义基因对内源靶基因的作用是在转录水平, 不改靶基因的结构。(6)反义基因所转录的产物— — —反义RNA, 与其靶基因的m RNA作用后二者极易被酶降解成单核苷酸, 无任何翻译产物产生, 即转基因植物不产生任何有毒物质, 在应用上更加安全。(7)反义基因的表达的程度可受外源调节。
3.2 反义基因技术在高等植物中成功应用的现状与展望由于乙烯是一种植物激素, 它能促进果实的成熟、花的衰老、花瓣和叶片的脱落等, 在高等植物的生长发育和抗病原反应过程中起着十分重要的调节作用(Christoffersen et al., 1982; 刘道宏, 1983; Brady et al., 1987; Zarembinski et al., 1994; Wouter et al., 1997)。因而寻求通过控制乙烯合成或其信号传递途径从而达到控制或延缓植物衰老、果实成熟和器官脱落一直是植物生理学家的研究课题之一。Adams和Yang(1979)阐明了乙烯生物合成途径, 其中催化SAM向ACC转化的ACC合酶和催化ACC氧化生成乙烯的ACC氧化酶是植物体内乙烯合成的2个关键酶(Yu, 1979;Yang et al., 1984; Mattoo et al., 1991; Kende, 1993; Mathooko, 1996)。随后, 有许多研究者先后从不同植物中克隆得到了ACC合酶和ACC氧化酶cDNA并测定了相应的DNA序列(Boller et al., 1979; Adams et al., 1979; Ververidis et al., 1991; Huang et al., 1991; Olson et al., 1991; Rottmann et al., 1991; Yip et al., 1992; Dong et al., 1992; Kende, 1993; Destefano-Beltran et al., 1995; Barry et al., 1996)。
近年来发展起来的反义基因技术给这项研究带来了希望(James, 1992; Ronato, 1992)。耐储藏转基因番茄植株的培育成功(Oeller et al., 1991), 标志着用反义基因技术控制有关乙烯合酶基因的表达, 从而控制乙烯生物合成是一条经济、安全、快速、有效的途径。由此揭开了利用反义基因技术培育耐储藏转基因植物的新篇章。Steve等(1993)将反义ACC氧化酶基因转化番茄, 结果发现不仅转基因植株乙烯的释放明显降低、番茄果实的成熟明显地受到抑制, 而且番茄叶片生长期延长, 叶片的衰老受到明显地抑制。John等(1995)将反义ACC氧化酶基因转化番茄, 发现转基因番茄植株不仅叶片的光合作用时间延长, 而且光合力增强、光合产物的积累增加。在国内, 也有许多成功的报道, 刘传银等(1998)将反义ACC合酶基因转入番茄获得了转基因植株并成功地抑制了其果实的成熟的报道; 李明亮等(1999)分别将反义ACC合酶基因、反义ACC氧化酶基因和这2个酶的融合基因转化美洲黑杨, 不仅成功地抑制了美洲黑杨乙烯的生物合成, 而且也抑制了叶片的脱落。同时还证明这2个酶的融合基因的抑制效果明显好于单基因1)。除转基因番茄和杨树外, 至今已获得转反义ACC合酶基因或反义ACC氧化酶基因的植物还有:香石竹(Savin et al., 1995)、白芥属植物(Pua et al., 1995)、烟草(Ma Qinghu et al., 1997)、甜瓜(Guis et al., 1997)、马铃薯(Cushman, 1998)、百合、满天星、猕猴桃和枣树1)。反义基因已在这些转基因植株中成功地表达, 抑制了这些植物乙烯的生物合成, 叶片和花瓣的衰老、脱落和果实的成熟也受到了明显地抑制。目前, 转反义ACC合酶基因香石竹已经在澳大利亚上市, 取得了良好的经济效益和社会效益, 受到人们的普遍欢迎。
1) 李明亮.大豆ACC合酶和番茄ACC氧化酶基因的克隆及其反义基因转基因植物的研究.中国林业科学研究院博士论文, 1998。
反义ACC合酶基因和反义ACC氧化酶基因在植物细胞内的表达, 除了能抑制果实的成熟、叶片和花瓣的衰老与脱落之外, 还能提高植物的抗逆性。Cushman(1998)将反义ACC合酶基因转化番茄和马铃薯发现转基因植株抗连续光照伤害的能力增强; Cooper等(1998)发现转反义ACC氧化酶基因番茄果实具有明显高的抗病菌(Colletotrichum gloeosporioides)感染能力(为对照植株的25倍); Ma Qinghu和Song Yanru(1997)将番茄的反义ACC合酶基因转到烟草中, 不仅成功地抑制了烟草体内乙烯的生物合成, 而且明显提高了烟草组培过程中的芽再生能力。
随着人们对反义基因在细胞内作用机理认识的不断深入和反义基因技术的广泛应用, 在不久的将来, 将有更多既具有抗病能力, 且其花和果实又耐贮藏、宜保鲜的转反义基因花卉和果树问世, 反义基因技术会在诸多方面极大地造福于人类。
高俊平, 叶新民, 孙自然, 等. 1994. 延缓月季和香石竹衰老的机理. 园艺学进展: 694-698. |
李曙轩, 傅炳通. 1979. 黄瓜及瓠瓜的性别表现与激素控制. 植物生理学报, 5(1): 83-92. |
李明亮, 韩一凡, 李玲, 等. 1999. ACC氧化酶cDNA克隆及其对杨树体内乙烯产生的反义抑制. 林业科学研究, 12(3): 223-229. DOI:10.3321/j.issn:1001-1498.1999.03.001 |
李明亮, 韩一凡, 邱德有, 等. 1998. ACC合酶cDNA克隆及其对杨树体内乙烯产生的反义抑制. 林业科学, 35(3): 10-16. |
刘传银, 田颖川, 沈全光, 等. 1998. 番茄ACC合成酶cDNA克隆及其对果实成熟的反义抑制. 生物工程学报, 14(2): 139-146. DOI:10.3321/j.issn:1000-3061.1998.02.004 |
刘道宏. 1983. 植物叶片的衰老. 植物生理学通讯, 2: 14-19. |
刘愚. 1986b. 果实成熟过程中乙烯的生成和作用. 大自然探索, 5(3): 127-132. |
潘瑞炽. 1982. 植物激素的作用机理. 植物生理生化进展, 1: 90-102. |
潘瑞炽, 董愚得.植物生理学.高等教育出版社, 1987, pp1~30
|
上海植物生理研究所激素研究室. 1975. 乙烯利对植物排泌乳液的刺激作用. 植物学报, 17(1): 49-53. |
宋俊岐, 赵春晖, 贺焰, 田波. 1997. 控制果实成熟的植物基因工程研究进展. 生物技术通报, 5: 8-13. |
Abeles FB. 1973. Ethylene in plant biology. New York: Academic Press.
|
Abeles FB, Morgan PW, Saltveit M E. 1992. Ethylene in Plant Biology. 2ed. New York: Academic Press.
|
Adams DO, Yang S F. 1979. Ethylene biosynthesis:identification of 1-aminocyclo-propane-1-carboxylic acid as an intermediate in the conversion of methionine to ethylene. Proc. Natl. Acad. Sci. U. S. A., 76: 170-174. DOI:10.1073/pnas.76.1.170 |
Aloni R, Wolf A, Feigenbaum P, et al. 1998. The never ripe mutant provides evidence that tumor-induced ethylene controls the morphogenesis of Agrobacterium tumefaciens-induced crown galls in tomato stems. Plant Physiol. Rockville, 117(3): 841-849. DOI:10.1104/pp.117.3.841 |
Arnaud M C, Thalouarn P, Fer A. 1998. Characterization of mechanism related to the resistance of crops to two parasitic higher plants (Cuscuta reflexa and Striga hermonthica). Comptes Rendus des Seances de la Societe de Biologie et de ses Filiales, 192(1): 101-119. |
Bailey BA, Avni A, Anderson JD. 1995. The influence of ethylene and tissue age on the sensitivity of xanthi tobacco leaves to a Trichoderma viride xylanase. Plant and Cell Physiol, 36(8): 1669-1676. |
Barry CS, Blume B, Bouzayen M, et al. 1996. Differential expression of the 1-aminocyclopropane-1-carboxylate oxidase gene family of tomato. Plant J, 9: 525-535. DOI:10.1046/j.1365-313X.1996.09040525.x |
Bashan Y. 1994. Symptom expression and ethylene production in leaf blight of cotton caused by Alternaia macrospora and Alternaria alternata alone and in combination. Can. J. Botany, 72(11): 1574-1579. DOI:10.1139/b94-194 |
Bolle T. 1990. Ethylene and plant-pathogen interactions. Curr. Top. Plant Physiol., 5: 138-145. |
Buell CR. 1998. Arabidopsis:A weed leading the field of plant-pathogen interactions. Plant Physiol. and Biochem. Paris, 36(1-2): 177-186. DOI:10.1016/S0981-9428(98)80102-2 |
Brady C, McGlsson B, Speirss J. Tomato Biotechnology, ed by Nevins, D J, Richard A J Published by INFO, NY, 1987
|
Buechter R, Stroemberg A, Schmelzer E, et al. 1997. Primary structure and expression of acidic (class Ⅱ)chitinase in potato. Plant Mol. Biol, 35(6): 749-761. DOI:10.1023/A:1005830706507 |
Chang PFL, Xu Y, Narasimhan M L, et al. 1997. Induction of pathogen resistance and pathogenesis-related genes in tobacco by a heat-stable Trichoderma mycelial extract and plant signal messengers. Physiologia Plantarum, 100(2): 341-352. DOI:10.1111/j.1399-3054.1997.tb04792.x |
Choi D, Kim HM, Yun HK, et al. 1996. Molecular cloning of a metallothionein-like gene from Nicotiana glutinosa L. and its induction by wounding and tobacco mosaic virus infection. Plant Physiol. (Rockville), 112(1): 353-359. DOI:10.1104/pp.112.1.353 |
Chrisltoffersen R E, Warm E, Laties G G, et al. 1982. Gene expression during fruit ripening in avocado. Planta, 155: 52-57. DOI:10.1007/BF00402931 |
Cooper W, Bouzayen M, Hamilton A, et al. 1998. Use of transgenic plants to study the role of ethylene and polygalacturonase during infection of tomato fruit by Colletotrichum gloeosporioides. Plant Pathology Oxford, 47(3): 308-316. DOI:10.1046/j.1365-3059.1998.00228.x |
Cushman KE. 1998. The role of ethylene in the development of constant-light injury of potato and tomato. J. Amer. Soc. Hort. Sci., 123(2): 239-245. DOI:10.21273/JASHS.123.2.239 |
Day DA, Aron GP, Christoffersen RE, Laties GG. 1978. Effect of ethylene and carbon dioxide on potato metabolism stimulation of tuber and mitochondria respiration, and inducement of the alternative path. Plant Physiol., 62: 820-825. DOI:10.1104/pp.62.5.820 |
Destefano-Beltran LJC, Caeneghem WV, Gelen J, et al. 1995. Characterization of three members of the ACC synthase gene family in Solanum tuberosum L. Mol. Gen. Genet., 246: 496-508. DOI:10.1007/BF00290453 |
Dong JG, Fernández-Maculet CJ and Yang SF. Proc. Natl. Acad. Sci. U. S. A., 1992, 89: 9789~9793
|
Dugassa GD, Von AT, Schoebeck F. 1996. Effects of arbscular mycorrhiza (AM) on health of Linum usitatissimum L. Infected by fungal pathogens. Plant and Soil, 185(2): 173-182. DOI:10.1007/BF02257522 |
Gude H, van der Plas LHW. 1985. Endogenous ethylene formation and the development of the alternative pathway in potato tuber discs. Physiol. Plant, 65: 57-62. DOI:10.1111/j.1399-3054.1985.tb02359.x |
Guiltinan MJ, Deikman J. 1994. Molecular and genetic approaches to the study of plant hormone action. Hort. Rev., 16: 1-32. |
Guis M, Botondi R, Ben AM, et al. 1997. Ripening-associated biochemical traits of cantaloupe charentais melons expressing an antisense ACC oxidase transgene. J. Amer.Soc. Hort. Sci., 122(6): 748-751. DOI:10.21273/JASHS.122.6.748 |
Halevy AH. Flower senescence. In: Leshem YY, Holevy AH and Frenkel Ced. Processes and control of plant senescence. Elsevier, Amsterdam, 1986
|
Hyodo H, Tanaka K, Yoshisaka J. 1985. Induction of 1-aminocyclopropane-1-carboxylic acid synthase in wounded tissue of winter squash fruit and effects of ethylene. Plant Cell Physiol., 26: 161-167. |
Hyodo H. 1989. Flower senescence and ethylene. Agriculture and Horticulture in Japan, 64: 19. |
Inaba A, Nakamura R. 1986. Effect of exogenous ethylene concentration and fruit temperature on the minimum treatment time necessary to induce ripening in banana fruit. J. Japan. Soc. Hort. Sci., 55: 348-354. DOI:10.2503/jjshs.55.348 |
James AH. 1992. Antisense RNA and DNA. Murray editor. New York: Wiley-liss.
|
John I, Drake R, Farrell A, et al. 1995. Delayed leaf senescence in ethylene-deficient ACC oxidase antisense tomato plants: Molecular and physiological analysis. Plant J., 7(3): 483-490. DOI:10.1046/j.1365-313X.1995.7030483.x |
Kamachi S, Sekimoto H, Kondo N, et al. 1997. Cloning of a cDNA for a 1-aminocyclopropane-1-carboxylate synthase that is expressed during development of female flowers at the apices of Cucumis sativus L. Plant Cell Physiol., 38(11): 1197-1206. DOI:10.1093/oxfordjournals.pcp.a029106 |
Kende H. 1993. Ethylene biosynthesis. Ann. Rev. Plant Physiol. Plant Mol. Biol., 44: 283-307. |
Knoester M, Van LLC, Van DHJ, Henning J, et al. 1998. Ethylene-insensitive tobacco lacks nonhost resistance against soil-borne fungi. Proc. Natl. Acad. Sci. U. S. A., 95(4): 1933-1937. DOI:10.1073/pnas.95.4.1933 |
Kosugi Y, Naoko O, Shigeru S, et al. 1997. Inhibition by 1-aminocyclobutane-1-carboxylate of the activity of 1-aminocyclopropane-1-carboxylate oxidase obtained from senescing petals of carnation (Dianthus caryophyllus L.)Flowers. Plant Cell Physiol, 38(3): 312-318. DOI:10.1093/oxfordjournals.pcp.a029168 |
Kue J. 1997. Molecular aspects of plant responses to pathogens. Acta Physiologiae Plantarum, 19(4): 551-559. DOI:10.1007/s11738-997-0053-2 |
Lawton K, Weymann K, Frienrich L, et al. 1995. Systemic acquired resistance in Arabidopsis requires salicylic acid but not ethylene. Mol. Plant Microbe Interactions, 8(6): 863-870. DOI:10.1094/MPMI-8-0863 |
Leon R, Santamaria JM, Alpizar L, et al. 1996. Physiological and biochemical changes in shoots of coconut palms affected by lethal yellow ing. New Physiologist, 134(2): 227-234. DOI:10.1111/j.1469-8137.1996.tb04627.x |
Leslie CA, Romani RJ. 1988. Inhibition of ethylene biosynthesis by salicylic acid. Plant Physiol., 88: 833-837. DOI:10.1104/pp.88.3.833 |
Lieberman M. 1979. Biosynthesis and action of ethylene. Ann. Rev. Plant Physiol., 30: 533-591. DOI:10.1146/annurev.pp.30.060179.002533 |
Liu Y, Hoffman NE, Yang SF. 1985. Production by ethylene of the capability to convert 1-aminocyclopropane-1-carboxylic acid to ethylene in preclimacteric tomato and cantaloupe fruits. Plant Physiol., 77: 407-411. DOI:10.1104/pp.77.2.407 |
Lund ST, Stall RE, Klee HJ. 1998. Ethylene regulates the susceptible response to pathogen infection in tomato. Plant Cell, 10(3): 371-382. DOI:10.1105/tpc.10.3.371 |
Ma Qinghu, Song Yanru. 1997. Expression of tomato antisense ACC synthase gene in transgenic tomato and its role in shoot formation. Acta Botanica Sinica, 39(11): 1047-1052. |
Marssen N, van der Plas LHW and Duy S. Influence of temperature, ethylene and cyanide on the occurrence of alternative respiration in mitochonbolria fromiris bulbs. 1986, 45: 19~25
|
Mathooko FM. 1996. Regulation of ethylene biosynthesis in higher plants by carbon dioxide. Postharv. Biol. Technol, 7: 1-26. DOI:10.1016/0925-5214(95)00026-7 |
Mathooko FM, Akitsugu Inaba, Reinosuke Nakamura. 1998. Characterization of carbon dioxide stress-induced ethylene biosynthesis in cucumber (Cucumis sativus L.)Fruit. Plant Cell Physiol., 39(3): 285-293. DOI:10.1093/oxfordjournals.pcp.a029369 |
McIntosh L. 1994. Molecular biology of alternative oxidase. Plant Physiol., 105: 781-786. DOI:10.1104/pp.105.3.781 |
McMurchie EJ, McGlosson WB and Eaks IL, Eaks IL. 1972. Treatment of fruit with propylene gives information about the biogenesis of ethylene. Nature, 237: 235-236. DOI:10.1038/237235a0 |
Moore TC. 1979. Biochemistry and physiology of plant hormones. New York: Springer Verlag.
|
Nickell LG. 1982. Plant growth regulators, agricultural uses. Berlin: Spriger Verla.
|
Olson DC, White JA, Edelman L et al. Proc. Natl. Acad. Sci. U. S. A.1991, 88: 5340~5344
|
Popp MP, Lesney MS, David JM. 1996. Defense responses elicited in pine cell suspension cultures. Plant Cell Tissue and Organ Culture, 47(3): 199-206. |
Pua EC, Lee JEE. 1995. Enhanced de novo shoot morphogenesis in vitro by expression of antisense 1-aminocyclopropane-1-carboxylate oxidase gene in transgenic mustard plants. Planta (heidelberg), 196(1): 69-76. |
Renato B and David TD. Antisense Strategies. New York Acad. Sci., 1992
|
Riov J, Yang SF. 1982. Effects of exogenous ethylene on ethylene production in citrus leaf tissue. Plant Physiol., 70: 136-141. DOI:10.1104/pp.70.1.136 |
Rottmann WH, Peter GF, Oeller PW et al. J Mol Biol., 1991, 222: 937~961
|
Rudich J, Baker LR, Scott JW, et al. 1976. Phenotypic stability and ethylene evolution in androecious cucumber. J. Amer. Soc. Hort. Sci., 101: 48-51. |
Rudich J, Halevy AH, Kedar N. 1972. Ethylene evolution from cucumber plants as related to expression. Plant physiol., 49: 998-999. DOI:10.1104/pp.49.6.998 |
Savin KW, Baudinette SC, Graham MW, et al. 1995. Antisense ACC oxidase RNA delay carnation petal senescence. Hortscience, 30(5): 970-972. DOI:10.21273/HORTSCI.30.5.970 |
Serek M. 1994. Novel gaseous ethylene biding inhibitor prevents ethylene effected in potted flowering plants. J. Amer. Soc. Hort. Sci., 119(6): 1230-1233. DOI:10.21273/JASHS.119.6.1230 |
Serek M, Michael SR. 1994. A volatile ethylene inhibitor improves the postharvest life of potted roses. J. Amer.Soc. Hort. Sci., 119(5): 572-577. |
Sisler EC, Reid MS, Yang SF. 1986. Effect of antagonists of ethylene action on binding of ethylene in cut carnations. Plant Grow th Regulation, 4: 213-218. DOI:10.1007/BF00028164 |
Solemos T, Laties GG. 1976. Induction by ethylene of cyanide-resistant respiration. Biochem. Biophys. Res. Comm., 70: 663-671. DOI:10.1016/0006-291X(76)91098-6 |
Song Feng-Ming, Zheng Zhong. 1998. The correlation between inhibition of ethylene production and trifluralin-induced resistance of cotton seedlings against Fusarium oxysporum f. Sp. Vasinfectum. Acta Physiologica Sinica, 24(2): 111-118. |
Steve P, Sarah LB, Mondher B, et al. 1993. Altered fruit ripening and leaf senescence in tomatoes expressing an antisense ethylene-forming enzyme transgene. The Plant J., 3(3): 469-481. DOI:10.1111/j.1365-313X.1993.tb00167.x |
Suttle JC, Kende H. 1980. Methionine metabolism and ethylene biosynthesis in senescing petals of Tradescanita. Phytochem., 19: 1075-1079. DOI:10.1016/0031-9422(80)83059-7 |
Theologis A. 1992. One rotten apple spoils the whole bushel:The role of ethylene in fruit ripening. Cell, 70: 181-184. DOI:10.1016/0092-8674(92)90093-R |
Veen H, Kwakkenbos AAM. 1982. The effect of silver thiosulphate pretreatment on 1-aminocyclopropane-1-carboxylic-acid content and action in cut carnations. Scientia Hort, 18: 227-286. |
Vendrell M, MacGlasson WB. 1971. Inhibition of ethylene production in banana fruit tissue by ethylene treatment. Aust. J. Biol. Sci., 24: 885-895. DOI:10.1071/BI9710885 |
Wang H, Woodson WR. 1989. Reversible inhibition of ethylene action and interruption of petal senescence in carnation flowers by norbornadiene. Plant Physiol., 89: 434-438. DOI:10.1104/pp.89.2.434 |
Wouter G, Van Doorn, Anthony D. 1997. Abscission of flowers and floral parts. J. Exp.Botany, 48(309): 821-837. |
Yang SF, Hoffman NE. 1984. Ethylene biosynthesis and its regulation in higher plants. Ann. Rev Plant Physiol., 35: 155-189. DOI:10.1146/annurev.pp.35.060184.001103 |
Yip KC, Hew CS. 1989. Ethylene-induced cyanide-resistant respiration in orchid petal cells. Plant Grow th Regul, 8: 365-373. DOI:10.1007/BF00024666 |
Yip WK, Moore T and Yang SF. Proc. Natl. Acad. Sci. U. S. A., 1992, 89: 2475~2479
|
Yoshii H, Imaseki H. 1982. Regulation of auxin-induced ethylene biosynthesis. Repression of inductive formation of 1-aminocyclopropane-1-carboxylate synthase by ethylene. Plant Cell Physiol, 23: 639-649. |
Yu BY, Adams DO, Yang SF. 1979. 1-Aminocyclopropane carboxylate synthase, a key enzyme in ethylene biosynthesis. Arch. Biochem. Biophys, 198: 280-286. DOI:10.1016/0003-9861(79)90420-X |
Zarembinski TI, Theologis A. 1994. Ethylene biosynthesis and action:a case of conservation. Plant Mol. Biol., 26: 1579-1597. DOI:10.1007/BF00016491 |
Zeroni M, Galil J, Ben YS. 1976. Autoinhibition of ethylene formation in nonripening stages of the fruit of sycamore fig (Ficus sycomorus L.). Plant Physiol., 57: 647-650. DOI:10.1104/pp.57.4.647 |
 2000, Vol. 36
2000, Vol. 36
