文章信息
- 汤浩茹, 王永清, 任正隆.
- Tang Haoru, Wang Yongqing, Ren Zhenglong.
- 核桃体细胞胚发生与转基因研究进展
- AN OVERVIEW OF PROGRESS ON SOMATIC EMBRYOGENESIS AND TRANSFORMATION IN WALNUT
- 林业科学, 2000, 36(3): 102-109.
- Scientia Silvae Sinicae, 2000, 36(3): 102-109.
-
文章历史
- 收稿日期:1998-10-15
-
作者相关文章
2. 四川农业大学植物遗传育种省级重点实验室 雅安 625014
2. State Key Laboratory of Plant Genetics and Breeding, Sichuan Agricultural University Yaan 625014
核桃(Juglans)是果、木兼用的优良经济树种。长期以来, 核桃主要采用实生与嫁接繁殖。自然授粉和实生繁殖难以保持品种的优良特性。由于切口氧化褐变, 嫁接繁殖的成功率极低。为了满足生产对良种苗木的需要, 核桃的离体繁殖技术得到了深入研究(McGranahan et al., 1987)。核桃试管苗生根极难, 限制了核桃离体繁殖技术的应用。核桃的体细胞胚(简称体胚)具有完整的两极结构, 能一次再生完整植株(Tulecke et al., 1985)。同时, 能反复产生次生胚而形成体胚无性系。核桃的体胚发生系统为核桃的离体繁殖提供了新途径并已用于繁殖核桃苗木(Tulecke et al., 1995)。
核桃是天然异花授粉植物, 而且其继代繁殖周期长。用传统的选育种方法对核桃进行品种改良不仅耗资耗时, 而且收效缓慢。现代无性基因转移方法不仅避免了因有性重组带来的不良后果, 而且能加快品种改良的进程、提高改良的效果(Oliveira et al., 1996)。能否获得转基因植株, 除基因转移的方法外, 在很大程度上取决于有效离体培养再生系统。原生质体培养与叶圆片培养是目前运用最为广泛的转基因植株再生系统(Oliveira et al., 1996)。但是, 核桃的原生质体培养与叶圆片培养还未成功(McGranahan et al., 1987)。核桃的体胚发生为核桃的转基因研究提供了良好的离体培养再生系统(McGra-nahan et al., 1988)。利用体胚发生系统, 不仅将外源报告基因转入了核桃, 而且有价值基因已转入核桃并得到了表达(Dandekar et al., 1989; Dandekar et al., 1998; Eluch et al., 1996; Eluch et al., 1998; Jay-Allemand et al., 1991; McGranahan et al., 1990)。
1 核桃的体细胞胚发生自Tulecke等(1985)首次报道核桃的体胚发生以来, 相继在核桃的5个种和3个杂种中有了体胚发生的报道(表 1)。与其它植物一样, 核桃体胚发生是个十分复杂的过程, 其机理还不清楚。核桃的体胚发生受多种因素的影响, 其中外植体与培养基(包含植物生长调节剂)对体胚发生起决定作用。
|
|
植物的每个细胞均有成胚的潜力, 但成胚频率最高的是那些具有较高胚性感受能力(embryogenic competence)的细胞。在核桃中, 幼胚及其组成成分具有较高的胚性感受态水平。因而, 核桃的体胚发生主要是采用幼胚及其组成成分(子叶)作外植体而获得的(表 1)。
与大多数植物一样, 核桃的组织或细胞维持高水平的胚性感受态的时间极短, 而且胚性感受态水平的高低还与基因型有关。授粉后3~4周时的黑核桃幼胚开始具有体胚发生能力, 而以授粉后6~7周时的幼胚体胚发生频率最高, 此时子叶开始具备体胚发生能力(Corn, 1988)。授粉8周以后, 幼胚的体胚发生能力下降, 而子叶的体胚发生能力升高。子叶体胚的发生能力可维持至授粉后14周, 而以授粉后8~12周时的子叶体胚发生能力最强(Neuman et al., 1993)。核桃(Tulecke et al., 1985)和灰核桃(Rijut, 1993)具有类似的表现。尽管采用较高浓度的植物生长调节剂处理可以将黑核桃子叶的胚性感受态时间从授粉后14周延长至17周, 但其体胚发生的频率极低(Neuman et al., 1993)。授粉后18周至果实成熟时的子叶具备器官发生能力, 但却失去了体胚发生能力(Long et al., 1995; Long et al., 1992)。
核桃也属无性繁殖的果树, 相对而言, 从营养繁殖器官诱导获得的体胚更具实用价值。Aly等(1992)用套袋隔离花粉而获得了“无融合生殖”的核桃果实。他们诱导培养该果实的幼胚而获得了体胚。但是, 经同功酶与限制性长度多态片段分析发现, 该体胚仍然属合子胚起源。刘淑兰等(1992)用幼龄实生苗叶柄作外植体进行诱导而获得了胚状体结构, 但未能将此胚状体结构转化成体胚。Tulecke等(1995)用胚囊、花序梗、根、茎等作外植体进行诱导只获得了愈伤组织, 少数愈伤组织能进行器官发生, 但都未发生体胚。我们用单核期花药和试管苗叶柄、叶脉、茎等作试验获得与Tulecke等相似的结果。迄今为止, 还未有从营养器官诱导核桃体胚发生的报道。
1.2 培养基与植物生长调节剂McGranahan等(1987)非常强调DKW在核桃离体培养中的作用。McGranahan等(1987)指出, Driver和Kuniyuki(1984)发表的DKW培养基配方有印刷错误。他们多次予以更正。更正后的DKW培养基取名为DKW-C的配方(表 2)。DKW也是核桃体胚发生的首选培养基(表 1)。DKW适用于核桃及其杂种的体胚诱导, 但却不适用于黑核桃(Neuman et al., 1993)。Long等(1995; 1992)的比较试验指出, 培养在DKW上的黑核桃子叶只有18 %产生胚, 平均每个外植体产生1个胚, 而培养在WPM上的黑核桃子叶有78 %产生胚, 平均产生22个胚。我们的试验发现, 培养基对核桃体胚发生的作用不仅与基因型有关, 而且还与外植体的种类有关。在相同条件下, 培养在MS上的幼胚体胚发生频率高, 数量多, 而培养在DKW上的子叶成胚频率高、数量多。但无论是幼胚还是子叶均未在WPM上产生胚。Kornova等(1993)能从培养在MS上的核桃幼胚获得体胚, 但不能从培养在DKW上的幼胚与子叶获得体胚。这进一步说明培养基与外植体在体胚发生上的相互作用。
|
|
生长素、尤其是2, 4-D是广泛用于诱导植物体胚发生的生长调节剂, 但却在核桃中少有应用(表 1)。被认为对体胚发生有阻碍作用的细胞分裂素类却是用于核桃体胚发生的主要生长调节剂。这可能与核桃的特殊生理机制有关。4.4BA +9.3KT +0.05IBA(单位μM)是核桃体胚诱导的主要生长调节剂组成形式, 但不同的基因型与外植体间有差异(表 1)。Kornova等(1993)和Neuman等(1993)采用上述生长调节剂组成未能诱导核桃和黑核桃子叶体胚发生。Neuman等(1993)认为0.05-5.0TDZ+1.0-10.0 2, 4-D更适于黑核桃子子叶的体胚诱导。这被后来Long等(1995; 1992)的比较试验所证实。Jay-Allemand等(1991)和Kornova等(1993)认为BA对幼胚的发育有阻碍, 在含BA的培养基上, 幼胚难以发生体胚。但是, 袁巧平等(1990a; 1990b)能够在仅含BA的培养基上诱导幼胚的体胚发生。有研究指出, 植物生长调节剂不是幼胚体胚发生所必需的, 在无生长调节剂的培养基上也能获得幼胚的体胚(Kornova et al., 1993; McGranahan et al., 1986)。
核桃的体胚发生已有了较多的报道。但是, 体胚发生均是在不同条件(外植体或培养基)下获得的。在相同条件下比较不同基因型或外植体体胚发生能进一步揭示核桃的体胚发生规律, 为从成熟营养器官获得体胚打下基础。
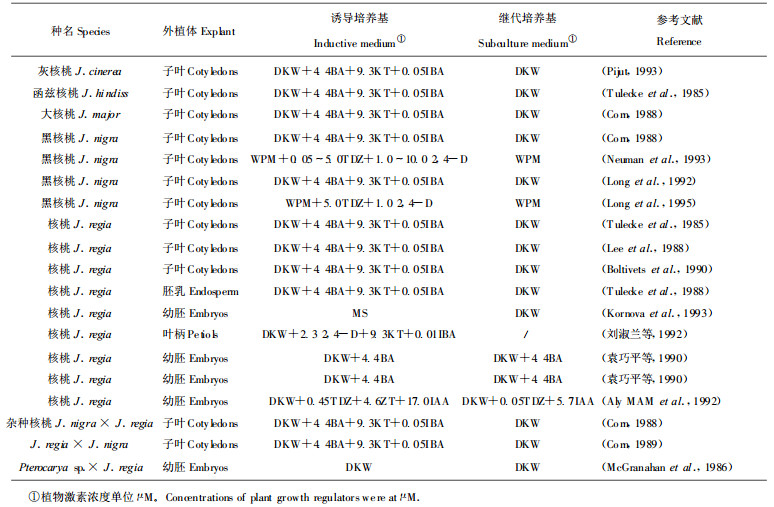
2 体胚的出现与次生胚发生外植体在诱导培养基上经2~4周诱导后转入无生长调节剂的基本培养基, 早的2周左右, 晚的6个月左右便能见到体胚(Tulecke et al., 1985)。核桃体胚的发育也遵循合子胚发育的历程, 由球形胚经心形胚与子叶期胚发育成熟。由于体胚发育的不同步, 经常在同一外植体上见到不同发育时期的胚(图 1)。将子叶未展开前的胚从初生组织或胚上剥离下来单独培养, 在胚上便形成胚, 由此而形成体胚无性系(Tulecke et al., 1985)。

|
图 1 核桃幼果胚珠(A)与胚轴(B)的体细胞胚发生 Fig. 1 Somatic embryos forming from an ovule (A) and an embryonic axis (B) of walnut immature fruits (Juglans regia L.) |
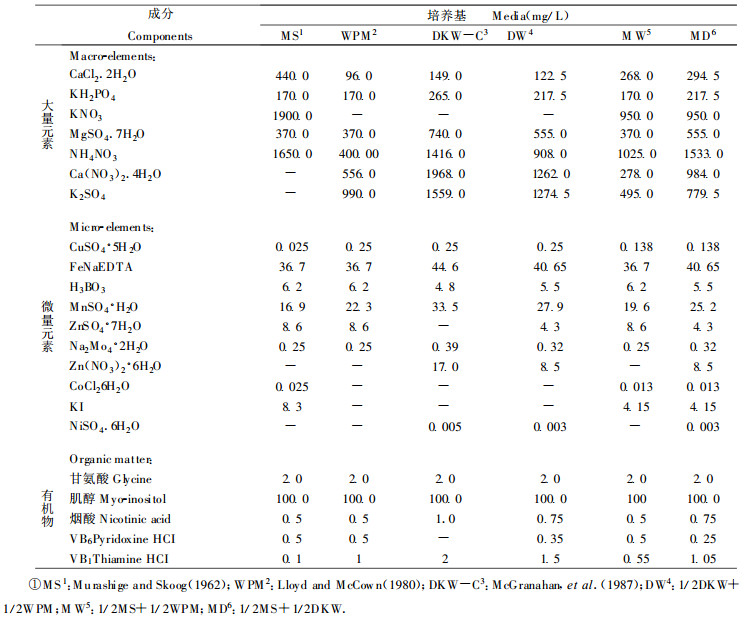
生长发育正常、具典型的结构、3~5 mm大小的胚是最易发生次生胚(Tulecke et al., 1985; Tulecke et al., 1995)。初生胚的多种部位都能形成次生胚, 但其子叶正面与其下胚轴是最易形成次生胚的部位(图 2)。
|
图 2 核桃次生胚发生于初生胚子叶正面(A)与初生胚下胚轴区(B) Fig. 2 Repetitive somatic embryos forming from the adaxial surface of cotyledons (A) and radicle regions (B) of walnut somatic embryos |
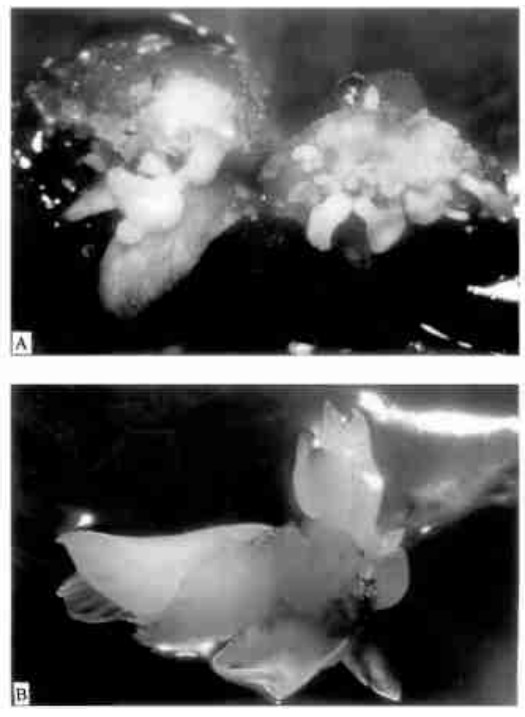
次生胚产生的速率与培养基的组成有关。在不含生长调节剂的基本培养基中, 次生胚产生的速率低。如加入微量的生长调节剂, 在增加次生胚的同时, 增加了畸型胚的比例。如改变基本培养基的组成, 不仅能提高次生胚产生的速率, 而且能使胚正常发育。Long等(1995)发现, 黑核桃的次生胚在无生长调节剂的DKW培养基上产生速率低, 而且胚只能发育至球形胚期。如改用WPM培养, 胚的发育只稍有改善。如采用DW培养基, 次生胚产生的速率高, 胚也能正常发育至成熟。我们用核桃的体胚作试验也得到同样的结果。同时我们还发现, 在核桃次生胚产生与发育上, 采用MW培养基效果更好, 但采用MD会阻碍次生胚发生。用于核桃体胚发生的几种培养基组成列于表 2中。图 3反映了这几种基本培养基对核桃次生胚发生的影响。
|
图 3 培养基基本成分对核桃次生胚发生的影响 Fig. 3 A compariso n of medium nutrients in secondary somatic embryo production in walnut 上排从左至右: M W, DW和M D培养基。下排从左至右: DKW, M S和W PM培养基 Upper line from left to righ t: MW, DW and MD media. Lower line from left to right : DKW, MS and WPM media |
核桃体胚的萌发与转化率极低(Corn, 1988; Tulecke et al., 1985)。Tulecke等(1985)认为, 核桃体胚与合子胚一样具有休眠特性。3 ℃~5 ℃低温处理8~10周才能打破休眠。尽管一些体胚未经低温处理或经2~4周短时低温处理也能萌发, 但往往形成不正常植株。Lee等(1988)和Deng等(1998)认为低温处理的效果也较差。Deng等(1998)报道采用饱和Mg(NO3)2·6H2O或ZnSO4·7H2O对体胚脱水处理3~5 d, 然后在湿棉纸上萌发可提高萌发率4~5倍。如脱水处理后在琼脂固化培养基上萌发其萌发率与低温处理的相似。体胚的质量(成熟度)对体胚的萌发率影响较大。发育较差的胚, 既使经低温或脱水处理也难以萌发(Deng et al., 1998; Tulecke et al., 1985)。
将萌发的体胚置于无生长调节剂的培养基上, 给予光照, 2~3周左右体胚便开始生长。为了促进转化植株的生长, 采用低盐浓度的培养基或降低蔗糖浓度、附加活性炭是有效方法(McGranahan et al., 1987)。植株生长至5~8 cm高时, 可移入培养土驯化炼苗或进行离体增殖培养。
4 核桃体胚的转基因研究Dandekar等(1988)用核桃与函兹核桃及其杂种的无性离体繁殖新梢作外植体, 用带致瘤质粒的农杆菌作感染转化, 诱导获得了能在无生长调节剂的培养基上生长的瘤组织。尽管未能获得转基因植株, 但证明农杆菌能够感染核桃。McGranahan等(1988; 1990)用核桃体胚作受体进行基因转移研究发现, 农杆菌不仅能侵染体细胞胚, 而且受农杆菌侵染的体胚也能再生完整植株。同时, 用体细胞胚作受体不须进行刻伤处理。尽管对核桃初生胚的起源有多种观点, 而核桃的次生胚却是表皮单细胞起源的(Polito et al., 1989)。用核桃的次生胚发生系统进行外源基因转移能够获得纯合的转基因植株。
McGranahan等(1988)首次用核桃的体胚发生系统进行外源基因转移, 虽然成功地获得了抗卡那霉素的转基因植株, 但其转化效率低, 方法繁琐。Dandekar等(1989)对转化方法进行了改进。McGranahan等(1990)采用改进的方法同样获得了转基因植株, 同时还提高了转化效率与加快了选择进度。
考德林蛾(苹果小卷蛾) (Cydia pomonella L.)是核桃的一种重要害虫(University of Califonia, 1987)。用化学药剂防治该虫不仅效果低, 而且还会引发其它害虫。考德林蛾对从苏云金芽孢杆菌(Bacillus thuringiensis)中分离纯化的晶体蛋白(B.t.毒素)非常敏感, 极其微量的B.t.毒素就能致死考德林蛾(Vail et al., 1991)。Dandekar等(1994)将编码B.t.毒素的基因之一cry IA(c)转入了核桃的体细胞胚, 再生的核桃植株仅表现了极低的抗虫性。其主要原因是该基因来自于苏云金芽孢杆菌的野生变种(B.thuringiensis var.kurstaki), 其遗传密码有较大偏移。Dandekar等(1998)通过人工构建该基因, 然后再转移。再生植株表现了高度的抗虫性。cry IA(c)基因是第一个引入核桃并得到表达的有价值基因。
核桃试管苗的生根极难, 其主要原因之一是插条中含有较多的类黄酮类酚类化合物。类黄酮类物质的合成是受查耳酮合成酶控制的。Eluch等(1996; 1998)和Jay-Allemand等(1991)将查耳酮合成酶反义基因转入了核桃的体胚。再生植株表现类黄酮类物质的减少, 在微繁新梢中检测不到栎苷、杨梅苷、花青苷等物质。在生根试验中, 转基因新梢表现对外源生长素敏感, 生根能力增强。
有关用核桃体细胞胚作受体的转基因研究报道列于表 3。根据已有的报道并结合我们的实践经验。我们将用核桃体胚发生系统进行外源基因转移的操作程序归纳于图 4。
|
|

|
图 4 用核桃体细胞胚进行基因转移的操作程序 Fig. 4 Procedures for obtaining transgenic plants from somatic embryos of walnut by using Agrobacterium-mediated method |
在过去的十多年时间里, 核桃的体细胞胚发生与转基因研究取得了巨大进展。用体胚发生途径代替器官发生途径繁殖苗木已得到应用(Tulecke et al., 1985; Tulecke et al., 1995)。通过体胚发生途径产生种内杂种(Corn, 1988; Corn, 1989)、种间杂种(MCGranahan et al., 1986)、三倍体(Tulecke et al., 1988)等极大地丰富了核桃的种质资源。核桃体胚的超低温保存已取得进展(Boucad et al., 1994)。外源有价值基因转入核桃并得到表达(Dandekar et al., 1994; 1998; Eluch et al., 1996; 1998; Jay-Allemand et al., 1991; McGranahan et al., 1990)。随着核桃体胚发生研究的深入, 有价值基因分离与克隆的增多, 遗传转化系统的日臻完善, 用遗传工程方法全面改良核桃品种将指日可待。
刘淑兰, 韩碧文, 陈正华. 1992. 核桃细胞胚胎发生及其细胞学观察. 北京农业大学学报, 18(2): 29-32. |
袁巧平, 董茂山, Jay-Allemand C. 1990a. 离体条件下核桃器官发生和体细胞胚胎发生. 林业科学, 26(6): 495-498. |
袁巧平, 董茂山, 黄钦才, 等. 1990b. 核桃细胞胚诱导的初步研究. 林业科技通讯, 7(1): 13-14. |
Aly MAM, Fjellstrom R G, McGranahan G H, et al. 1992. Origin of walnut somatic embryos determined by RFLP and isozyme analysis. Hort Sci, 27(1): 61-63. DOI:10.21273/HORTSCI.27.1.61 |
Boltivets V S, Piven N M. 1990. Induced embryogenesis in the tissue culture of walnut. Fizilogiyai Biokhimiya Kulturnykh Rastenii, 22(4): 409-413. |
Boucad M T, Brison M, Negrier P. 1994. Cryopreservation of walnut somatic embryo. Cryo-Letters, 15(3): 151-160. |
Corn D. Somatic embryogenesis in tissue culture of walnut (Juglans nigra, J. major and hybrids J. nigra × J. regia)In: Ahuja MR (ed.), Somatic Cell Genetics of Woody Plants. Kluwer Academic Publishers, Dordrecht 1988: 45~49
|
Corn D. 1989. Walnut somatic embryogenesis: physiological and histological aspects. Ann. Sci. For, 46(Suppl.): 133-135. |
Dandekar A M, Martin L A, McGranahan G H. 1988. Genetic transfomation and foreign gene expression in walnut tissue. J. Amer. Soc. Hort. Sci, 113(6): 945-949. |
Dandekar A M, McGranahan G H, Leslie C A, et al. 1989. Agrobacterium-mediated transformation of somatic embryos as a method for the production of transgenic plants. J. Tissue Culture Methods, 12(4): 145-150. DOI:10.1007/BF01404441 |
Dandekar A M, McGranahan G H, Vail P V, et al. 1994. Low levels of expression of wild type Bacillus thuringiensis var kurstaki cry IA(c)sequences in transgenic walnut somatic embryos. Plant Sci, 96(2): 151-162. |
Dandekar A M, McGranahan G H, Vail P V, et al. 1998. High levels of expression of full-length cry IA(c)gene from Bacillus thuringiensis in transgenic walnut somatic emb ryos. Plan t Sci, 131(2): 181-193. DOI:10.1016/S0168-9452(97)00256-2 |
Deng M D, Corn D. 1992. M aturation and germination of walnut somatic embryos. Plant Cell Tiss. and Org. Cult, 28(2): 195-202. DOI:10.1007/BF00055517 |
Eluch C, Jay-Allemand C, Pastuglia M, et al. 1996. M odification delexpression du metabolisme phenolique chezle Noyer et reactivite in vitro. Acta Bot. Gallica, 143(6): 547-553. DOI:10.1080/12538078.1996.10515352 |
Eluch C, Jay-Allemand C, Pastuglia M, et al. 1998. Expression of antisense chalcone synthase RNA in transgenic hybrid walnut microcutting-effect on flavonoid content and rooting ability. Plant Mol. Bio, 38(3): 467-479. DOI:10.1023/A:1006034709501 |
Jay-Allemand C, Jouanin L, Deng M D, et al. 1991. Transfer of chalcone synthase antisense gene: new strategy for studying polyphenols involved in walnut rhizogenesis. Plant Sci. Today, 59: 305. |
Kornova K, Stephanova A, Terzijsky D. 1993. In vitro culture of immature embryos and cotyledons of Juglans regia L: morphological and anatomical analyses of some regenerants. Acta Hort, 311: 125-133. |
Lee B C, Shim S Y, Lee S K. 1988. Mass propagation and germination of somatic embryos in Juglans regia L. (English walnut). Res. Rep. Inst. For Gen Korea, 24: 99-106. |
Long L M, Preece J E, Van Sambeek J W. 1995. Adventitious regeneration of Juglans nigra L. (Eastern black walnut). Plant Cell Rept, 14(12): 799-803. DOI:10.1007/BF00232926 |
Long L M, Preece J E, Gaffney G R, et al. 1992. Somatic embryogenesis and organogenesis of Eastern black walnut(Juglans nigra). Hort. Sci, 27(2): 107. DOI:10.21273/HORTSCI.27.2.107 |
McGranahan G H, Driver J A and Tulecke W. Tissue culture of Juglans. In: Bonga J M and Durzan D H. (eds.), Cell and Tissue Culture In Forestry 3, Martinus Nijhoff, Boston, 1987, 261~272
|
McGranahan G H, Leslie C A, Uratsu S L, et al. 1988. Agrobacterium-mediated transformation of walnut somatic embryos and regeneration of transgenic plants. Bio/Technol, 6: 800-804. |
McGranahan G H, Leslie C A, Uratsu S L, et al. 1990. Improved efficiency of the walnut somatic embryo gene transfer system. Plant Cell Rept, 8(8): 512-516. |
McGranahan G H, Tulecke W, Arulsekar S, et al. 1986. Intergeneric hybridization in the Juglandaceae: Pterocerya sp. × Juglans regia. J. Amer. S oc. Hort. S ci, 111(4): 627-630. |
Neuman M C, Preece J E, Van Sambeek J W, et al. 1993. Somatic embryogenesis and callus production from cotyledon explants of Eastern black walnut (Juglans nigra L.). Plant Cell Tiss. and Org. Cult, 32(1): 9-18. DOI:10.1007/BF00040110 |
Oliveira M M. 1996. MiguelC M, Raquel M H. Transformation studies in woody fruit species. Plant Tissue Culture and Biotechnology, 2(2): 76-93. |
Pijut P M. 1993. Somatic embryogenesis in butternut, Juglans cinerea. Canadium J. of Forest Research, 23(5): 835-838. DOI:10.1139/x93-108 |
Polito V S, McGranahan G H, Pinney K, et al. 1989. Origin of somatic emb ryos from repetitively embryogenic cultures of walnut (Juglans regia L.): implications for Agrobacterium-mediated transfomation. Plant Cell Rept, 8(3): 219-221. |
Tulecke W, McGranahan G H. 1985. Somatic embryogenesis and plant regeneration from cotyledons of walnut, Jug lans regi a L. Plant Sci, 40(1): 57-63. DOI:10.1016/0168-9452(85)90163-3 |
Tulecke W, McGranahan G H, Leslie C A. 1995. Somatic embryogenesis in walnut (Juglans species). Biotechnology in Agriculture and Forestry, 30: 370-377. |
Tulecke W, McGranahan G H, Ahmadi H. 1988. Regeneration by somatic embryogenesis of triploid plants from endosperm of walnut, Juglans regia L. cv Manregian. Plant Cell Rept, 7(4): 301-304. |
University of Califonia. Intergrated pest management for walnut, Division of Agriculture and Natural Resources Publication, 1987(2nd ed): 3270
|
Vail P V, Tebbets J S, Hoffmann D F, et al. 1991. Response of production and postharvest pests to Bacillus thuringienesis insecticidal crystal protein fragment. Biol. Control, 1(4): 329-333. DOI:10.1016/1049-9644(91)90086-F |
 2000, Vol. 36
2000, Vol. 36