文章信息
- 周珊, 周汇, 单胜道.
- Zhou Shan, Zhou Hui, Shan Shengdao
- 竹炭固定化微生物去除水样中氨氮的研究
- Removal of Ammonia Nitrogen in Aqueous Samples by Bamboo-Carbon Immobilized Microorganism
- 林业科学, 2009, 45(6): 133-138.
- Scientia Silvae Sinicae, 2009, 45(6): 133-138.
-
文章历史
- 收稿日期:2008-12-01
-
作者相关文章
冶炼、化肥生产、畜禽养殖等工农业生产过程中产生大量氨氮废水。氨氮废水是造成水体富营养化的主要因素。缺氧/好氧、间歇式活性污泥法、氧化沟等生物处理工艺在氨氮废水的治理中得以广泛应用,但存在水力停留时间较长、耐冲击负荷性较差、剩余污泥量大等缺点(王洪等,2008)。固定化微生物作为一种新兴生物处理技术,是将微生物固定在载体上使其高度密集并保持其生物活性,该技术具有反应效率高、稳定性强、污泥量少等优点。近年来,固定化微生物技术在养殖废水、垃圾渗滤液、含酚废水、印染废水、重金属废水等废水的处理中得以研究和应用(王里奥等,2004)。微生物固定的载体材料应具有物理和化学稳定性好、无毒性或抑制性、物理性状(包括形态、孔隙率、相对密度等)优越、廉价易得等特性。目前,微生物固定化的常用载体有活性炭、多孔玻璃、石英砂、硅藻土、沸石等无机材料,以及琼脂、海藻酸钙(钠)、PVA凝胶、ACAM凝胶、硅胶等有机材料(王里奥等,2004)。微生物固定化过程及固定化微生物在废水处理实际应用效果的好坏,与所利用的载体材料特性有密切的联系。同时,固定化载体的成本是固定化微生物技术经济可行的关键。
竹材作为一种多孔介质材料、孔隙率高、比表面积大、吸附性好、物理化学性能稳定,且价廉易得(张齐生,2001),具备微生物固定化载体材料应具有的性能特点,可用作微生物固定化载体。本试验以竹炭为载体,采用载体结合法将微生物菌吸附固定在竹炭上,用竹炭固定化微生物处理模拟氨氮水样。考察初始氨氮质量浓度、固定化微生物量、溶解氧、pH等因素对竹炭固定化微生物处理氨氮的影响,研究竹炭固定化微生物去除氨氮的反应动力学,进行竹炭吸附法和竹炭固定化微生物处理氨氮的对比试验,以期为以竹炭为载体固定化微生物技术的研究及应用奠定一定基础。而目前,有关以竹炭为载体的固定化微生物处理技术的研究鲜有报道。
1 材料与方法 1.1 试验设备及试剂主要试验设备:752型紫外可见分光光度计(上海光谱仪器有限公司),AR2140电子分析天平(梅特勒-托利多仪器上海有限公司),DGG-9070B型电热恒温鼓风干燥箱(国华电器有限公司),THZ-82恒温振荡器(上海博迅实业有限公司),PHS-3C型数字式酸度计(上海科学仪器厂),生物反应器(自制)。
主要试剂:氯化钙,硫酸亚铁,硫酸镁,氢氧化钠,氯化铵,硫酸铵,磷酸氢钾,氯化钠,酒石酸钾钠,碘化钾,碘化汞,氢氧化钾等。上述试剂均为分析纯,由上海化学试剂厂提供。
竹炭由浙江临安姚氏炭业有限公司提供。利蒙LLMO N-1菌剂由美国通用环保科技公司及安信达环保科技有限公司合作生产。
1.2 检测方法氨氮测定:纳氏试剂比色法(奚旦立等,2004);NO2--N测定:气相分子吸收光谱法(奚旦立等,2004);NO3--N测定:气相分子吸收光谱法(奚旦立等,2004);pH测定:PHS-3C型数字式酸度计;菌量测定:活菌计数法(张胜华等,2005)。
1.3 菌种驯化试验采用美国通用环保科技公司及安信达环保科技有限公司合作生产的利蒙LLMO N-1微生物菌剂,其主要包含硝化菌和反硝化菌等菌种,该菌剂适用温度为25℃左右。室温(25±1) ℃下,将200 mL菌剂投入加有2 L培养基(表 1)的5 L烧杯中,向烧杯中连续曝气,控制曝气量0.1 m3·h-1左右,对其进行培养。7天后当烧杯中培养液变浑浊且池底部及壁部出现棕黄色附着物,就说明微生物开始生长,此时就可逐渐投加氨氮对其进行驯化。第一次氨氮的投加量为50 mg·L-1,以下几次根据实际情况慢慢增加,直到氨氮质量浓度为400 mg·L-1为止,加料频率以每次3天为好。
|
|
试验所用竹炭为最终炭化温度700℃下烧制而成,具有高孔隙度和比表面积,孔隙包括大孔隙、中孔和微孔,其比表面积为365 m2·g-1,孔比容积为0.34 mL·g-1。周珊等(2008)、周建斌等(2008)研究结果表明,竹炭较大的比表面积和丰富的空隙结构可以为不同微生物提供较为适宜的场所,微生物可以在竹炭表面以及内部孔隙中附着生长,构建一个人工微生物生态系统。
将粒径约5 mm的竹炭用蒸馏水洗净、灭菌后烘干。室温(25±1) ℃下,取1 kg竹炭加入到装有6 L经氨氮驯化后微生物悬液(含水率93.6%,菌计数浓度3.3×1010cfu·L-1)的反应器中,向反应器中连续曝气,曝气量控制在0.1 m3·h-1左右,依靠竹炭对微生物的强吸附性进行固定化反应,10天后,滤出竹炭固定化微生物菌,备用。
取25 g所制备的竹炭固定化微生物,将固载了微生物的竹炭粒压碎,置于灭菌烧杯中,加少量蒸馏水和灭菌玻璃珠,摇荡10 min,使竹炭上的生物膜脱落在水中,做成菌液。然后,取出玻璃珠,用无菌大孔滤纸滤去竹炭,竹炭烘干后称重。将滤液再置于烧杯中加玻璃珠摇荡5 min后,测其菌量。检测结果表明,25 g竹炭固定化微生物中竹炭质量24.4 g,竹炭上的菌量为3.1×108 cfu·g-1。
1.5 废水处理试验称取一定量经100℃干燥过的分析纯氯化铵溶于蒸馏水中,移入1 L容量瓶中,稀释至标线,配置一定质量浓度的模拟氨氮水样。室温(25±1) ℃下,将150 mL不同质量浓度模拟氨氮水样和一定量竹炭固定化微生物加入到容积为500 mL的自制反应器中进行试验,向反应器中连续曝气,控制适宜的曝气量。检测不同水力停留时间下出水残余氨氮质量浓度。
2 结果与分析 2.1 水样中初始氨氮质量浓度的影响竹炭固定化微生物处理初始氨氮质量浓度分别为50,100,200,300,400和500 mg·L-1的水样,考察各质量浓度氨氮的去除情况(图 1)。竹炭固定化微生物投加量均为25 g,水力停留时间均为48 h,调节水样pH为8,通过曝气控制水样中溶解氧为1 mg·L-1左右。
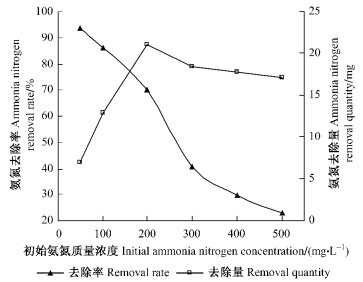
|
图 1 不同初始氨氮质量浓度水样的氨氮去除率和去除量 Figure 1 Removal rate and removal quantity of ammonia nitrogen for aqueous samples with different initial ammonia nitrogen concentration |
从图 1可知,氨氮去除率随着氨氮质量浓度的增加而减小。初始氨氮质量浓度小于200 mg·L-1时,氨氮去除量随质量浓度增大而增加。初始氨氮质量浓度大于200 mg·L-1后,氨氮去除量随质量浓度增大而下降。初始氨氮质量浓度为200 mg·L-1时,氨氮去除量最大。结果表明,竹炭固定化微生物适于处理初始氨氮质量浓度≤200 mg·L-1的水样。微生物脱氮遵循硝化-反硝化原理,即亚硝化菌将NH4+转化为NO2-,硝化菌将NO2-转化为NO3-,反硝化菌将NO3-还原为氮气。初始氨氮质量浓度增大,水样中游离氨质量浓度增加,当游离氨超过一定质量浓度时会对硝化菌产生抑制作用,导致NO2-积累,NO2-对微生物有较强毒性,使微生物活性降低,从而导致对氨氮去除能力的下降(Sarap et al., 2002)。
2.2 竹炭固定化微生物投加量的影响向初始氨氮质量浓度为50和200 mg·L-1水样中分别添加不同量的竹炭固定化微生物,考察竹炭固定化微生物投加量对氨氮去除的影响(图 2,3)。水力停留时间均为48 h,调节水样pH为8,通过曝气控制水样中溶解氧为1 mg·L-1左右。

|
图 2 竹炭固定化微生物投加量对不同初始氨氮质量浓度水样氨氮去除率的影响 Figure 2 Effect of amount of bamboo-carbon immobilized biomass on ammonia nitrogenremoval rate for aqueous samples with different initial ammonia nitrogen concentration —▲— 50 mg·L-1, mg·L-1, 下同The same below. mg·L-1, 下同The same below. |

|
图 3 竹炭固定化微生物投加量对不同初始氨氮质量浓度水样氨氮去除量的影响 Figure 3 Effect of amount of bamboo-carbon immobilized biomass on ammonia nitrogen removal quantity for aqueous samples with different initial ammonia nitrogen concentration |
氨氮去除率和去除量均随着竹炭固定化微生物投加量的增加而趋于增大,但竹炭固定化微生物投加量增加到一定值时,氨氮去除率和去除量增幅趋缓(图 2,3)。对于初始氨氮质量浓度50 mg·L-1水样,当固定化微生物量增加至20 g后,氨氮去除率和去除量的增幅均开始趋缓;对于初始氨氮质量浓度200 mg·L-1水样,当固定化微生物量增加至25 g后,氨氮去除率和去除量的增幅均开始趋缓(图 2,3)。这可能是由于亚硝化菌是以NH4+为养源的自养菌,当微生物量增加到一定程度时,繁殖菌体浓度相对于水样中基质浓度过高,菌体营养状态较微生物量少时差,细胞活性相对微生物量少时有所下降。但另一方面,由于微生物总量的增加,对氨氮的总体去除能力是增加的。因而出现氨氮去除率和去除量随投菌量增加到一定量而增幅趋缓现象。
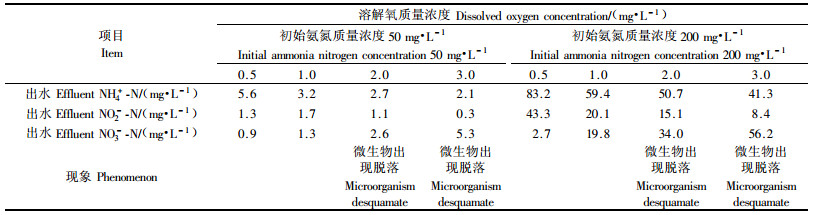
2.3 溶解氧的影响分别向反应器中曝入不同的空气量,将反应水样中溶解氧控制在不同质量浓度,考察溶解氧对竹炭固定化微生物处理氨氮的影响(表 2)。竹炭固定化微生物添加量均为25 g,水力停留时间均为48 h,调节水样pH为8。
|
|
从表 2试验结果可知,溶解氧质量浓度是影响氨氮去除率的一个非常重要的因素,出水氨氮量随溶解氧质量浓度增大而降低,但出水总氮量在溶解氧质量浓度为1 mg·L-1左右时最低(表 2)。这说明水样中溶解氧需控制在适宜质量浓度,竹炭固定化微生物才能产生最佳的脱氮效果。溶解氧质量浓度太低,会出现对亚硝化菌、硝化菌等好氧菌的供氧不足,直接影响硝化作用,从而降低氨氮的去除能力。溶解氧质量浓度过高,氧的穿透能力较强,在竹炭内部形成的缺氧区较小,反硝化菌活性不强并出现脱落。虽然大量的氨氮被氧化为亚硝酸盐氮和硝酸盐氮,但将硝酸盐氮转化为氮气的反硝化能力较低,导致出水硝酸盐氮含量高,总氮量增大。
当溶解氧质量浓度控制在1 mg·L-1左右时,出水氨氮、NO2--N、NO3--N浓度较低,且无微生物脱落现象(表 2)。这表明通过合理控制溶解氧质量浓度,可使硝化菌和反硝化菌等不同功能菌共同固定在竹炭载体上,并均保持较高活性,在竹炭固定化微生物系统中发生同时硝化-反硝化作用。
2.4 水样pH的影响调节水样至不同pH值,考察水样pH对竹炭固定化微生物处理氨氮的影响。竹炭固定化微生物添加量均为25 g,水力停留时间均为48 h,通过曝气控制水样中溶解氧质量浓度为1 mg·L-1左右。氨氮去除率随水样pH的变化见图 4。
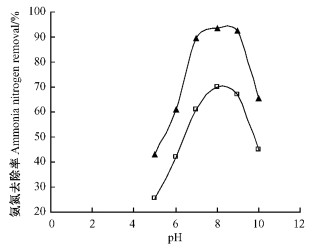
|
图 4 pH值对不同初始氨氮质量浓度水样氨氮去除率的影响 Figure 4 Effect of pH on ammonia nitrogen removal rate for aqueous samples with different initial ammonia nitrogen concentration |
氨氮去除率先随着pH的增加而上升,当pH为8时,初始氨氮质量浓度为50和200 mg·L-1水样的氨氮去除率分别为93.6%和70.2%,当pH大于8时,氨氮去除率又随着pH的增加而迅速下降,到pH为10时分别下降为65.7%和45.2%(图 4)。由此可以看出:本试验所用的菌种对pH比较敏感,适应范围较窄,偏碱性环境利于氨氮的去除。这是由于硝化反应分氨氧化和亚硝酸盐氧化两步进行,氨氧化是在氨单加氧酶(AMO)和羟胺氧化还原酶(HAO)的共同作用下完成(Lisa et al., 1997; Vilaverde et al., 1997)。水样中游离氨可以作为氨氧化细菌即亚硝化菌的基质,增大pH可导致水样中游离氨浓度增大,在一定浓度范围内,游离氨浓度的增加对AMO活性有促进作用(Sarah et al., 2002)。但当游离氨浓度随pH增大而增加到一定浓度时又会对硝化菌产生抑制作用,导致NO2-积累,使微生物活性降低(Lisa et al., 1997; Vilaverde et al., 1997),对氨氮的去除能力下降。故水样pH为8左右的偏碱性条件,有利于硝化菌对氨氮的转化,但pH不宜过高。
2.5 反应动力学试验向反应器中添加25 g竹炭固定化微生物处理氨氮水样,水力停留时间均为48 h,调节水样pH为8,通过曝气控制水样中溶解氧浓度为1 mg·L-1左右。测定不同反应时间时水样中残余氨氮质量浓度C,氨氮水样lnC-t曲线如图 5所示。

|
图 5 不同初始氨氮质量浓度水样的lnC-t曲线 Figure 5 The curve of lnC-t for aqueous samples with different initial ammonia nitrogen concentration |
对图 5所得试验数据进行线性回归分析,初始氨氮质量浓度50 mg·L-1动力学方程为:0~48 h:lnC=3.921 8-0.059 5t,r= 0.995 1,去除速率常数k为0.059 5;48~72 h:lnC=1.468 8-0.006 9 t,r=0.985 6,去除速率常数k为0.006 9。初始氨氮质量浓度200 mg·L-1动力学方程为:0~48 h:lnC=5.327 2-0.024 7t,r=0.995 8,去除速率常数k为0.024 7;48~72 h:lnC=4.744 2-0.013 2t,r=0.971 9,去除速率常数k为0.013 2。分析结果表明,竹炭固定化微生物对氨氮的去除可分为2个阶段,48 h后的氨氮去除速率小于48 h前的氨氮去除速率。回归分析结果同时表明,一级反应动力学模型能较好描述竹炭固定化微生物对氨氮的去除,说明本试验范围内,竹炭固定化微生物可保持较高的活性。
2.6 与竹炭吸附的对比试验室温(25±1) ℃下,分别取24.4 g粒径为5 mm竹炭和25 g竹炭固定化微生物处理初始氨氮质量浓度200 mg·L-1水样,处理量均为150 mL,水样pH值均调节至8。竹炭固定化微生物处理氨氮水样时,向反应器中连续曝气,控制水样中溶解氧浓度为1 mg·L-1左右。
试验结果表明,竹炭对氨氮具有一定的吸附作用,但吸附量较低。竹炭吸附处理氨氮水样2 h后即达到吸附平衡,平衡时,氨氮去除率为34.6%,竹炭对氨氮的吸附量为10.4 mg。
竹炭固定化微生物处理氨氮水样48 h时,氨氮去除率为70.2%,氨氮去除量为21.1 mg。25 g竹炭固定化微生物可连续处理6组150 mL初始氨氮质量浓度200 mg·L-1的水样,每组水力停留时间为48 h,平均氨氮去除率为70.0%,累计氨氮去除量为126.0 mg。竹炭固定化微生物处理氨氮水样不需污泥回流,出水悬浮物含量低,水样颜色接近无色,克服了悬浮微生物法需污泥回流,出水混浊,污泥量大的缺陷。
结果表明,竹炭固定化微生物对氨氮的去除能力远远大于竹炭吸附,单独通过竹炭吸附作用难以对氨氮进行有效去除。由试验结果可以推断,竹炭固定化微生物处理氨氮水样存在竹炭吸附和微生物脱氮2种作用。竹炭表面将水样中氨氮大量吸附,也将水样中溶解氧富集于竹炭表面(Scholz et al., 1997),为固定在竹炭上的微生物提供了有利反应条件,亚硝化菌、硝化菌将氨氮转化为硝酸盐氮,固定在竹炭孔隙中的反硝化菌将硝酸盐氮转化为氮气。竹炭表面吸附质的去除使吸附位再次打开,供水样中残留氨氮占用,被吸附氨氮被微生物继续降解,以此在竹炭吸附、亚硝化菌、硝化菌和反硝化菌的协同作用下进行脱氮,吸附作用和生物降解作用的有机结合,导致竹炭固定化微生物相对于单独竹炭吸附的处理效果的大幅提高,氨氮去除量的显著增加。
3 结论本试验范围内,竹炭能将硝化菌和反硝化菌共同固定。初始氨氮质量浓度、竹炭固定化微生物投加量、溶解氧质量浓度、pH等因素均影响氨氮的去除效果。竹炭固定化微生物适于处理初始氨氮质量浓度≤200 mg·L-1的水样。随竹炭固定化微生物投加量增加,氨氮去除率和去除量均趋于增大,但投加量增加到一定量时,去除率和去除量增幅均趋缓。pH为8的偏碱性环境利于竹炭固定化微生物对氨氮的去除。控制水样溶解氧质量浓度为1 mg·L-1左右,固定化微生物系统中可发生同时硝化-反硝化作用,使氨氮有效去除,氨氮去除率可达70%以上。竹炭固定化微生物去除氨氮的过程符合一级反应动力学模型。
王洪, 李海波. 2008. 氨氮废水生物处理工艺及研究进展. 河南师范大学学报:自然科学版, 36(5): 97-100. |
王里奥, 崔志强, 钱宗琴, 等. 2004. 微生物固定化的发展及在废水处理中应用. 重庆大学学报, 27(3): 125-128. |
张齐生. 2001. 重视竹材化学利用.开发竹炭应用技术. 竹子研究汇刊, 20(3): 34-35. DOI:10.3969/j.issn.1000-6567.2001.03.006 |
奚旦立, 孙裕生, 刘秀英. 2004. 环境监测. 北京: 高等教育出版社.
|
张胜华, 郭一飞, 勒慧霞, 等. 2005. 水处理微生物学. 北京: 化学工业出版社.
|
周珊, 胡泽友, 喻景权. 2008. 竹炭固定化假单胞菌处理含酚废水的研究. 高校化学工程学报, 22(5): 889-894. DOI:10.3321/j.issn:1003-9015.2008.05.029 |
周建斌, 叶汉玲, 张合玲, 等. 2008. 生物改性竹炭制备工艺及其应用的研究. 水处理技术, 134(10): 38-41. |
Lisa Y S, Daniel J A, Michael R H. 1997. Regulation of the synthesis and activity of ammonia monooxygenase in nitrosomonas europaea by altering pH to affect NH3 availability. Appl Environ Microbiol, 63(11): 4588-4592. |
Sarah P, Hendrikus J L, Willy V. 2002. Origins, causes and effects of increased nitrite concentration in aquatic environments. Rev of Environ Sci & Biotechnol, (1): 115-141. |
Scholz M, Martin R J. 1997. Ecological equilibrium on biological activated carbon. Water Science and Technology, 31(12): 2959-2968. |
Vilaverde S, Garcia-Encina P A, Fdz-Polanco F. 1997. Influence of pH over nitrifying biofilm activity in submerged boilers. Water Research, 31(5): 1180-1186. DOI:10.1016/S0043-1354(96)00376-4 |
 2009, Vol. 45
2009, Vol. 45