文章信息
- 任建军, 师光禄, 王建文, 谷继成, 王有年.
- Ren Jianjun, Shi Guanglu, Wang Jianwen, Gu Jicheng, Wang Younian
- 薄荷中杀螨活性物质的分离与鉴定
- Isolation and Identification of the Principal Acaricidal Components Extracted from Mentha piperita
- 林业科学, 2009, 45(6): 77-82.
- Scientia Silvae Sinicae, 2009, 45(6): 77-82.
-
文章历史
- 收稿日期:2008-04-02
-
作者相关文章
2. 北京市农业应用新技术重点实验室 北京 102206;
3. 北京农学院生物技术系 北京 102206
2. Key Laboratory of New Technology of Agricultural Application of Beijng Beijng 102206;
3. Department of Biotechnology in Beijing University of Agriculture Beijing 102206
朱砂叶螨(Tetranychus cinnabarinus)是我国分布最广、发生最为严重的一种农林害螨,其个体小、繁殖快、年发生代数多、适应性强,危害十分严重,是很难防治的有害生物类群之一(张弘等,2003;何林等,2004)。目前,这种害螨的控制主要依靠化学药剂,如喷施有机磷类和菊酯类农药等(Kim et al., 2003)。这种药剂的长期使用不但导致了螨类的抗药性(Wilkin,1979;Stables,1984),而且对非靶标生物也产生了不利影响(Hays et al., 1991)。植物源农药具有广谱性、作用机理独特、对天敌干扰少、对脊椎动物无明显毒性、在环境中降解迅速、资源丰富、可再生等优点,是防治害螨的理想选择。并且杀螨活性物质广泛存在于自然界的多种植物中,完全可以利用植物次生物质所表现出来的综合优势,来弥补目前现有杀螨剂存在的众多缺陷。因此从植物源天然产物出发来寻找结构物质,成为新型杀螨剂研发的热点之一(罗万春,1997)。Mansour等(1986)曾报道唇形科14个种的提取物对朱砂叶螨有毒性;Grange等(1988)报道约有2 400种植物具有控制有害生物的活性,其中具杀螨活性的有40余种;Pamo等(2004)发现广藿香(Ageratum houstonianum)花朵提取物对螨虫有毒杀作用;Chiasson等(2001)分别用微波提取、水蒸馏、汽蒸馏3种方法从苦艾(Artemisia absinthium)中提取粗提物,用二斑叶螨(T. urticae)做毒性试验,发现β-侧柏酮为杀螨主要物质;Wang等(2007)用不同方法提取核桃(Juglans regia)青皮活性物质,发现石油醚浸提物对朱砂叶螨有强烈的触杀效果;Tak等(2006)在牡丹(Paeonia suffruticosa)的根皮中发现了芍药醇和安息香酸,对二斑叶螨有较强的毒杀作用,LC50分别为5.29和4.80 mg·L-1,在密闭环境中效果更明显。Shi等(2006)用地肤(Kochia scoparia)的甲醇、氯仿、石油醚3种溶剂的粗提物对二斑叶螨进行毒性试验,发现氯仿的粗提物具有很高的致死率,可达78.86%。目前,有关薄荷(Mentha piperita)功效的研究很多,其地上部分的干燥产品性凉味辛,具有宣散风热、清头目、透疹之功效,用于治疗风热感冒、温病初起、头痛、目赤、喉痹、口疮、风疹、麻疹、胸胁胀闷等(郑汉臣等,2003),且对消化、中枢、生殖及呼吸系统等有明显的药理作用(梁呈元等,2003),但有关其作为一种对害螨有明显杀灭作用的植物目前尚未被人们发现与研究。本文对薄荷的杀螨活性进行了研究,并对其活性物质进行了初步分离、鉴定,以揭示其杀螨活性物质的天然构造,为新农药研制提供新的活性先导化合物,从而通过对其进一步模拟修饰,合成结构全新、机理独特、安全高效的农药新品种。
1 材料与方法 1.1 供试材料薄荷材料取自北京市昌平区七里渠。将其地上部位清洗干净后放于通风处阴干(25±3)℃,用粉碎机(北京环亚天元Pulverizer-6202)粉碎,粒度60目,冰箱(Electrolux BCD-281EA)中4 ℃条件下储藏备用。
供试虫为朱砂叶螨成虫,实验室内用豇豆(Vigna unguiculata)幼苗饲养2年,多代繁殖。饲养环境为温度(26±1)℃,相对湿度50%±10%,光照L:D=18 h:6 h(侯挥等,2004)。4周后,取饲养一致、活动力强的成虫供试。
1.2 方法 1.2.1 提取及分离植物粗提物提取:取粉碎的植物6 000 g平均分3份,分别用甲醇、氯仿、石油醚(分析纯:北京化工厂)浸泡3天后过滤,滤渣继续浸泡3天,重复3次。将浸提液合并后放于浓缩仪(Buchi Rotavapor R-220)中进行浓缩,计算提取率。取1mg浸膏加入0.05 mg吐温-80,用蒸馏水配制成1 mg·mL-1的乳液,进行杀螨生物活性测定。
将3种不同溶剂浸膏中杀螨效果最明显的部分进行液-液萃取,并通过生物活性测定跟踪活性成分。取有效浸膏8 g作为大柱上样样品。选用200~300目柱层析硅胶(青岛海洋生物试剂厂生产)进行分离纯化(Buchi,C-615)。条件:120 ℃活化,柱内直径100 mm,填料高度400 mm。以石油醚、氯仿、甲醇进行梯度洗脱,在一种洗脱体系下无流分产生,改换洗脱体系配比。流速10 mL·min-1,分步收集,每瓶50 mL。薄层检测(青岛海洋化工厂),110 ℃活化。碘缸中显色,合并相同组分,测定毒力。
紫外分析:氯仿溶解样品,用1.0 cm×1.0 cm比色皿,扫描范围200~1 100 nm,进行紫外图谱扫描(TU-1810,北京普析通用仪器有限责任公司)。HPLC样品的分析(Agilent 1200):流动相为甲醇:水溶液(70:30,V:V),流速1 mL·min-1,柱温25 ℃,进样浓度0.050 mg·mL-1,进样量10 μL,Eclipse XDB-C18柱(4.6 mm×150 mm,5 μm USA),二极管矩阵检测器(G1315B,DAD),波长范围为190~800 nm,采集时间50 min。
红外分析:分别取2.0 mg样品粉末与150.0 mg的KBr混合,在红外灯下研磨均匀,压片,将样品的KBr压片置于傅立叶变换红外光谱仪(Bruker TENSOR 27,德国)的测定窗口固定位置,按照设定的仪器条件,在4 000~400 cm-1波数范围内扫描。质谱分析:用气相色谱质谱联用仪(VARIAN 2200,USA)测定。
1.2.2 杀螨活性的测定处理时用双面胶剪成3 cm长贴在载玻片(江苏盐城市恒泰玻璃仪器厂)的一端,用零号毛笔(北京京华毛笔厂)蘸住活动力强的成螨,将其背部粘在胶带上,每片粘1行,30头左右。供试螨放置在温度(26±1)℃、相对湿度60%~80%的环境下,用体视镜(浙江舜宇光电有限公司SZM-45B3)200倍下检查并剔除死亡和不活泼的个体,记载活螨数。将粘有螨的玻片一端浸于已配好的药液中5 s,取出后迅速用吸水纸吸去多余的药液。然后在同样条件下培养,24 h后检查结果。用毛笔轻触其身体,以螨足不动者为死亡。试验重复3次。对照为1%吐温-80溶液(周玉顺等,2007)。
对朱砂叶螨卵的触杀毒力测定:采集新鲜的豇豆叶片,洗净晾干,在叶背划出一个约3 cm2的区域,将叶背朝上放置在垫一层湿棉花的培养皿(d=5 cm)中,区域两侧用湿棉花覆盖,使叶片紧贴棉花。用0号毛笔往区域内接15头5日龄的雌成螨,置养虫室中任其产卵12 h,移去成螨。用微型喷雾器将药液喷于叶背面。药液设置3~5个浓度,每处理设置3次重复,以1%吐温-80溶液为对照。叶片晾干后按照上述方法重新放入培养皿中,检查并记录所剩卵数。每日往培养皿中加水保湿,每24 h观察卵孵化情况1次。环境条件为温度26 ℃、相对湿度60%~80%,观察4天,当对照卵全部孵化,处理卵仍没有孵化视为死亡。
1.2.3 数据分析数据分析方法:对所得数据用Abbott公式进行校正(Abbott,1925)。对结果进行方差分析,并用Duncan方法比较各处理间的效果差异。线性回归按照机率值分析法求得。用DPS v3.01专业版完成试验数据的方差分析和Duncan's检验。
死亡率=死亡虫数/总虫数×100%;校正死亡率=(处理死亡虫数-对照死亡虫数)/(100%-对照死亡虫数)×100%。
2 结果与分析 2.1 薄荷不同提取液的杀螨活性试验表明薄荷的甲醇、氯仿和石油醚粗提物配制成浓度为1 mg·mL-1乳液时,对成螨24 h触杀率分别为28.51%,10.73%和87.05%;对卵96 h的触杀效果依次为38.91,16.11,93.16(表 1)。3种溶剂对成螨及卵的触杀效果差异显著(P<0.05)。从表 1可以看出,与甲醇和氯仿相比,石油醚粗提物对成螨和卵均有较高的毒杀作用,这可能由于石油醚提取物的极性较小,毒性物质更容易穿透螨表皮的蜡质层,渗透到体内产生作用之故。表 1结果表明,甲醇的提取率为82.73%,氯仿的提取率为14.96%,石油醚的提取率为2.31%。表明石油醚的提取率相对较小;此说明薄荷中极性较小的物质相对少,而极性较大的物质相对较多。
|
|
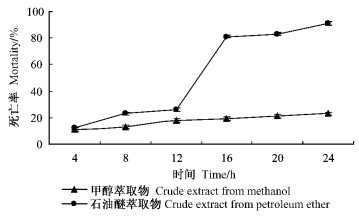
对石油醚粗提物用甲醇进行萃取,并跟踪2种萃取物的杀螨活性,每隔4 h进行观察的结果如图 1所示:石油醚萃取物的杀螨活性明显高于甲醇萃取物。处理后12~16 h是石油醚萃取物对螨虫作用的高峰期,螨虫死亡率增加明显。24 h后,石油醚萃取物对成螨的触杀率达到90%以上,甲醇萃取物则不足40%。
|
图 1 不同萃取物对成螨24 h的触杀效果 Figure 1 Contact toxicity against T. cinnabarinus of different partitions |
从表 2看出,最终分离出的8种组分中,组份Ⅴ的杀螨活性最高,24 h的LC50值为0.546 4%,其95%置信区间为(0.326 8~0.913 4)mg·mL-1;组分Ⅰ次之,24 h内的LC50值为0.871 8 mg·mL-1,95%置信区间为(0.472 7~1.607 7)mg·mL-1。组分Ⅱ、Ⅲ、Ⅳ、Ⅵ的杀螨的LC50值分别为1.268 1,1.745 3,1.889 9,1.814 9 mg·mL-1。表 2结果表明:在分离出的8个组份中,组份Ⅷ的杀螨效果最差,其LC50为12.505 mg·mL-1,置信区间为8.439 3~18.529 3 mg·mL-1。可见薄荷中的杀螨活性物质主要存在于氯仿的洗脱体系中。石油醚洗脱体系段的流分Ⅰ也显示出较好效果,初步推断薄荷中存在2种杀螨活性成分,而流分Ⅰ则在触杀过程中起协同作用。组分Ⅴ的活性相对于石油醚粗提物而言有明显提高;表明组份Ⅴ对朱砂叶螨具有较好的触杀活性。生测结果进一步证实薄荷中的杀螨活性物质主要存在于茎叶的石油醚提取物中,该提取物可能含有2种不同的高效杀螨性物质。
|
|
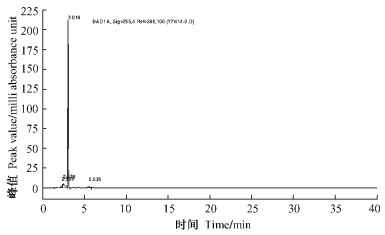
对杀螨效果最好的组分Ⅴ采用HPLC的方法进行纯度检测,发现HPLC图中,波长255 nm紫外吸光条件下,在2~6 min区域,有4个吸收峰,各峰峰高以及积分面积百分比如下:1号峰(RT=2.303 min) 1.346 7%,峰高2.1817 1 mAU;2号峰(RT=2.470) 8.445 4%,峰高4.948 27 mAU;3号峰(RT=3.019) 89.162 1%,峰高213.515 98 mAU;4号峰(RT=5.535) 1.045 7%,峰高1.225 08 mAU。可见3号主峰面积积分比最大,达到90%左右,该样品已具很高的纯度。1,2,4号小峰可能为流分Ⅴ的上、下2个洗脱体系的产物,这可能是与活性成分极性相似的一类物质。
|
图 2 薄荷提取物流分Ⅴ的高压液相图谱 Figure 2 HTLC analysis of the fifth fraction of M. piperita extract |
如图 3所示,MS(EI-MS)m/z=414(M+),即检测到组分Ⅴ的分子离子峰为414,说明这个分子的分子量为414,对照质谱数据库发现该物质含有甾醇环状结构。
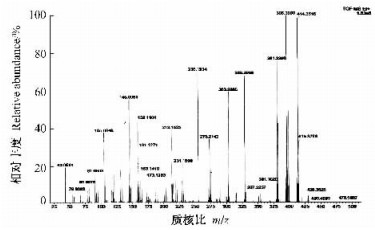
|
图 3 薄荷提取物流分Ⅴ的MS图谱 Figure 3 MS analysis of the fifth fraction of M.piperita extract |
为进一步确定该物质的特性,对其进行了红外检测,由红外光谱图(图 4)可见,光谱显示出几个特征峰,这几个峰代表几个重要官能团。3 440 cm-1处的宽峰为该化合物的O-H伸缩振动(νO-H),同时1 160 cm-1的峰归属于环状烃基叔醇或者仲醇的C-O键伸缩振动(νC-O)。3 000~2 700 cm-1为饱和的C-H伸缩振动频率区,一般是甲基和亚甲基的伸缩振动(νC-H)。与之对应的在1 450 cm-1(δas)是甲基的不对称变形振动,1 380 cm-1(δs)是甲基的对称变形振动。1 700 cm-1为碳碳双键伸缩振动(νC=C)。经过文献查阅及MS和IR谱图对照,初步确定该物质为β-谷甾醇。
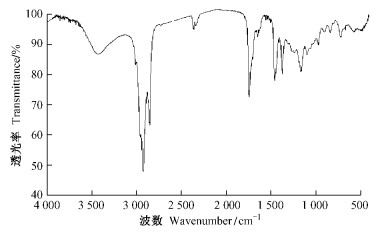
|
图 4 薄荷提取物流分Ⅴ的红外图谱 Figure 4 IR analysis of the fifth fraction of the M. piperita extract |
研究表明薄荷主要成分包括挥发性油、黄酮类、有机酸、氨基酸等有机物。鲜茎、叶含挥发油约1%,干茎、叶约含1.3%~2%。挥发油中含左旋薄荷脑约77%~87%、L-薄荷酮8%~12%及醋酸薄荷酯约3%(Mucciarelli et al., 2007)。薄荷油作为外用和内用药应用已经有很长的历史,在食品香料及糖果上也广泛使用(Grigoleit et al., 2005)。薄荷油中关于薄荷酮类或薄荷醇类物质对真菌、病毒的抑制作用和毒性研究比较多。Edris等(2003)等发现薄荷油、薄荷醇分别与核盘菌、匍茎根霉菌、毛霉菌共处于一个封闭系统中,对这些真菌的生长和繁殖有一定抑制作用。Schuhmacher等(2003)发现薄荷油对单纯疱疹病毒的2种亚型(HSV21和HSV22)均显示较强的抑制作用。在肝毒性方面,对薄荷油的毒性机制研究较多,认为薄荷油中所含的右旋胡薄荷酮可能是导致啮齿类动物肝中毒的主要成分,而左旋胡薄荷酮则无此效果(Clanahan et al., 1989;Moorthy et al., 1989;Thomassen et al., 1992;Engel,2003)。胡薄荷酮在肝脏中还可氧化为其他产物,从而参与肝损伤(Madyastha et al., 1993)。可见,薄荷的抑菌和毒性物质大多存在于薄荷油中;本试验在提取分离过程中也发现杀螨活性物质主要存在于极性很弱的石油醚中。关于薄荷对其他害虫的毒杀或趋避作用的研究也有一些报道,姚康1)利用2%的薄荷叶干粉处理小麦时发现,96 h后米象成虫的死亡率达到了100%,显示出强烈的毒杀效果。Raja等(2001)和Ahmed等(1986)发现薄荷精油对豆象有很强的熏杀作用。有报道,1,8-桉叶油素是薄荷油中的主要驱避活性成分(Masatoshi et al,1997)。然而前人研究都没能够对其触杀活性成分做进一步的探讨。本试验发现薄荷中存在的杀虫活性成分对朱砂叶螨有强烈毒杀作用,初步确定该物质是β-谷甾醇。这与曾建伟等(2006)在薄荷中发现β-谷甾醇存在的结论是一致的。王亚维等(2000)曾用其对菜粉蝶肠道酯酶进行过研究,发现β-谷甾醇对肠道酯酶有抑制作用,也证实了薄荷对昆虫的毒性。
1) 姚康. 1981.国外植物性谷物保护剂研究简介.第二次全国粮油储藏专业学术交流会文献选编,28-38.
本研究通过生测跟踪与有关分析,从薄荷中分离并初步鉴定出的杀螨活性物质为β-谷甾醇。该杀螨有效成份单体的获得,可为杀螨机理的研究及新农药的研制提供依据。
何林, 杨羽, 符建章. 2004. 朱砂叶螨阿维菌素抗性品系选育及适合度研究. 植物保护学报, 31(4): 395-400. DOI:10.3321/j.issn:0577-7518.2004.04.011 |
侯挥, 赵莉蔺. 2004. 地肤提取物杀螨活性的研究. 植物保护, 30(3): 42-45. DOI:10.3969/j.issn.0529-1542.2004.03.012 |
梁呈元, 李维林, 张涵庆. 2003. 薄荷化学成分及其药理作用研究进展. 中国野生植物资源, 22(3): 9-12. DOI:10.3969/j.issn.1006-9690.2003.03.003 |
罗万春. 1997. 植物源生物碱的杀虫作用. 农药, 36(7): 11-15. |
王亚维, 张国洲, 徐汉虹. 2000. β-谷甾醇等化合物对昆虫中肠酯酶活力的影响. 青海大学学报:自然科学版, 18(6): 1-2. |
曾建伟, 钱士辉, 吴锦忠. 2006. 薄荷非挥发性成分研究. 中国中药杂志, 31(5): 400-402. DOI:10.3321/j.issn:1001-5302.2006.05.014 |
张弘, 孟铃. 2003. 农用杀螨剂应用、开发现状及展望. 农药, 42(3): 14-17. DOI:10.3969/j.issn.1006-0413.2003.03.003 |
郑汉臣, 蔡少青. 2003. 药用植物学与生药学. 北京: 人民卫生出版社, 383.
|
周顺玉, 李庆, 杨群芳. 2007. 七叶一枝花与增效剂复配对柑桔全爪螨的毒杀作用. 安徽农业科学, 35(2): 458-459. DOI:10.3969/j.issn.0517-6611.2007.02.068 |
Abbott W S. 1925. A method for computing the effectiveness of an insecticide. Economic Entomology, 18: 265-267. |
Ahmed S M, Eapen M. 1986. Vapour toxicity and repellency of some essential oils to insect pests. Indian Perfumer, 30(1): 273-278. |
Chiasson H L N, Langer A B, Bostanian N. 2001. Acaricidal properties of Artemisia absinthium and Tanacetum vulgare(Asteraceae) essential oils obtained by three methods of extraction. Journal of Economic Entomology, 94(1): 167-171. DOI:10.1603/0022-0493-94.1.167 |
Clanahan R H, Thomassen D, Slattery J T. 1989. Metabolic activation of (R)2(+)2 pulegone to are activeen on althatcova 2 lentlybinds to mouse liver proteins. Chemical Research Toxicology, 2: 349-355. DOI:10.1021/tx00011a013 |
Edris A E, Farrag E S. 2003. Antifungal activity of peppermint an sweet basil essential oils and their majority constituents of some plant pathogenic fungi from the vaporphase. Nahrung, 47(2): 117-121. DOI:10.1002/food.200390021 |
Engel W. 2003. In vivo studies on the metabolism of the monoterpene pulegone in humans using the metabolism of ingestion correlated amounts(MICA) approach: explanation for the toxicity differences between (S)-(2)- and (R)2(+)-pulegone. Journal of Agriculture Food Chemical, 51(22): 6589-6597. DOI:10.1021/jf034702u |
Grange M, Ahmed S. 1988. Handbook of plants with pest control properties. Wiley-Interscience, 202-203.
|
Grigoleit H G, Grigoleit P. 2005. Pharmacology and preclinical pharmacokinetics of peppermint oil. Phytomedicine, 12: 612-616. DOI:10.1016/j.phymed.2004.10.007 |
Hays J B, Laws E R. 1991. Handbook of Pesticide Toxicology. San Diego: Academic Press, 496.
|
Kim E H, Kim H K, Choi D H, et al. 2003. Acaricidal activity of clove bud oil compounds against Tyrophagus putrescentiae (Acari: Acaridae). Applied Entomology Zool, 38(2): 261-266. DOI:10.1303/aez.2003.261 |
Madyastha K M, Raj C P. 1993. Studies on the metabolism of amonoterpeneketone, R2(+)2 pulegoneahepa to toxin in rat: isolation and characterization of new metabolites. Xenobiotica, 23: 509-518. DOI:10.3109/00498259309059391 |
Mansour F, Ravid U, Putievsky E. 1986. Studies on the effects of essential oils isolated from 14 species of Labiatae on the carmine spider mite Tetranychus cinnabarinus. Phytoparasitica, 14: 137-142. DOI:10.1007/BF02980899 |
Masatoshi H, Hiroaki K. 1997. Repellency of rosemary oil and its components against the onion, aphid Neotoxoptera formosana (Takahashi) (Homoptera: Aphididae). Applied Entomology Zoolology, 32(2): 303-310. DOI:10.1303/aez.32.303 |
Moorthy B, Madyastha P, Madyastha K M. 1989. Hepatotoxicity of pulegoneinrats: its effects on microsomalenzymes, in vivo. Toxicology, 55: 327-337. DOI:10.1016/0300-483X(89)90022-X |
Mucciarelli M, Camusso W, Maffei M, et al. 2007. Volatile terpenoids of endophyte-free and infected peppermint (Mentha piperita): Chemical partitioning of a symbiosis. Microbial Ecology, 54(4): 685-696. DOI:10.1007/s00248-007-9227-0 |
Pamo T E, Tendonkeng T. 2004. The acaricidal effect of the essential oil of Ageratum houstonianum Mill. flowers on ticks (Rhipicephalus lunulatus) in Cameroon South Africa. Journal of Animal Science, 34(Sup1): 244-247. |
Raja N, Albert S, Ignacimuthu S. 2001. Effect of plant volatile oils in protecting stored cowpea Vigna unguiculata (L.) Walpers against Callosobruchus maculates (F.) (Coleoptera: Bruchidae) infestation. Journal of Stored Products Research, 37: 127-132. DOI:10.1016/S0022-474X(00)00014-X |
Schuhmacher A, Reichling J, Schnitzler P. 2003. Virucidal effect of peppermint oil on the developed viruses herpess implex virus type and type in vitro. Phytomedicine, 10(6-7): 504-510. DOI:10.1078/094471103322331467 |
Shi G L, Zhao L L, Liu S Q. 2006. Acaricidal activities of extracts of Kochia scoparia against Tetranychus urticae, Tetranychus cinnabarinus, and Tetranychus viennensis (Acari: Tetranychidae). Journal of Economic Entomology, 99(3): 858-863. DOI:10.1093/jee/99.3.858 |
Stables L M. 1984. Effect of pesticides on three species of Tyrophagus, and detection of resistance to pirimiphosmethyl in T. palmarum and T. putrescentiae//Griffiths D A, Bowman C E. Acarology Ⅵ. Ellis Horwood Limited Chichester, England, 1026-1033.
|
Tak J H, Kim H K, Lee S H. 2006. Acaricidal activities of paeonol and benzoic acid from Paeonia suffruticosa root bark and monoterpenoids against Tyrophagus putrescentiae (Acari: Acaridae). Pest Management Science, 62(6): 551-557. DOI:10.1002/(ISSN)1526-4998 |
Thomassen D, Knebel N, Slattery J T. 1992. Reactive intermediates in the oxidation of menthofuranby cytochromes. Chemical Research Toxicology, 5: 123-130. DOI:10.1021/tx00025a021 |
Wang Y N, Shi G L. 2007. Acaricidal activity of Juglans regia leaf extracts on Teranychus viennensis and Tetranychus cinnabarinus(Acari: Tetranychidae). Journal of Economic Entomology, 100(4): 1298-1303. DOI:10.1093/jee/100.4.1298 |
Wilkin D R. 1979. The control of mites in cheese stores//Rodriguez J H. Recent Advances in Acarology. New York: Academic Press, 221-229.
|
 2009, Vol. 45
2009, Vol. 45