文章信息
- 刘华, 臧润国, 江晓珩, 丁易, 张炜银, 白志强, 郭仲军.
- Liu Hua, Zang Runguo, Jiang Xiaoheng, Ding Yi, Zhang Weiyin, Bai Zhiqiang, Guo Zhongjun
- 新疆额河流域两种野生杨树萌蘖苗叶片的气体交换特性
- Leave Gas Exchange Characteristics of Sprout Seedlings of Two Poplar Species in the Irtysh River Basin, Xinjiang
- 林业科学, 2009, 45(6): 45-53.
- Scientia Silvae Sinicae, 2009, 45(6): 45-53.
-
文章历史
- 收稿日期:2008-03-18
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 国家林业局森林生态与环境重点实验室 北京 100091;
3. 新疆林业科学研究院森林生态研究所 乌鲁木齐 830000
2. Key Laboratory of Forest Ecology and Environment, The State Forestry Administration Institute of Forest Ecology, Environment and Protection, Chinese Academy of Forestry Beijing 100091;
3. Institute of Forest Ecology, Xinjiang Academy of Forestry Urumqi 830000
气孔是植物气体交换的通道和枢纽,在CO2气体通过气孔进入植物的叶肉细胞进行光合作用的同时,植物蒸腾作用产生的H2O也通过气孔散失到大气中去。气孔导度大小可衡量植物气孔传导CO2和水汽能力的强弱,气孔的开闭常受到各种环境因子变化的调节(Buckley et al., 1999;Hiyama et al., 2005)。在自然条件下,干旱、盐碱和温度是影响植物(特别是作物)生长的三大主要的非生物胁迫因子( de Vries,2000)。其中,干旱胁迫给人类带来的危害与影响是最大的(温国胜等,2006)。加之由于全球变暖引起降雨量分布的波动与土壤水分的时空动态变化,使大多数植物都不同程度地受到干旱胁迫,增加了植物应对干旱的风险(Miyashita et al., 2005)。而植物收到干旱胁迫信号后,首先的反应就是关闭气孔,以保持体内水分的不丧失(Griffiths et al., 2002),但这一行为限制了其对CO2的吸收和光合作用过程(Wang et al., 2000;Flexas et al., 2004;2006;Reddy et al., 2004)。而气孔关闭程度又受胁迫强度及持续时间的影响。在这个过程中,随环境条件的变化植物自身会采取相应的适应对策。植物对环境的响应首先表现在其生理和生态学功能上,如光合作用类型、水分利用程度和生长发育的差异等,然后才表现出形态、结构和外貌上的差异。生长在干旱环境中的各种植物经过自然选择,形成了不同的耐旱生理生态适应对策(Larcher,1999;Grulke et al., 2002;Tardieu,2005)。对干旱影响植物生理生态过程的大部分研究主要是通过水分胁迫的控制试验,即人为控制水分条件下测定植物生理生态指标的变化机制(Garrity et al., 1984;French et al., 1991;Fernández et al., 1997;Ramesh et al., 2000;Casper et al., 2001;Araus et al.,2002;Chaves et al., 2002;Lopes et al., 2004;Suarez et al., 2004;Bray,2004;Staley et al.,2006;Robredo et al., 2007)。国内外有关杨树抗旱特性的研究也多在控制条件下进行,我国杨树研究工作多集中在华北和东北地区,在西北地区,特别是在自然条件下天然杨树应对自然干旱的生理生态研究还不多。
额尔齐斯河(简称额河)位于我国新疆北部阿勒泰地区,是我国唯一的北冰洋水系的河流。它源于阿尔泰山脉中段西南坡,全长4 248 km。中国境内的河长633 km,流域面积5.726万km2(李生宇等,2002)。该流域是我国杨柳科树木自然混交种类最多、集中程度最高、分布面积最大的区域,也是部分杨柳科树种唯一的天然分布和自然种源发源地,素有“杨树基因库”之称,具有极其重要的科学研究价值和潜在的生态经济价值。天然杨树作为额河流域自然生态系统的主体和林牧生态经济系统的关键种,决定着该系统的结构和功能。但是,自然环境的变化、人口增长、农牧业的快速发展和上游截流引水等都对河谷天然林造成非常大的压力,导致各杨树种群正在不断衰老乃至死亡,严重地影响了林分的更新和林牧业的可持续发展(臧润国等,2005)。位于准噶尔盆地北部边缘的额河流域,主要的自然胁迫因素是干旱、高温、强光,干旱引起植物叶肉组织水分亏缺,影响许多生理过程。加之2006年夏季是全国特别是西部区受干旱灾害威胁严重的季节,该流域北屯地区6—8月间的降水量不足40 mm,这明显对杨树的正常生长造成一定的压力。在该流域的多种天然杨树中,苦杨(Populus laurifolia)既分布于山地河谷,也分布于平原河谷,银白杨(P. alba)只分布于平原河谷,它们主要是通过根蘖萌生进行繁殖。苦杨在额河流域的分布幅度比银白杨广泛,它既可以分布在靠近河流的地段,又可以分布在离开河道较远洪水漫灌较少的地段,而银白杨则常常分布在离开河道较近洪水漫灌量较多的地段。从自然分布的范围及其生境来推断,无论是抗旱性还是耐水湿性苦杨应该都比银白杨强。植物叶片特征是反应抗旱性大小的指标之一,它对干旱的最初响应是调节气孔开度,关闭气孔以减少水分的散失。在自然条件下,额河流域天然杨树对自然干旱的适应机制还未见相关的报道。因此,本文选择苦杨和银白杨的天然根蘖苗为研究对象,分析其应对自然干旱的气孔响应特性,旨在为额河流域杨树的分布机理、天然林更新及种质资源保护和可持续发展提供一定的理论基础。
1 材料与方法 1.1 研究材料在额河流域北屯段北屯林场苗圃附近封育的平原河谷天然林分中,以自然萌蘖更新的苦杨和银白杨苗木作为研究对象。分别选择当年生、1年生和2年生苗各3株,并标记以进行连续测定。
1.2 气孔特性指标的测定于2006年主要生长季节(6—8月),每月按上、中、下旬各选择3个晴天,使用LI-6400便携式光合作用测定系统完成2种杨树的气体交换指标(由于受高温干旱的影响,8月份银白杨萌生苗的叶片全部自然干枯并脱落,故未测定其气体交换值)。以苗木中上部枝条顶端完全展开的第3~5片中的任意一完整功能叶片作为测定叶,在8:00—20:00时段内,按照“早-中-晚”的顺序采用“2 h-1 h-2 h”的时间间隔进行测定。其中,每一年龄的苗木测定3株作为重复,连续测定3天,结果取平均值。对所有测定叶片及叶室夹放位置做标记以备下月测定。测定的气体交换指标有净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)、胞间CO2浓度(Ci)以及光合有效辐射(PAR)、空气温度(Ta)、叶片温度(Tl)、大气CO2浓度(Ca)等环境因子。根据测定的气体交换指标计算叶片的水分利用效率(WUE)和气孔限制值(Ls) (Berry et al., 1982)。各项指标的统计分析在SPSS 11.0软件程序中进行。

|
选用土壤相对含水量的大小来衡量不同月份内天然林地杨树所受自然干旱胁迫的相对强度。采用挖剖面取土烘干法测定6—8月苦杨和银白杨林分内土壤水分含量。取样位置为各林分内树种之间的空地,测定深度为0~20 cm(杨树自然萌蘖苗的相对独立的根系及其从母树根部萌发的深度大多分布在此土壤深度范围内),同时做3个剖面作为重复,取样时间和气孔测定日期同步。取样时,用铝盒从20 cm处向上刮取适量的土壤,称其鲜质量(Wf),该土样在室内经过48 h,105 ℃的烘干后称其干质量(Wd),计算样地土壤的相对含水量(W)。
2 结果与分析 2.1 不同月份2种杨树遭受自然干旱胁迫的相对强度额河流域天然林生长发育所需水分的来源有自然降雨和阿尔泰山雪融水。6月上、中旬是雪融洪水的高发期,天然林内土壤的水分含量达到饱和为98.4%,7、8月份土壤相对含水率分别为31.6%和4.8%。
2.2 温度和光强在测定季内的日变化规律额河流域天然杨树林分内不同月份温度和光照强度的日变化见图 1a~1b。林内温度和光照强度的变化基本一致,随着光强的增加和降低,温度也发生相应的同步变化。其中,林内6,7月的平均温度的差别不大,比8月略高2~3 ℃。光照强度在一天中的变化基本符合单峰型,其值在14:00—16:00时段内相对较高。

|
图 1 6—8月林内温度和光强日变化 Figure 1 Diurnal changes of temperature and PAR from June to August |
图 2所示苦杨和银白杨的当年生、1年生和2年生萌生苗功能叶片在6—8月Gs的日变化规律。从图 3明显看出,相同年龄苦杨和银白杨叶片的Gs日变化规律不同。对比分析6,7月2个树种的变化规律发现,当年生苗木叶片Gs的日变化趋势比较一致,在光照强度较低的10:00—11:00时段内出现了Gs的最大值,之后随着时间和光、热条件的变化Gs值开始下降,但在15:00时,两者的Gs值均出现1个低谷,因为与14:00和16:00时的值差异显著(P<0.05)。苦杨1年生苗木叶片Gs在11:00时达到最大值后呈逐渐下降的趋势,表现为明显的单峰型;银白杨1年生苗木在15:00时也出现明显的低谷(P<0.05)。2年生苦杨叶片6—7月的Gs值在1天中呈现明显的双峰型,在12:00—14:00时段内出现了和光合作用相似的“午休现象”;而2年生银白杨叶片在接受自然干旱的7月份,在13:00时光照强度有所下降时出现较高的Gs值,而在14:00时光照强度较前一时段高时其Gs值却在下降,这与苦杨Gs值在此时段的变化有明显差异,说明在相同条件下银白杨气孔对环境的敏感性较苦杨要差,即气孔的控制力有所降低。受干旱高温的影响,8月份银白杨萌生苗的叶片全部自然干枯并脱落,但苦杨叶片Gs值的日变化呈单峰曲线型。在较低的光照条件下具有相对较大的Gs值。
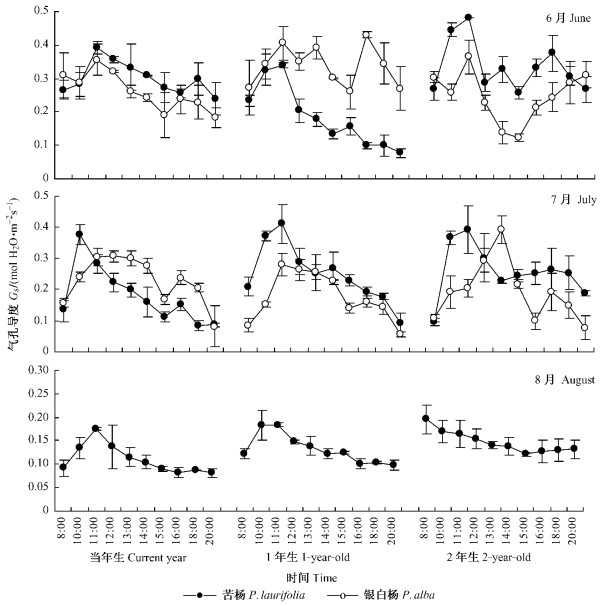
|
图 2 不同年龄苦杨和银白杨的气孔导度在不同月份内的日变化 Figure 2 Diurnal changes of Gs of P. laurifolia and P. alba in different age from June to August |
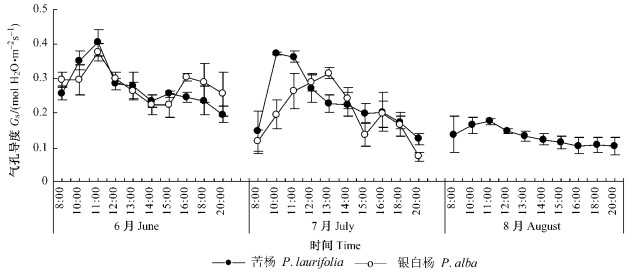
|
图 3 2种杨树气孔导度的日变化曲线在不同月份间的变化 Figure 3 Relationship between diurnal changes curve and seasonal changes of Gs of two poplar |
在相同月份,2树种Gs值的变化不同年龄间也存在差异。苦杨的Gs值在不同年龄间的变化较银白杨的稳定。
2.3.2 2种杨树Gs在不同生长期的日变化规律在额河流域,由于大气降水很少,河谷天然林植物生长的水分需求主要靠季节性融雪形成的洪水漫过河岸来满足。在测定的年份,从6—8月,呈现出自然干旱逐渐增加的趋势,2种杨树Gs随自然干旱季节的日变化见图 3。从图 3明显看出,2种杨树的平均Gs在生长季内随着干旱程度的增加从6—8月显示出递减的趋势。这可能是由于6月叶片刚刚萌发,正值额河流域上游雪融水形成洪水高峰时期,树木生长所需的水分条件良好,处于生长旺盛时期。在6月底7月初,洪水消退,植物生长开始面临干旱时期。8月是该地区最干旱的季节,降水几乎为0,树木的生长受到抑制,加之高温作用,使得Gs很小。这也再次说明了长时间的自然干旱减小了杨树叶片的Gs。
不同月份2树种的Gs日变化规律也存在差异。6月两者的日变化规律一致,气孔在11:00时达到最高导度值后,随着时间的推移,Gs值随之下降,即使在16:00时出现上升的趋势,但上升的差异是不显著的(P>0.05);7月苦杨的Gs日变化趋势与6月的基本一致,在10:00—11:00时段维持一天中的最大Gs值,之后Gs随时间推移呈缓慢下降的趋势,而银白杨的Gs在13:00时达到最大,而且在15:00时出现了低谷;8月苦杨Gs在各时间点间的差异不显著(P>0.05),在11:00时的值略高于其他时刻,但整体上仍表现为相对稳定的水平直线,且其值明显低于6,7月。
对比6,7月苦杨和银白杨的Gs变化趋势,可以看出,随着自然干旱的增加,苦杨的Gs日变化在6—8月均在11:00时段达到最大值,但数值是随着月份呈现下降的趋势;而银白杨的Gs日变化在6、7月表现为双峰型,但在维持Gs最大值的时间上存在明显的差异,这个差异说明银白杨气孔对环境的敏感性随自然干旱的增加有所降低。总体上,在测定期内苦杨气孔对干旱的耐性要高于银白杨,其值分别为(2.11±0.03)mol H2O·m-2 s-1和(1.60±0.01)mol H2O·m-2 s-1。
2.3.3 2种杨树Gs在不同月份间的变化2种杨树3个年龄叶片的Gs在不同月份间的变化见图 4。从图 4明显看出,Gs值从6—8月间呈下降趋势。3个年龄苦杨的Gs均以8月的最低。其中,当年生和2年生叶的Gs下降规律明显,其值在6—8月间的差异显著(P<0.05),均以6月的值为最大;而1年生叶在7月的Gs值虽较6月的高,但两者之间无差异(P>0.05),均与8月的值差异明显(P<0.05) (表 1)。因此,苦杨3个年龄苗木叶片的Gs的月变化呈现下降的趋势。
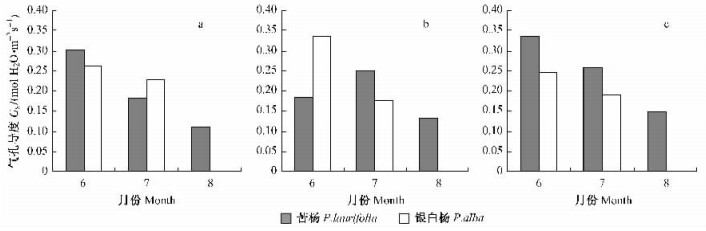
|
图 4 不同年龄苦杨和银白杨气孔导度的月变化 Figure 4 Diurnal changes of Gs of P. laurifolia and P. alba in different age from June to August a:当年生叶Current year leaves; b:1年生叶1-year-old leaves; c:2年生叶2-year-old leaves |
|
|
在8月,干旱高温导致银白杨萌生苗的叶片全部自然干枯并脱落,故未能测定该月的Gs值。从图 4上可以看出,7月的Gs值略低于6月的值。
2.4 气孔限制值(Ls)对净光合速率(Pn)、蒸腾速率(Tr)及水分利用效率(WUE)的影响根据2种杨树气孔限制值在6—8月的日变化趋势,其最大值在14:00—16:00时段内出现。因此,选择该时段内的一个时间点——15:00时作为代表,分析气孔限制对叶片水分和光合特性的影响。图 5显示了苦杨叶片在15:00时的Ls和Pn、WUE及Tr关系。在6,7月,苦杨叶片在15:00时Pn的变化不受气孔限制的影响,随着Ls的增大,Pn值也随之增加;在8月,当Ls大于0.3时,苦杨叶片的Pn值开始降低,即8月此时刻的Ls大于0.3就对Pn起到限制作用;相同的Ls在不同月份所对应的Pn值不同,表现为6,7和8月依次下降的趋势,但8月的Pn值要明显低于6,7月(P<0.05)。WUE在6—8月均随着气孔限制的增加而增大,说明苦杨叶片的水分利用效率大小在这一时刻是不受气孔限制的。Tr在6月随Ls的增加略有下降,表明该时刻气孔对Tr的限制作用很小,7月Tr在15:00时是不受气孔限制的影响,而在8月,随着Ls的增加,Tr出现了明显的下降,其对应的Ls为0.35。从图 5数据点的分布还可以看出,不同月份的Pn、WUE和Tr对Ls的响应值也是有差异的。

|
图 5 苦杨在15:00时的Ls对Pn、WUE和Tr的影响 Figure 5 Effect of Ls of P. laurifolia on Pn, WUE and Tr at 15:00 a:6月June;b:7月July;c:8月August |
6,7月的银白杨在15:00时的Ls和Pn、WUE及Tr关系见图 6。6,7月的Pn值随Ls的增加基本维持水平稳定的变化趋势。而WUE均随着Ls的增大而增加。Tr的变化比较明显,均随着Ls的增加而降低,引起其降低的Ls约为0.2。6月Ls在15:00时的变化范围在0~0.7之间,而7月的Ls在此时刻的变化范围缩小到0~0.5。

|
图 6 银白杨在15:00时的Ls对Pn、WUE和Tr的影响 Figure 6 Effect of Ls of P. alba on Pn, WUE and Tr at 15:00 a:6月June;b:7月July |
综上所述,6,7月苦杨和银白杨的Pn和WUE均不受Ls的影响;到8月,当苦杨的Ls大于0.3时,其叶片的Pn就产生明显的抑制,而银白杨的叶片由于不耐干旱均已脱落。2种杨树的Tr在6—8月均受Ls的限制,且气孔对苦杨的限制性要高于对银白杨。
3 结论与讨论1) 植物生理特性对干旱的响应随植物或年龄的大小的变化而变化(Casper et al., 1996)。苦杨和银白杨天然萌蘖更新幼树随着自然干旱程度的增加,其气孔导度的响应之间的差异不仅体现在树种上,而且同一树种在不同年龄、不同月份之间的Gs都存在差异。这里值得讨论的是2种杨树在8月叶片气孔导度对干旱的响应。在8月,银白杨由于受干旱高温的影响叶片全部干燥并脱落。这是因为植物在生长的过程中,叶片面积在增大,叶片水分蒸腾和从根系吸收水分的量也在增加,当水分限制因子存在时,如果植物保留叶片则增加了生存成本(Casper et al., 2001)。Garrity等(1984)的研究表明:在干旱期间高粱(Sorghum vulgare)群体光合速率的降低是源于叶表面积的减少,并非是气孔导度的降低。因此,叶片脱落是银白杨避旱的表现方式之一,但也说明了8月的干旱程度已经使银白杨叶片的气孔完全关闭,进而使叶肉细胞内光合器官及其代谢过程受阻。在试验过程中也观察到,8月银白杨的树干还是绿色,说明银白杨树干的光合作用可能在树木光合碳循环中也起着重要的作用。而苦杨在8月的叶片仍然生长正常,但其在该月份的气孔导度值明显的较6,7月的均低(P<0.05)。在天然分布上,苦杨在该流域既分布在山地河谷又分布在平原河谷,而银白杨只分布在平原河谷。对比这2种杨树在8月的特征表现,苦杨叶片对干旱的耐性要高于银白杨,这为解释上述2种杨树天然林分布范围差异的生态机制提供了依据。因此可以说,2种杨树分别是利用不同的方式来调节气孔,以适应自然干旱,这是种间生态功能差异的体现。
2) 气孔是一个通道,Gs反应气孔的开放的程度。它的变化影响叶片代谢所需的CO2,即造成气孔限制。Ls是反映气孔对植物各种生理过程的影响能力(Cornic,2000)。面对干旱,植物的气孔功能显示出广泛性和多样性(Hetherington,2003)。不同年龄及生长期树种的气孔限制值是不同的(Nardini et al., 2000)。苦杨和银白杨2种杨树在相同月份其Ls在同一时刻的变化范围不同,说明Ls在2种杨树间的差异还是比较明显。即使是同一树种,在相同的Ls范围内,数据点的分布也具有差异,表明生长季内不同月份的叶片经历自然干旱的响应也是有差异的;而Ls在某一时刻的数值范围随季节的变化趋势反应出自然干旱对气孔的作用程度。1天中不同时刻叶片气孔限制值是不同的。在15:00时,相同的气孔限制值对应的净光合速率随月份的变化在降低,说明自然干旱程度对叶片功能的影响是随着月份的推移在增加。因为气孔限制值的增加,叶片内外气体和水分交换受到限制,减少了叶肉组织中的水分含量,使叶片光合速率降低(Lawlor,2002),但2种杨树在15:00时的WUE的变化均不受Ls的影响,产生这种结果的原因可能是由于WUE的变化主要是Pn和Tr共同作用的结果。
3) 理解干旱的定义一般包含有2层意思,1层意思可以理解为干扰;另1层则认为是生物对干扰的反应(Lake,2003)。干旱可以产生短暂的大规模的水分短缺(低于正常供应值以下),不利于生长,而植物通过一系列的生理和形态的可塑性变化可抵消干旱对生长的限制,但是水分限制程度大将导致树木的死亡(Suarez et al., 2004)。大部分研究植物对干旱的反应是复杂和多变的,包括细胞水平、叶水平的生理和发育。气孔和非气孔限制是否在干旱抑制光合活力方面起着主要的作用是最近几年研究的焦点,并在该领域开展了相关的研究(Bunce,1998;Seneweera et al., 2001;Cornic et al., 2002;Grassi et al., 2005;Flexas et al., 2006)。在这些研究中,一些认为气孔限制是干旱胁迫的主要过程,因为最大CO2同化能力通过外部施加CO2或去除叶表皮是可以得到恢复的(Cornic et al., 2002;Gallé et al., 2007),而高CO2浓度不能彻底恢复干旱胁迫下的最大光合速率,应该属于非气孔限制(Lawlor,2002)。绝大多数的研究认为,轻度到中度干旱条件下,扩散阻力限制了光合作用,在重度干旱条件下,当Gs下降到0.1~0.05 mol·m-2 s-1时,非气孔限制是主要的(Flexas et al., 2006)。大气CO2浓度的增加可能引起全球变暖,进而影响降雨格局,提高自然干旱发生的机率(Kimball et al., 2001)。
本研究选择额河流域天然分布的典型树种——苦杨和银白杨,比较2个种的气孔特性对自然干旱的反应,不仅可以了解它们应对自然干旱的抗性差异,为研究其自然分布机理做出基础性的解释,也可为进一步分析气候变化后天然杨树林的响应奠定基础。今后,研究额河流域天然植被如何响应增强的气候变化和人为截流用水引起的干旱、干旱如何影响植物的生产力和生长以及受到干旱胁迫后天然植被的恢复能力和速度均是值得进一步探讨的问题。这些研究将为阐明在自然干旱胁迫下的天然植被恢复机理提供良好的理论支持,也可以为估测生态系统的生产力或为灌溉系统提供更好的服务。
李生宇, 雷加强. 2002. 额尔齐斯河流域生态系统格局及变化. 干旱区研究, 19(2): 56-61. |
刘平, 王健. 2004. 额尔齐斯河流域河谷林可持续发展的问题与对策. 新疆环境保护, 26(增): 139-142. |
温国胜, 张明如, 张国盛, 等. 2006. 干旱条件下臭柏的生理生态对策. 生态学报, 26(12): 4059-4065. DOI:10.3321/j.issn:1000-0933.2006.12.019 |
臧润国, 成克武, 李俊清, 等. 2005. 天然林生物多样性保育与恢复. 北京: 中国科技出版社, 269-315.
|
Araus J L, Slafer G A, Reynolds M P, et al. 2002. Plant breeding and drought in C3 cereals: what should we breed for?. Ann Bot, 89: 925-940. DOI:10.1093/aob/mcf049 |
Berry J A, Downton W J S. 1982. Environmental regulation of photosynthesis//Govind J. Photosynthesis (Vol Ⅲ). New York: Academic Press, 263-343.
|
Bray E A. 2004. Gene commonly regulated by water-deficit stress in Arabidopsis thaliana. Journal of Experimental Botany, 55: 2332-2341. |
Buckley T N, Farquhar G D, Mott K A. 1999. Carbon-water balance and patchy stomatal conductance. Oecologia, 118: 132-143. DOI:10.1007/s004420050711 |
Bunce J A. 1998. Effect of humidity on short-term responses of stomatal conductance to an increase in carbon dioxide concentration. Plant Cell Environ, 21: 115-120. DOI:10.1046/j.1365-3040.1998.00253.x |
Casper B B. 1996. Demographic consequences of drought in the herbaceous perennial Cryptantha flava: effects of density, associations with shrubs, and plant size. Oecologia, 106: 144-152. DOI:10.1007/BF00328593 |
Casper B B, Forseth I N, Kempenich H, et al. 2001. Drought prolongs life span in the herbaceous desert perennial Cryptantha flava. Functional Ecology, 15: 740-747. DOI:10.1046/j.0269-8463.2001.00583.x |
Chaves M. 2002. Water stress in the regulation of photosynthesis in the field. Ann Bot, 89: 907-916. DOI:10.1093/aob/mcf105 |
Cornic G, Fresneau C. 2002. Photosynthetic carbon reduction and carbon oxidation cycles are the main electron sinks for photosystem Ⅱ activity during a mild drought. Annals of Botany, 89: 887-894. DOI:10.1093/aob/mcf064 |
Cornic G. 2000. Drought stress inhibits photosynthesis by decreasing stomatal aperture: not by affecting ATP synthesis. Trend in Plant Science, 5(5): 187-188. DOI:10.1016/S1360-1385(00)01625-3 |
de Vries G E. 2000. Climate changes lead to unstable agriculture. Trends Plant Sci, 5: 367. |
Fernández J E, Moreno F, Girón I F, et al. 1997. Stomatal control of water use in olive tree leaves. Plant and Soil, 190: 179-192. DOI:10.1023/A:1004293026973 |
Flexas J, Bota J, Galmes J, et al. 2006. Keeping a positive carbon balance under adverse conditions: responses of photosynthesis and respiration to water stress. Physiologia Plantarum, 127: 343-352. DOI:10.1111/j.1399-3054.2006.00621.x |
Flexas J, Bota J, Loreto F, et al. 2004. Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3 plants. Plant Biology, 6: 269-279. DOI:10.1055/s-2004-820867 |
French R J, Turner N C. 1991. Water deficit change dry matter partitioning and seed yield in narrow-leafed lupins (Lupinus angustifolius L.). Aust J Agric Res, 42: 471-484. DOI:10.1071/AR9910471 |
Gallé A, Haldimann P, Feller U. 2007. Photosynthetic performance and water relations in young pubescent oak (Quercus pubescens) trees during drought stress and recovery. New Phytologist, 174: 799-810. DOI:10.1111/nph.2007.174.issue-4 |
Garrity D P, Sullivan C Y, Watts D G. 1984. Changes in grain sorghum stomatal and photosynthetic response to moisture stress across growth stages. Crop Science, 24: 441-446. DOI:10.2135/cropsci1984.0011183X002400030003x |
Grassi G, Magnani F. 2005. Stomatal, mesophyll conductance and biochemical limitations to photo-synthesis as affected by drought and leaf ontogeny in ash and oak trees. Plant, Cell & Environment, 28: 834-849. |
Griffiths H, Parry M A J. 2002. Plant responses to water stress. Ann Bot, 89: 801-802. |
Grulke N E, Preisler H K, Rose C, et al. 2002. O3 uptake and drought stress effects on carbon acquisition of ponderosa pine in natural stands. New Phytologist, 154: 621-631. DOI:10.1046/j.1469-8137.2002.00403.x |
Hetherington A M, Woodward F I. 2003. The role of stomata in sensing and driving environmental change. Nature, 424: 901-908. DOI:10.1038/nature01843 |
Hiyama T, Kochi K, Kobayashi N, et al. 2005. Seasonal variation in stomatal conductance and physiological factors observed in a secondary warm- temperate forest. Ecol Res, 20: 333-346. DOI:10.1007/s11284-005-0049-6 |
Kimball B A, Morris C F, Pinter Jr P J, et al. 2001. Elevated CO2, drought and soil nitrogen effects on wheat grain quality. New Phytol, 150: 295-303. DOI:10.1046/j.1469-8137.2001.00107.x |
Lake P S. 2003. Ecological effects of perturbation by drought in flowing waters. Freshwater Biology, 48: 1161-1172. DOI:10.1046/j.1365-2427.2003.01086.x |
Larcher W. 1999. Physiological plant ecology. Tokyo: Springer-Verlag, 234-258.
|
Lawlor D W. 2002. Limitation to photosynthesis in water-stressed leaves: stomata vs. metabolism and the role of ATP. Annals of Bontany, 89: 871-885. DOI:10.1093/aob/mcf110 |
Lopes M S, Nogués S, Araus J L. 2004. Nitrogen source and water regime effects on barley photosynthesis and isotope signature. Funct Plant Biol, 31: 995-1003. DOI:10.1071/FP04031 |
Miyashita K, Tanakamaru S, Maitani T, et al. 2005. Recovery responses of photosynthesis, transpiration, and stomatal conductance in kidney bean following drought stress. Environ Exp Bot, 53: 205-214. DOI:10.1016/j.envexpbot.2004.03.015 |
Nardini A, Salleo S. 2000. Limitation of stomatal conductance by hydraulic traits: sensing or preventing xylem cavitation?. Trees, 15: 14-24. DOI:10.1007/s004680000071 |
Ramesh P, Mahadevaswamy M. 2000. Effect of formative phase drought on different classes of shoots, shoot mortality, cane attributes, yield and quality of four sugarcane cultivars. J Agronomy & Crop Science, 185: 249-258. |
Reddy A R, Chaitanya K V, Vivekanandan M. 2004. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 161: 1189-1202. DOI:10.1016/j.jplph.2004.01.013 |
Robredo A, Pérez-López U, Sainz de la Maza H, et al. 2007. Elevated CO2 alleviates the impact of drought on barley improving water status by lowering stomatal conductance and delaying its effects on photosynthesis. Environmental and Experimental Botany, 59: 252-263. DOI:10.1016/j.envexpbot.2006.01.001 |
Seneweera S, Ghannoum O, Conroy J P. 2001. Root and shoot factors contribute to the effect of drought on photosynthesis and growth of the C4 grass Panicum coloratum at elevated CO2 partial pressures. Aust J Plant Physiol, 28: 451-460. |
Staley J T, Mortimer S R, Masters G J, et al. 2006. Drought stress differentially affects leaf-mining species. Ecological Entomology, 31: 460-469. DOI:10.1111/een.2006.31.issue-5 |
Suarez M L, Ghermandi L, Kitzberger T. 2004. Factors predisposing episodic drought-induced tree mortality in Nothofagus: site, climatic sensitivity and growth trends. Journal of Ecology, 92: 954-966. DOI:10.1111/jec.2004.92.issue-6 |
Tardieu F. 2005. Plant tolerance to water deficits: physical limits and possibilities for progress. Comptes Rendus Geoscience, 337: 57-67. DOI:10.1016/j.crte.2004.09.015 |
Wang G X, Cheng G D. 2000. The characteristics of water resources and the changes of the hydrological process and environment in the arid zone of northwest China. Environmental Geology, 39(7): 783-790. DOI:10.1007/s002540050494 |
 2009, Vol. 45
2009, Vol. 45


