文章信息
- 张振, 余仲东, 唐明, 侯璐.
- Zhang Zhen, Yu Zhongdong, Tang Ming, Hou Lu
- 陕西省31株木本植物炭疽菌的rDNA-ITS区序列分析
- ITS-rDNA Sequence Analysis of Colletotrichum in Woody Plants in Shaanxi Province
- 林业科学, 2009, 45(5): 164-168.
- Scientia Silvae Sinicae, 2009, 45(5): 164-168.
-
文章历史
- 收稿日期:2008-08-07
-
作者相关文章
炭疽菌属(Colletotrichum)是一类重要的植物病原真菌,广泛分布于热带、亚热带和温带地区,可引起许多植物病害,尤其对用材林、特种经济林、苗木和果树危害较大。我国是炭疽病的重发区,每年该类病害都会造成严重的损失。
在陕西省,胶孢炭疽菌可危害32个科46个属70个种(变种)的植物(王晓鸣等,1987)。刘晓云等(1995)根据国内发生的寄主植物和分生孢子、附着孢及培养特征,将陕西省木本植物上炭疽菌分为3个种,大多数木本植物上的炭疽菌种归为胶孢炭疽菌[Colletotrichum gloeosporioides(有性型:Glomerella cingulata)],梭孢炭疽菌(Colletotrichum acutatum)和1个中国新记录种壳皮炭疽菌(Colletotrichum crassipes)。2000年以后,因为分生孢子,附着孢,子囊壳形成、培养特征等在不同菌株间差异大且受环境条件的显著影响,木本植物上的炭疽病真菌多以复合种胶孢炭疽菌命名;有性型以Glomerella cingulata命名(曹文广, 2005),种下根据侵染寄主和附着孢等培养性状的差异将该种又分为9个专化型(von Arx et al., 1970;Sutton,1992)。许多研究表明:除形态上的变异较大外,胶孢炭疽菌在遗传特征上也存在差异。徐红梅等(2004)根据RAPD结果,将来自国内的43个胶孢炭疽菌分为2个群;曾大兴等(2003)根据RAPD结果,将来自广东省果树上的20个胶孢炭疽菌分为1个群。系统群不能反应菌株在形态上的差别,也不能反映其在寄主上的选择性。Lu等(2004)对12种树木炭疽病病原菌的研究表明:炭疽菌的寄主专化性和地域专化性均不明显。为进一步探讨木本植物炭疽菌在寄主专化性、地域来源和遗传差异之间的关系,明确其系统发育,本文对来自陕西省木本植物上的炭疽病病原真菌进行了rDNA-ITS序列分析和比较,现报道如下。
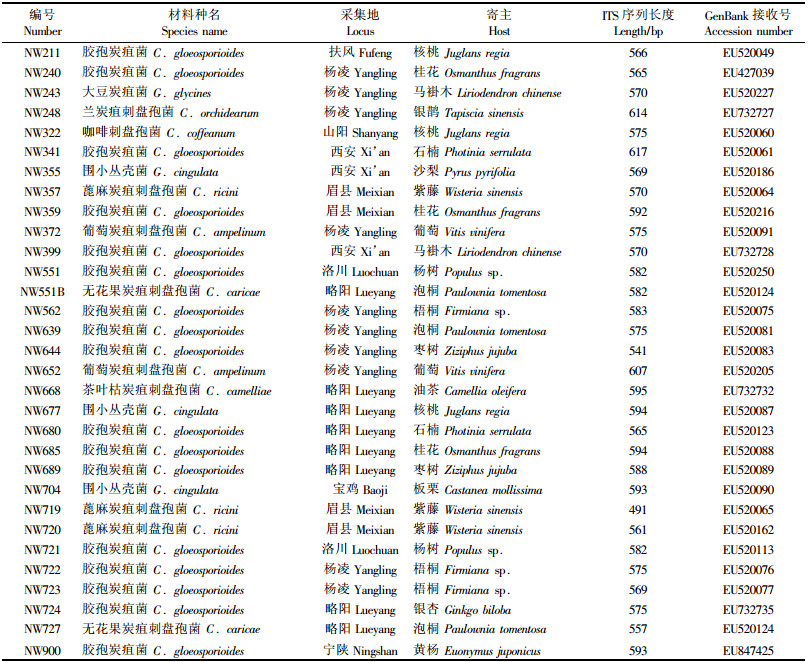
1 材料与方法 1.1 供试菌种的采集和分离在陕西省境内采集木本植物炭疽菌菌株共31株(表 1),按常规方法分离获得纯培养物。
|
|
根据子实体形态特征,按von Arx(1957;1970)分类系统和Sutton(1980)分类系统进行鉴定,文中定名均采用魏景超(1979)和戴芳澜(1979)等相关资料命名。
1.3 DNA提取收集培养物干菌丝,采用改进的CTAB法提取DNA,参照王国英(1997)的方法。
1.4 引物和反应条件优化扩增引物采用真菌核糖体基因转录间隔区(ITS)通用引物ITS1和ITS4(White et al., 1990)。PCR反应体系为50 μL,反应条件为:94 ℃预变性2 min;94 ℃变性30 s,57.3 ℃退火30 s,72 ℃延伸40 s,共30个循环,最后72 ℃延伸10 min 30 s。
1.5 DNA序列测定和ITS序列分析PCR产物经纯化后,送交上海生物工程公司进行DNA双向测序,测序引物为PCR扩增引物。序列用Chromas.exe软件进行修订后提交GenBank,并用BLASTn进行同源性比较。
1.6 系统发育树的构建以痂圆孢菌属(Sphaceloma)真菌为外群,以从Genebank下载的7株炭疽菌菌株为参考菌株,用Clustalx 1.81首先将序列对齐,然后利用MEGA 4.0软件进行系统发育分析,以自展法(bootstrap)进行检测,共循环1000次,构建邻接树(NJ树,neighbor-joining tree)和最大简约树(MP树,maximum parsimony tree)(Wang et al.,1999)。系统发育树描述中的步长(tree length,TL)、一致性指数(consistency index,CI)、保留指数(retention index,RI)等由MEGA 4.0提供报告,应用Kimura双参数法计算遗传距离和菌株间平均遗传距离,应用Tajima-Nei法计算序列多样性(邢红梅等,2008)。
2 结果与分析 2.1 形态学鉴定经过形态学初步鉴定,31株炭疽菌菌株分属以下9个种(表 1):胶孢炭疽菌,葡萄炭疽刺盘孢菌,咖啡刺盘孢菌,无花果炭疽刺盘孢菌,茶叶枯炭疽刺盘孢菌,蓖麻炭疽刺盘孢菌,兰炭疽刺盘孢菌,大豆炭疽菌,围小丛壳菌。
2.2 rDNA-ITS区段的PCR扩增及测序结果用引物ITS1和ITS4扩增31个炭疽菌菌株的rDNA-ITS区段,获得约580 bp的电泳产物。31个菌株的rDNA-ITS区段PCR产物测序后获得ITS区段的全序列,ITS区域长度为491~617 bp,呈现明显的序列长度多态性,GC含量在46.2%~56.9%之间。测序结果经校对后提交到GenBank数据库,接收序列号见表 1。
2.3 rDNA-ITS序列聚类分析(图 1)

|
图 1 rDNA-ITS序列分析构建的最大简约(MP)系统发育树 Figure 1 The maximum parsimony tree based on rDNA-ITS sequences 分支上的数字代表该分枝的自展支持率(bootstrap值,1 000次重复)。★表示序列来自GenBank,☆表示外群。 The number on each branch denotes bootstrap value (1 000 replication).The samples marked with "★" were obtained from GenBank, "☆" represented out-group. |
MEGA4.0软件构建的MP树步长=406,一致性指数(consistency index,CI) =0.672 414,总留存指数(retention index,RI)=0.902 849,总尺度化一致性指数RCI =0.607 088(for all sites)。构建的NJ树与MP树拓扑结构一致。
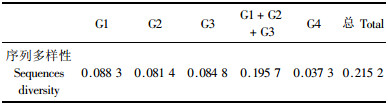
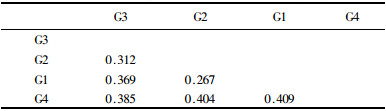
以痂圆孢菌属(Elizabeth A et al,2003)为外群的情况下,全部菌株在99%的自展支持率下同炭疽菌属分开,从GeneBank下载的2株炭疽菌属模式菌株(Duke,1928;吴文平等,1994)黑线炭疽菌同木本炭疽菌群聚在一起,4株胶孢炭疽菌参比菌株比较均一地聚在同一炭疽菌群内。在92%的自展率下,38个炭疽菌株可分为3个大的类群,图 1。菌株序列多样性指数为0.195 7(表 3),株间平均遗传距离为0.193 3。群G1和群G2的亲缘关系较近,之间的遗传距离为0.267。群G3与G1的亲缘关系相对较远,两者之间的遗传距离为0.369(表 4)。胶孢炭疽菌与其他木本炭疽菌一起分属于G1、G2、G3群中。大多数胶孢炭疽菌归属于群G1,序列多样性指数最大(0.088 3);群G2中菌株序列多样性最小(0.081 4)。
|
|
|
|
木本植物炭疽菌存在比较丰富的遗传多样性,其形态特征差异性大。菌落质地、颜色、菌丝高度、产孢梗、分生孢子、附着胞都有很大的差异,但形态特征稳定性差且易受培养条件的影响,以至Sutton(1992)认为对胶孢炭疽菌复合种内的菌株的系统分类和鉴定, 单独依靠形态特征是不可能取得进展的;世系一致性系统发育种在真菌的鉴定中起了重要作用(John et al., 2002),但有些炭疽菌的有性形态产生较困难:所以, 依靠遗传特征的差异来研究炭疽菌种间差异和系统学关系是一个重要的尝试。本研究表明:炭疽菌rDNA的ITS区序列存在明显的差异,其ITS-rDNA序列多样性达0.195 7,序列长度差异达94 bp,通过聚类分析可将其分为不同的遗传类群。因此,炭疽菌rDNA的ITS区序列对种及种下专化型的划分具有一定的意义,这与Dresler等(1999), Freeman等(2000)的研究结果一致。
3.2 木本植物炭疽菌的分类与寄主、地理来源的关系早期的炭疽菌分类在很大程度上是依据寄主的范围进行确定,为研究该类真菌及其所引起的病害防治提供了依据。但从序列分析结果看,来自同一寄主的炭疽病菌在遗传上有分化,如NW551B,NW639,NW727 3者均来自泡桐,相互间却存在较大的遗传差异。来自核桃上的NW211,NW322,NW677,以及来自桂花上的NW240,NW359,NW685均存在类似现象,在系统进化树中分属不同的群。采用RAPD,ISSR-PCR等分子生物学技术对该类真菌的分析也得到类似结论(Lu et al,2004;曾大兴等,2003;徐红梅等,2004;Cannon et al.,2000;Johnston et al., 2000;Du et al., 2004),表明胶孢炭疽菌这个复合种内存在一定程度的遗传分化现象,但这种分化能否随供试菌株数量增加而达到种级分类学水平,需将来进一步研究。
有些研究表明炭疽菌的分类与菌株的地理来源有明显的相关性(曾大兴等,2001;张欣等, 2002), 同时也有些研究认为炭疽菌的分类与菌株的地理来源没有相关性(曾大兴等,2004;徐红梅等,2004)。本研究表明:陕西境内炭疽菌分化与地理来源没有直接相关性,如NW722与NW723均为胶孢炭疽菌来自于杨凌的梧桐,但在系统进化树中分属不同的群,同样的结果也出现在NW719与NW720(均为蓖麻炭疽刺盘孢菌,来自于眉县的紫藤)之间。
3.3 胶孢炭疽菌与其他木本植物炭疽菌的关系胶孢炭疽菌种内遗传变异较大,与寄主及地理来源相关性不明显,在ITS序列聚类分析中胶孢炭疽菌明显的分属在3个系统群中。但各群的遗传多样性指数均较小(小于0.1), 群间遗传距离不大, 同一群内胶孢炭疽菌各菌株间以及胶孢炭疽菌与其他木本炭疽菌间遗传距离也均较小,表明胶孢炭疽菌同其他木本炭疽菌间仍然具有较近的亲缘关系。因此, 目前在未明确木本炭疽菌内有性种产生的形态差别前, 以复合种名胶孢炭疽菌来定名木本植物炭疽病菌是合理的。
曹文广, 刘云龙, 张中义, 等. 2005. 炭疽菌属Colletotrichum Cda的分类研究进展. 中国食用菌, 24: 118-122. |
戴芳澜. 1979. 中国真菌总汇. 北京: 科学出版社.
|
刘晓云, 景耀, 杨俊秀. 1995. 陕西省木本植物炭疽菌分类研究. 西北林学院学报, 10(3): 29-36. |
王晓鸣, 李建义. 1987. 陕西省炭疽菌的研究. 真菌学报, 6(4): 211-218. |
魏景超. 1979. 真菌鉴定手册. 上海: 上海科学技术出版社.
|
吴文平, 张志铭. 1994. 炭疽菌Colletorichum Cda分类学研究Ⅰ属级分类和名称. 河北农业大学学报, 17(2): 24-31. |
邢红梅, 丁平, 周晓云, 等. 2008. 红掌胶胞炭疽菌的分子检测. 植物病理学报, 38(2): 113-119. DOI:10.3321/j.issn:0412-0914.2008.02.001 |
徐红梅, 管兰华, 韩正敏. 2004. 用RAPD标记研究中国木本植物胶孢炭疽菌的群体分化. 东北林业大学学报, 32(6): 55-57. DOI:10.3969/j.issn.1000-5382.2004.06.016 |
徐红梅, 管兰华, 韩正敏. 2004. 不同胶孢炭疽菌菌株比较. 南京林业大学学报, 28(3): 67-69. DOI:10.3969/j.issn.1000-2006.2004.03.017 |
王国英. 1997. 基因工程实验技术. 北京: 中国农业出版社.
|
曾大兴. 2003. 胶孢炭疽菌的种内遗传多样性研究. 菌物系统, 22(1): 50-55. DOI:10.3969/j.issn.1672-6472.2003.01.015 |
曾大兴, 戚佩坤, 姜子德. 2001. 香蕉炭疽菌菌株亲缘关系的RAPD分析. 菌物系统, 20(3): 324-329. DOI:10.3969/j.issn.1672-6472.2001.03.007 |
曾大兴, 戚佩坤, 姜子德. 2004. 弯孢类炭疽菌菌株的RAPD分析与分类研究. 菌物学报, 32: 170-174. |
张欣, 史学群. 2002. 橡胶树炭疽病菌的RAPD指纹分析. 热带作物学报, 23(3): 43-46. DOI:10.3969/j.issn.1000-2561.2002.03.008 |
Cannon P F, Bridge P D, Monte E. 2000. Linking the past and future of Colletotrichum systematics. Hostspecifcity, Pathology and Host-pathogen Interaction, 85: 1-20. |
Dresler N A, Kaijalainen S, Lindstrom K, et al. 1999. Grouping of lignin degrading corticioid fungi based on RFLP analysis of 18S rDNA and ITS regions. Mycol Res, 103: 990-996. DOI:10.1017/S0953756298008156 |
Du M Z, Christopher L. Schardl, Etta M N. 2005. Using mating-type gene sequences for improved phylogenetic resolution of Collectotrichum species complexes. Mycologia, 97(3): 641-658. DOI:10.1080/15572536.2006.11832795 |
Duke M M. 1928. The genera Vermicularia Fr. and Colletotrichum Cda. Mycol Soc, 13: 147-167. |
Elizabeth A, Juan F M. 2003. Molecular and Pathogenicity Characterization of Sphaceloma manihoticola Isolates from South-Central Brazil. Plant Disease, 87(11): 1322-1328. DOI:10.1094/PDIS.2003.87.11.1322 |
Freeman S, Minz D, Jurkevitch E, et al. 2000. Molecular analyses of Colletotrichm species from almond and other fruits. Phytopathology, 90(6): 608-614. DOI:10.1094/PHYTO.2000.90.6.608 |
John W T, David J J, Scott K, et al. 2002. Phylogenetic species recognition and species concepts in Fungi. Fungal Genetics and Biology, 31: 21-32. |
Johnston P R. 2000. The importance of phylogeny in understanding host relationships within Colletotrichum. Host Specifcity, Pathology and Host-pathogen Interaction, 96: 21-28.
|
Lu G Z, Paul F C, Alex R D, et al. 2004. Diversity and molecular relationships of endophytic Colletotrichum isolates from the Iwokrama Forest Reserve, Guyana. Mycol Res, 108(1): 53-63. DOI:10.1017/S0953756203008906 |
Sutton B C. 1992. The genus Glomerella and its anamorph Colletotrichum. Biology Pathology and Control, 78: 1-26. |
Sutton B C. 1980. The Coelomycetes CMI. Kew, Surrey, 523-537.
|
von Arx J A. 1957. Die arten der gattung Colletotrichum Cda. Phytopathol Z, 29: 413-468. |
von Arx J A. 1970. A revision of fungi classified as Gloeosporium. J Cramer Lehre, 66: 383-390. |
Wang J B, Zhang W J, Chen J K. 1999. Application of ITS sequences of nuclear rDNA in phylogenetic and evolutionary studies of angiosperms. Acta Phytotaxonomica Sinica, 37(4): 407-416. |
White T J, Bruns T, Tee S, et al. 1990. Applification and directsequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols, 315-322.
|
 2009, Vol. 45
2009, Vol. 45