文章信息
- 陆俊锟, 陈俊, 康丽华, 杨振德.
- Lu Junkun, Chen Jun, Kang Lihua, Yang Zhende
- 华南红树林溶磷菌16S rDNA PCR-RFLP分析及其溶磷能力
- Analysis of the 16S rDNA PCR-RFLP and the Phosphate-Dissolving Capacity of Phosphate-Dissolving Bacteria Isolated from Rhizosphere of Mangrove in Southern China
- 林业科学, 2009, 45(5): 137-142.
- Scientia Silvae Sinicae, 2009, 45(5): 137-142.
-
文章历史
- 收稿日期:2008-05-12
-
作者相关文章
2. 广西大学林学院 南宁 530004
2. College of Forestry, Guangxi University Nanning 530004
红树林是自然分布于热带、亚热带海岸的潮间带的木本植物群落, 通常生长在港湾河口的淤泥质滩涂上,是海滩上特有的森林类型(Lin, 1999),具有独特的生态地位,是宝贵的生物资源。磷是植物生长不可或缺的营养元素,由于红树林周期性生长在海水中, 间隙水富含Mg2+,Ca2+,Fe2+等阳离子,磷酸盐通常沉淀在底泥中,导致大量的磷元素不能被红树植物所利用(Bashan, et al., 2002)。
溶磷菌在代谢过程中分泌多种有机酸,降低培养介质的pH值,同时有机酸与Ca2+,Mg2+,Fe2+,铝等金属离子的结合,为植物提供可溶性磷(赵小蓉等,2003),对植物的生长发育中起着不可忽视的作用。能够使土壤中无效态磷转化为有效态磷的微生物种类很多,研究比较多的是芽孢杆菌属(Bacillus sp.)(杜春梅等,2007;李文红等,2006)。在以往红树林微生物研究中,对微生物溶磷作用、对溶磷细菌的研究较少(龙寒等,2005)。本研究从华南3地的2种红树植物根际中分离具有溶磷能力的菌株,并通过16S rDNA PCR-RFLP对菌株进行聚类分类,对代表菌株进行16S rDNA测序并构建系统发育树,以及其溶磷能力测定,分析华南地区红树林根际溶磷菌的多样性,为进行红树人工林恢复试验提供优良菌株提出有效的理论依据。
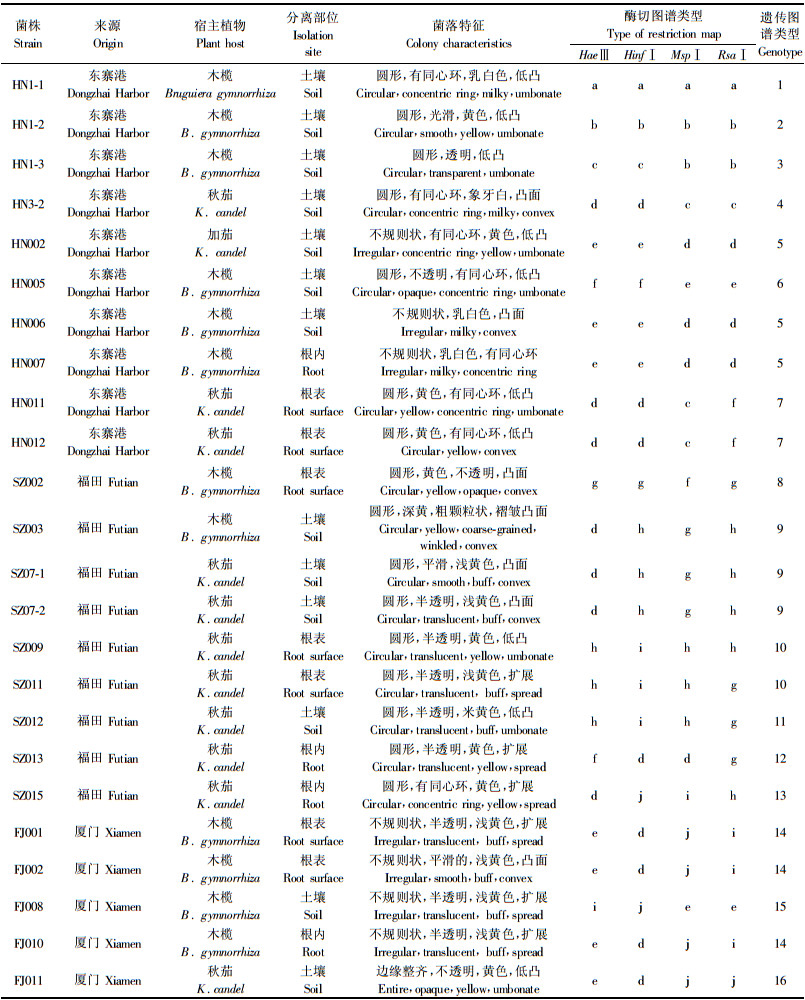
1 材料与方法 1.1 菌株来源在海南东寨港红树林保护区、深圳福田红树林保护区以及厦门大学引种园等3地红树林中,从红树植物木榄(Bruguiera gymnorrhiza)和秋茄(Kandelia candel)的根际通过改良SRSM固体培养基(Vazquez et al., 1999)分离筛选出溶磷菌,然后经纯化及保存。采集地点和宿主植物参见表 1。
|
|
参照Wen等(1993)快速提取法提取菌株DNA。菌株用LB液体培养基(沈萍等,1999)在28 ℃振荡培养至对数生长期, 12 000 r·min-1离心收集菌体, 用1×TE(10 mmol·L-1 Tris-HCl, pH7.6;1 mmol·L-1 EDTA, pH8.0)缓冲液洗涤2~3次, 以除去细菌的胞外多糖。用裂解液(40 mmol·L-1 Tris-HCl, 20 mmol·L-1 NaAc, 1 mmol·L-1EDTA, 1% SDS)破壁, 再用5 mol·L-1 NaCl沉淀溶液, 上清液用等体积的苯酚、苯酚/氯仿/异戊醇(25:24:1)、氯仿各抽提1次。2倍体积无水乙醇、0.1倍体积3 mol·L-1 KAc沉淀, 抽真空干燥, 最后溶于1×TE缓冲液中。
1.3 16S rDNA的扩增引物分为正向引物F27(5′-AGA GTT TGA TCA TGG CTC AG-3′)和反向引物R1492(5′-TAC GGT TAC CTT GTT ACG T-3′)。25 μL反应体系中:10×PCR Buffer 2.5 μL, 2.5 mmol·L-1 dNTP 2 μL, 50 μmol F27引物和R1492引物各0.5 μL,Mg2+ 3.25 μL, 模板DNA 1 μL,Taq酶1U,ddH2O补至总体积25 μL。扩增条件:95 ℃变性5 min,再以95 ℃变性1 min,56.7 ℃退火50 s,72 ℃延伸1 min,32个循环, 72 ℃延伸10 min。
1.4 酶切与电泳选取4种限制性内切酶(HaeⅢ、HinfⅠ、MspⅠ及RsaⅠ)。每个酶切反应中加入16 μL PCR产物,1 μL酶,1.5 μL相应的酶切缓冲液,37 ℃酶切3 h。全部酶切产物与2 μL上样缓冲液混匀后点样,3%琼脂糖100 V电泳4 h。
1.5 数据分析和处理对RFLP酶切图谱通过NTSYS软件按平均连锁法(UPGMA)进行聚类分析,将结果转化为树状图谱。
1.6 16S rDNA序列分析与进化树的建立根据16S rDNA PCR-RFLP聚类结果,选取各亚群中的代表菌株,扩增其16S rDNA,扩增方法同1.3,16S rDNA PCR产物全序列由上海生工生物公司测定。将测序结果输入GenBank, 通过BLAST程序在GenBank(www.ncbi.nlm.nih.gov)中进行相似性搜索,并从比对后所得的结果中找到相似度高的序列进行比对分析,应用Clustal X 1.81进行多重序列比对,然后用MAGA3.1软件采用邻位相连(Neighbor-joining)法计算各个菌株之间的遗传距离并构建系统发育树。序列相似性所用参比菌株来自GenBank,索取号分别为:Bacillus aquaemaris TF-12(AF483625)、B.pumilus SDB-01(EU874254)、B.megaterium B4(FJ009397)、Paenibacillus sp.GPTSA21(DQ854978)、P.ginsengagri(AB245383)、Uncultured Shigella sp.clone M7-22(EU530456)、Klebsiella ornithinolytica(Y17662)、Vibrio parahaemolyticus(DQ068942)。
1.7 溶磷能力的测定1)溶磷圈大小的测定 将待测的菌株先在LB固体培养基上活化,然后用灭菌牙签点接种菌株至固体改良SRSM培养基上。每菌株在1个皿上接4个重复。在28 ℃培养箱中培养5天后观察菌株透明圈的大小。
2)钼锑抗比色法测定 将不加磷源的改良SRSM液体培养基100 mL分装在250 mL三角瓶中,灭菌后加入0.5 g灭菌Ca3(PO4)2粉,加入1 mL已培养24 h的菌液,28~30 ℃,150 r·min-1摇床培养48 h,然后取菌株培养液,10 000 r·min-1离心10 min,取上清液进行钼锑抗比色法(许光辉等,1986)测定其溶磷量,用pHS-3C型酸度计直接测定pH值。同时做不接种的改良SRSM液体培养基(含Ca3(PO4)2粉)为对照(CK),溶磷量由扣除不接种对照的值计算,所有菌株均做3次重复。
2 结果与分析 2.1 溶磷菌的分离采集到的溶磷菌经过分离、纯化后共获得24株待测菌(见表 1),其中10株来自东寨港,9株来自福田,5株来自厦门。从分离自红树植物根际各部位中,土壤分离的溶磷菌最多,其次是根表和根内。分离菌株的菌落多都呈圆形或近圆形,表面光滑,质地松软,生长较快。
2.2 16S rDNA PCR产物的酶切图谱用引物F27和R1492对供试菌株的16S rDNA进行PCR扩增后,通过琼脂糖凝胶电泳检测,均产生约1.5 kb的DNA带。24株菌的16S rDNAPCR产物经HaeⅢ、HinfⅠ、MspⅠ及RsaⅠ酶切后分别产生9,10,10,10种带型。表 1列出了各株菌的酶切图谱类型及遗传图谱类型。这4种酶组合到一起所得到的16S rDNA遗传图谱类型共有16种。
2.3 RFLP聚类结果将4种酶切图谱结果转换成数值“1”“0”后,用NTSYS软件(UPGMA)对其进行聚类分析(图 1)。24株溶磷菌在59%的相似水平上聚在一起分为2个大群,表明菌株的16S rDNA序列相似性低,菌种多样性丰富。在80%的相似水平上,24株溶磷菌可分为7个亚群;另有1菌株(SZ002)在树状图上占据独立的1个分支。

|
图 1 16S rDNA PCR-RFLP聚类结果 Figure 1 Phylogenetic tree derived from 16S rDNA PCR-RFLP |
亚群1、亚群2都包括4株菌株,亚群内各菌株分离自同一地点,分别为东寨港红树林和福田红树林,但群内的宿主及分离部位没有特异性,即不同的宿主,不同的分离部位。
亚群3包括2株菌株,宿主为秋茄,分离自福田红树林,但分离部位不一致。
亚群4包括2株菌株,宿主为木榄,分离自东寨港红树林,分离部位都来自土壤。
亚群5包括3株菌株,分离自东寨港红树林,但宿主及分离部位不具特异性。
亚群6包括5株菌株,分离自福田红树林的1株,其余4株在95%的相似水平上聚集在一起,均分离自厦门大学引种园,群内的宿主及分离部位均无特异性。
亚群7包括2株菌株,分离自厦门大学引种园及东寨港红树林,但宿主同为木榄,分离部位同为土壤。
以上结果表明:24株溶磷菌在RFLP聚类结果中,大多数菌株的分类聚群与地理位置有明显的对应关系,个别菌株SZ013、HN005及FJ008与异地的菌株聚群也在相似性较低的水平上,表明红树林溶磷菌具有明显的地域性特征;而溶磷菌的分类聚群与宿主及分离部位之间没有明显的对应关系。
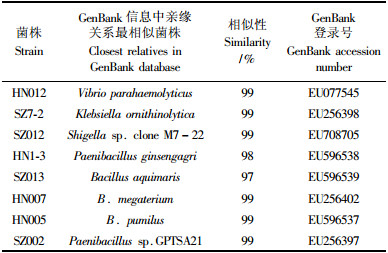
2.4 16S rDNA序列的相似性及系统发育选取16S rDNA PCR-RFLP分析结果中各亚群的代表菌株分别为HN012,SZ7-2,SZ012,HN1-3,SZ013,HN007,HN005,以及独立分支SZ002, 进行16S rDNA全序列测定,在NCBI进行BLAST分析(表 2)。
|
|
8株代表菌株与来自GenBank的8株参比菌株构建系统发育树(图 2),各代表菌株都与已知参比菌株有很高的序列相似性,最低的为SZ013与1株分离自韩国黄海潮滩的Bacillus aquaemaris TF-12(AF483625),相似性为99%,其余均为100%,包括HN012与分离自海洋的Vibrlo parahaemolyticus(DQ068942),SZ7-2与分离自丹麦土壤的K.ornithinolytica(Y17662),SZ012与分离自环境的Uncultured Shigella sp.clone M7-22(EU530456),SZ002与分离自温泉水中的Paenibacillus sp. GPTSA21(DQ854978),HN1-3与分离自人参林地的P.ginsengagri(AB245383),HN007与分离自土壤的B.megaterium B4(FJ009397),以及HN005与分离自土壤的B.pumilus SDB-01(EU874254)。

|
图 2 溶磷菌16S rDNA序列系统发育树分析 Figure 2 Neighbor-joining tree constructed showing the phylogenetic relationships among 16S rDNA genes sequences of phosphate-dissolving bacteria and their closely related sequences downloaded from GenBank |
红树林生态系统处于海洋、陆地的动态交界面,周期性遭受海水侵淹的潮间带环境,致使其在结构和功能上具有既不同于陆地生态系统,也不同于海洋生态系统的特征(曹启民等,2008)。从各代表菌株系统发育结果看出,红树林根际溶磷菌不仅具有常见的Bacillus megaterium,B. pumilus等陆生土壤细菌,还兼具Vibrio parahaemolyticus,B. aquimaris等海洋性细菌,表现出红树林土壤兼有海洋和陆地的性质却又与2者不同的生态环境特征。
2.5 溶磷能力的测定1)溶磷圈的测定 依据透明圈大小进行平板筛选和鉴定,虽然仅是一种粗略的半定量方法,但其透明圈直径大小与菌株解磷能力呈正相关关系(李文红等,2006)。选取代表菌株分别为HN1-3,HN005,HN012,SZ7-2,SZ012,SZ013以及HN007等溶磷菌进行溶磷圈大小的测定(表 3),各代表菌株在固体培养基上产生了不同程度大小的溶磷圈(图 3),其中以SZ012及HN007所产生的溶磷圈最大,平均达到16 mm,最小的为SZ013,仅有1 mm。
|
|

|
图 3 供试溶磷菌产生的溶磷圈 Figure 3 Halo of phosphate-dissolving bacteria in solid media |
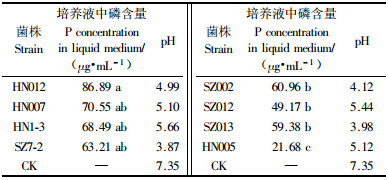
2)溶解无机磷能力的测定 对8株代表菌株的溶解无机磷能力及pH进行测定(表 4)。各代表菌株均有一定的溶磷能力,以HN012最强,在其接种的培养液中,可溶性磷含量高达86.89 μg·mL-1;HN005溶磷能力最差,可溶性磷含量为21.68 μg·mL-1。万璐等(2004)对13株红树林溶磷菌溶磷能力测定结果为1.10~160.11 mg·L-1,与本研究结果比较接近。本研究发现,接种48 h后溶磷菌产生溶解无机磷的同时,培养液的pH值不同程度的下降,但差异不显著,符合林启美等(2000)培养介质酸度升高是溶解磷矿粉的重要但不是必要条件的结论。
|
|
红树林独特的生态环境和丰富的生物多样性越来越引起国内外学者的关注。本文通过16S rDNA PCR-RFLP及序列测定的方法对华南地区红树林根际溶磷菌进行多样性的分析,发现分离出的溶磷菌存在着丰富的遗传多样性,且都具有较强的溶磷能力。
本研究表明:在红树植物根际中存在大量的溶磷菌,且存在土壤中的溶磷菌多于根表、根内。通过16S rDNA PCR-RFLP聚类结果对各亚群的代表菌株进行16S rDNA测序,3地红树植物根际分离的溶磷菌包括:Bacillus sp.,Paenibacillus sp.,Vibrio sp.,Klebsiella sp.和Shigella sp.,表现为华南红树林溶磷菌具有丰富的多样性,其中以Bacillus属为优势菌,并广泛分布于3地红树林中,与胡承彪等(1987)发现不同地区的红树林,土壤细菌以芽孢杆菌属占优势的结果一致。Vazquez等(2000)从墨西哥红树林根部分离出了9种溶磷细菌(B.amyloliquefaciens,B.atrophaeus,P. macerans,Xanthobacter agilis,Vibrio proteolyticus,Enterobacter aerogenes,E. taylorae,E. asburiae和Kluyvera cryocrescens),其中Bacillus属, Paenibacillus属和Vibrio属与本研究所鉴定的溶磷菌属的水平一致,而在种的水平上有明显的差异,表明在不同地域生物多样性存在差异。在华南3地红树林根际中,溶磷菌种属表现出明显的地域特征,如Klebsiella属仅在福田红树林发现,Vibrio sp.仅分离于东寨港红树林,而厦门大学引种园仅分离有Bacillus sp.的溶磷菌,而无其余种类的溶磷菌出现,表明溶磷菌的聚群与地域分布有明显的对应关系。引起菌种地域差异的主导因素有待深入研究。
用16S rDNA PCR-RFLP的方法,对24株溶磷菌进行聚类分析,在80%相似性水平上可分成7个亚群和1个独立分支,与各代表菌株在系统发育树上所处的分类地位一致。系统发育树分析发现:16S rDNA PCR-RFLP能准确地把24株溶磷菌在59%的相似水平上分成革兰氏阳性菌和革兰氏阴性菌2大类群;亚群4与独立分支SZ002在71%的相似水平上归为Paenibacillus属;亚群5、亚群6和亚群7在72%的相似水平上归为Bacillus属,证实了Laguerre等(1994)提出的RFLP分析能较好地预测16S rDNA序列结果。从16S rDNA序列构建的系统发育树得到代表菌株与已知参比菌株有很高的序列相似性(99%~100%),为红树林的溶磷菌的种类鉴定提供了有力的证据,仅依据16S rDNA基因分析等方法来确定其分类并不充分, 某些属于不同种的16S rDNA基因之间可能发生重组,因此, 需进一步进行如全细胞可溶性蛋白SDS-PAGE分析, DNA杂交等试验来进一步明确供试菌的具体种类。
Promod等(1987)发现海洋底泥中的磷细菌Vibrio sp.和Pseudomonas sp.在它们的对数生长期间, 可溶性磷的含量为0.50~0.55 mg·L-1。Craven等(1982)报道, 分离自海藻(Zostera marina)根际的1株未经鉴定的溶磷细菌的可溶性磷含量高达300 mg·L-1。本研究分离的各代表菌株均具有较强的溶磷能力,培养48 h后培养液中可溶性磷含量从21.68~86.89 μg·mL-1,与其他学者研究结果相比,溶磷能力处于中等水平。在对溶磷菌分离纯化过程中,发现随着转皿次数的增加,大部分菌株的溶磷圈直径逐渐减小,这一现象与Kucey(1983)发现在菌株纯化以及传代保存过程中有近50%的溶磷细菌失去其溶磷能力相似。微生物的溶磷机制现在还不完全清楚, 但多数研究认为是由于微生物分泌出有机酸(草酸、酒石酸、苹果酸、丙二酸等)(赵小蓉等,2003), 这些酸既能够降低pH值, 又可与Fe,Al,Ca,Mg等离子结合, 从而使难溶性磷酸盐溶解, 加速土壤中无效磷的有效化,增加土壤中磷对植物的供应。本研究分离的溶磷菌中,培养一段时间后,降低了培养基的pH值(3.87~5.44),但发现2者之间不存在显著的相关性关系,这可能与Agnihotri等(1970)发现微生物分泌的有机酸种类比数量更加重要有关。
曹启民, 郑康振, 陈耿, 等. 2008. 红树林生态系统微生物学研究进展. 生态环境, 17(2): 839-845. DOI:10.3969/j.issn.1674-5906.2008.02.075 |
杜春梅, 金术超, 王葳, 等. 2007. 无机磷分解菌BL-11的鉴定及其解磷能力研究. 微生物学通报, 34(2): 283-286. DOI:10.3969/j.issn.0253-2654.2007.02.020 |
胡承彪, 梁秀棠. 1987. 合浦滨海海滩森林土壤微生物区系及生化活性. 热带林业科技, (1): 1-7. |
林启美, 赵小蓉, 孙焱鑫, 等. 2000. 四种不同生态环境土壤中解磷细菌的数量及种群分布. 土壤与环境, 9(1): 34-37. DOI:10.3969/j.issn.1674-5906.2000.01.009 |
李文红, 施积炎. 2006. 西湖沉积物中解磷菌的分离纯化及其解磷能力. 应用生态学报, 17(11): 2112-2116. DOI:10.3321/j.issn:1001-9332.2006.11.023 |
龙寒, 向伟, 庄铁城, 等. 2005. 红树林区微生物资源. 生态杂志, 24(6): 696-702. |
万璐, 康丽华, 廖宝文, 等. 2004. 红树林根际解磷菌分离、培养及解磷能力的研究. 林业科学研究, 17(1): 89-94. DOI:10.3321/j.issn:1001-1498.2004.01.015 |
沈萍, 范秀容, 李广武. 1999. 微生物学实验. 北京: 高等教育出版社, 221.
|
许光辉, 郑洪元. 1986. 土壤微生物分析方法手册. 北京: 农业出版社, 187-189.
|
赵小蓉, 林启美, 李保国, 等. 2003. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系. 微生物学杂志, 23(3): 5-7. DOI:10.3969/j.issn.1005-7021.2003.03.002 |
Agnihotri V P. 1970. Solubilization of insoluble phosphates by some soil fungi isolated from nursery seedbeds. Can J Microbiol, 16: 877-880. DOI:10.1139/m70-148 |
Bashan Y, Holguin G. 2002. Plant growth-promoting bacteria:a potential tool for arid mangrove reforestion. Trees, 16: 159-166. DOI:10.1007/s00468-001-0152-4 |
Craven P A, Hayasaka S S. 1982. Inorganic phosphate solubilization by rhizosphere bacteria in a Zostera marina community. Can J Micro-biol, 28: 605-610. DOI:10.1139/m82-090 |
Kucey R M N. 1983. Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils. Canadian Journal of Soil Science, 63: 671-678. DOI:10.4141/cjss83-068 |
Laguerre G, Allard M R, Revoy F, et al. 1994. Rapid identification of rhizobia by restrietion fragment length polymorphism analysis of PCR-amPlified16S rDNA genes. Appl Environ Microbiol, 60: 56-63. |
Lin P. 1999. Mangrove ecosystems in China. Beijing and New York: Science Press, 1-7, 142-167.
|
Promod K C, Dhevendaran K. 1987. Studies on phosphobacteria in Cochin backwater. J Mar Biol Ass India, 29: 297-305. |
Vazquez P, Holguin G, Puente M E, et al. 2000. Phosphate-solubilizing microorganisms associated with the of mangroves in a semiarid coastal lagoon. Biol Fertil Soils, (30): 460-468. |
Wen P C, TsongT K. 1993. A simple and rapid method for preparation of gram-negative bacterial genomic DNA. Nucleic Acids Res, 21(9): 2260-2263. DOI:10.1093/nar/21.9.2260 |
 2009, Vol. 45
2009, Vol. 45