文章信息
- 王新建, 何威, 张秋娟, 王念, 祝亚军, 朱延林.
- Wang Xinjian, He Wei, Zhang Qiujuan, Wang Nian, Zhu Yajun, Zhu Yanlin
- 豫楸1号扦插生根过程中营养物质含量及氧化酶类活性的变化
- Change of Nutrient Content and Oxidase Activities during Rooting of Catalpa bungei cl.'Yu-1'
- 林业科学, 2009, 45(4): 156-161.
- Scientia Silvae Sinicae, 2009, 45(4): 156-161.
-
文章历史
- 收稿日期:2008-12-23
-
作者相关文章
2. 中南林业科技大学 长沙 410004;
3. 河南省退耕还林管理中心 郑州 450008
2. Central South University of Forestry and Technology Changsha 410004;
3. Henan Province Conversion of Farmland into Forest and Crude Forest Protection Project Management Center Zhengzhou 450008
楸树(Catalpa bungei)作为扦插难生根树种,普通扦插技术成活率一直很低,少见其扦插技术系统研究报道(郭从俭等,1993;梁明武,2002)。近年来,豫楸1号(C. bungei cl.`Yu-l')作为从楸树中选育的良种在全国范围内得到了大面积推广。但该品种主要通过嫁接繁殖,第1年培育砧木,第2年嫁接,繁育周期长、费用高,不利于良种迅速推广,制约这一优良品种的发展(王新建等,2005)。
插穗内的不定根孕育过程蛋白质的合成和核糖核酸的产生等新陈代谢活动增强。随着根的发育,去氧核糖核酸的形成和酶的含量也在生变化。研究表明:某些蛋白质在根原始体形成中起着特殊的作用,过氧化物酶能够造成某些阻碍插穗生根的抑制剂的破坏,而淀粉酶使淀粉转变为糖,作为各种合成过程的基质(Hassig, 1974)。多酚氧化酶(PPO)、过氧化物酶(POD)、吲哚乙酸氧化酶(IAAO)在植物的生长、发育中起重要的作用,这些酶与植物不定根的发生和发展有着密切的关系(Gaspar et al., 1982;Kieliszew,1989;Al Barazi et al., 1984;Haissig,1974;Bouillenne et al., 1955;Bassuk et al., 1981)。笔者在探索出豫楸1号最佳扦插技术模式基础上(王新建等,2008),对其扦插阶段的营养物质(可溶性蛋白质、总糖、总糖/全氮)、氧化酶类(IAAO、POD、PPO)等生理生化指标的变化进行研究,以期阐明豫楸1号的平埋复幼扦插生根机制,为加快这一良种的推广提供理论基础及技术保障。
1 材料与方法 1.1 试验材料试验在河南省林业科学研究院郑州试验林场全光照自动喷雾大棚内进行,试验材料为该林场1年生豫楸1号健壮幼苗。
1.2 试验方法1)沙藏及催芽处理 2007年1月采集大田1年生健壮、无病虫害的豫楸1号平茬苗干于背风向阳处进行沙藏处理后,3月14日起在温棚催芽池中进行催芽处理。温棚催芽池长5.85 m、宽1.35 m、高37 cm,底铺煤渣厚17 cm,上铺腐熟的干鸡粪与细河沙(1:3混合均匀)6~10 cm,在混合层上撒施一层3~5 cm厚的细沙,在上面撒施25%多菌灵药粉,用量为10 g·m-2,均匀撒施,喷1次清水。将苗干按粗细长短分级平摆在温棚催芽池内,密度为苗干间隔约2~3 cm。然后根据苗干的粗度覆盖湿润细沙3~5 cm,进行保温保湿催芽,定时观测棚温与床畦温度,使其保持在床畦温度12~25 ℃,棚温15~30 ℃,相对湿度75%~80%。
2)扦插处理及取样方法 待催芽池中平埋苗干新生嫩枝长至12~15 cm高,5~8片真叶时,将嫩枝带芽基掰下用500 mg·L-1吲哚丁酸+萘乙酸(2:1)混配溶液速蘸处理后在温棚内蛭石基质中扦插,1年生豫楸1号大田自然生长干条同期所生幼枝采取同样处理作为对照。按照完全随机区组试验设计,3次重复,每重复500根插穗。取样方法:取出插穗后立即放入冰盒或冰水混合物中,带回实验室将插穗用清水冲掉泥沙等杂物,擦去水珠后剥取根部2 cm的韧皮部,剪碎,迅速放入冰箱备用。每4天采样1次,每次采30株插穗。
1.3 测定指标及方法总糖的测定参照杨晓华等(2006)的方法测定;可溶性蛋白、吲哚乙酸氧化酶(IAAO)、全氮的测定参照张志良(2003)的方法测定;多酚氧化酶(PPO)的测定参照Park等(1980)的方法测定;过氧化物酶(POD)的测定参照李合生(2000)的方法测定。室内试验在河南省林木种质资源保护与良种选育重点实验室完成,重复3次。
1.4 数据分析利用EXCEL绘图,用SPSS13.0统计软件进行方差分析。
2 结果与分析 2.1 豫楸1号扦插生根率的差异平埋催芽抽生嫩枝插穗生根率最高可达91.24%,平均生根率为90.33%(表 1)。生根植株不定根根数范围为1~18条,平均根数为9条;不定根根长范围为0.4~12.3 cm,平均根长为4.5 cm,大田自然生长插穗生根率仅为22.53%,2种处理生根率差异极显著(P < 0.01)。
|
|
从4月19日至5月9日对大田自然生长和平埋催芽抽生嫩枝进行外部形态观察发现:无论是大田抽生嫩枝还是平埋催芽抽生嫩枝的插穗均在8天左右切口出现愈伤组织,12天左右愈伤组织大量出现并膨大,16天左右平埋催芽抽生嫩枝基部表皮出现不定根。对照在12天后基部开始部分腐烂,地上部分萎蔫,20天后大量死亡。从生根部位看,生根插穗全为皮部生根,因此豫楸1号扦插生根为皮部生根类型。结合形态观察分析认为:不定根的形成大致可以划分为5个阶段:1) 0~4天,个别产生愈伤组织,无明显变化(变化不明显期);2) 4~8天,平埋催芽抽生嫩枝大量产生愈伤组织,大田抽生嫩枝部分产生愈伤组织(愈伤组织形成期);3) 8~12天,平埋催芽抽生嫩枝愈伤组织继续膨大,并且少量从皮孔处生根,大田抽生嫩枝部分愈伤组织继续膨大,部分开始从基部腐烂(愈伤组织膨大期);4) 12~16天,平埋催芽抽生嫩枝大量从皮孔处生根,根伸长生长,大田抽生嫩枝大部分从基部腐烂变黑,地上部分开始萎蔫(生根期);5) 16~20天,平埋催芽抽生嫩枝地下部分继续从皮孔处生根,根伸长生长,地上部分抽出新叶,大田抽生嫩枝大部分死亡(根伸长期)。
2.3 豫楸1号扦插生根过程中营养物质含量变化可溶性蛋白质虽只占蛋白质的一部分,但是生物体能吸收利用的主要是可溶性蛋白质,在生命活动中发挥着运输协调、免疫保护、产生和传导神经活动、控制生长分化等功能,并且能够构成细胞的膜系统。测定其含量是了解植物体总代谢的一个重要指标。
1)豫楸1号扦插生根过程中可溶性蛋白含量变化 整个扦插阶段,大田自然生长嫩枝比平埋催芽抽生嫩枝的可溶性蛋白含量低。处理期间变化趋势是先下降,在扦插后的第8天,分别达到了最低值,然后升高,扦插后第16天达到峰值,之后趋向平稳下降(图 1)。经方差分析,二者间差异不显著(P>0.05)。

|
图 1 插穗内可溶性蛋白质含量变化 Figure 1 Soluble protein content change in ear -◆-大田抽生嫩枝Natural growth softwood; -■-催芽抽委嫩枝Stratification growth softwood.下同The same below. |
结合外部形态观察可知,在0~8天愈伤组织产生期,无论是催芽抽生嫩枝还是大田抽生嫩枝都大量消耗可溶性蛋白用以产生愈伤组织,导致可溶性蛋白含量急剧下降。8~16天,催芽抽生嫩枝愈伤组织膨大生长,并且部分开始生根,可溶性蛋白含量稍有上升;而大田抽生嫩枝在此期间则大部分逐渐从基部腐烂,地上部分萎蔫,整株茎和根的活动相对极弱,从而导致可溶性蛋白含量的急剧升高,这与田维敏(2002)的理论完全一致。16~20天根伸长期,催芽抽生嫩枝根系生长,地上部分抽生嫩叶,可溶性蛋白含量略有下降,大田抽生嫩枝则大量死亡。
2)豫楸1号扦插生根过程中总糖含量变化 插穗生根时需要一定的营养物质,一般脂肪利用较少,而碳水化合物和氮素化合物则利用较多。
总糖含量测定结果表明:催芽抽生嫩枝总糖含量明显高于大田抽生嫩枝(图 2)。大田抽生嫩枝总糖含量在扦插的前12天变化不明显,12天后有所上升;催芽抽生嫩枝的总糖含量总体呈先上升后下降趋势,扦插前16天持续上升,此后急剧下降。方差分析表明:两者间差异达到极显著水平(P < 0.01)。结合形态观察可知:在扦插的前16天愈伤组织形成期、愈伤组织膨大期、皮部生根期催芽抽生嫩枝总糖含量迅速增加,此时总糖含量的增加可能是因为其自身储藏的淀粉转化为总糖的速度大于总糖消耗的速度,因此呈现上升趋势。前人研究表明:用激素处理可使插穗内某些酶的活性增加,淀粉和蛋白质的水解产物增加,原生质的粘性降低,有利于根原始体的诱导和形成(梁玉堂,1993)。16天后进入根伸长期,催芽抽生嫩枝体内积聚的总糖含量减少,可能是由于此时淀粉转化及光合作用制造总糖的速度小于根伸长生长所消耗的总糖的速度所致,本试验与前人结果一致(李玲,1997)。大田抽生嫩枝总糖含量在扦插12天后有所增加,这可能是其自身储藏的淀粉在植株死亡前大量转化为糖类物质用以延续生命,导致总糖含量的急剧增加。从而印证逆境下植物体内淀粉等储藏物质转化成糖的应急反应(王凤宝等, 2006)。

|
图 2 插穗内总糖含量变化 Figure 2 Total sugar content change in ear |
3)豫楸1号扦插生根过程中全氮、全糖/全氮的变化 通过扦插生根过程中全氮含量测定结果可知(表 2):在扦插期间大田抽生嫩枝的全氮含量变化时高时低,规律不明显,催芽抽生嫩枝体内的全氮含量总体呈降低趋势,整个扦插阶段仅减少0.36%,这可能是可溶性蛋白在扦插生根过程中转化或分解的结果。
|
|
从扦插阶段的总糖/全氮值可以看出:2种处理变化趋势与其总糖变化趋势相同,而全氮在处理期间变化不大,所以总糖/全氮值的变化主要是由总糖变化造成的。方差分析表明:扦插期间催芽抽生嫩枝体内总糖/全氮值显著高于大田自然生长的1年生枝,且达到显著水平(P < 0.05)。
2.4 豫楸1号扦插生根过程中氧化酶类活性的变化POD,PPO,IAAO与植物不定根的发生和发展有着密切的关系,IAAO能降解IAA,调节植物体内的IAA水平,从而影响植物的生长发育(Kieliszew,1989;Devi et al., 1996)。IAAO活性的变化与根的生长有着密切的联系,且POD与IAAO活性变化呈相似规律(Bagatharia et al., 1998)。PPO活性对不定根的形成是十分重要的(Al Barazi et al., 1984)。“生长素-酚”的缩合物(生根素)是在POD,PPO以及其他酶的作用下形成的。不定根的起源和生长与这3种氧化酶有着密切关系。
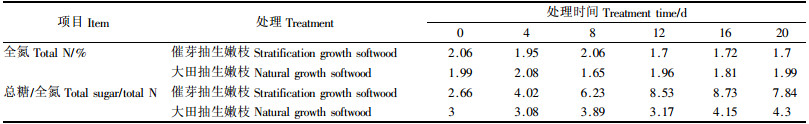
1)吲哚乙酸氧化酶(IAAO)活性变化 大田抽生嫩枝IAAO活性明显低于催芽抽生嫩枝(图 3);无论是催芽抽生嫩枝还是大田抽生嫩枝IAAO活性在扦插的前8天均逐渐上升;催芽抽生嫩枝在8~12天IAAO活性有下降趋势,12~16天急剧上升然后又急剧下降。大田抽生嫩枝在扦插的前16天缓慢上升,然后急剧下降。方差分析表明:两者之间差异极显著(P < 0.01),不同天数之间IAAO活性差异也达到了极显著水平(P < 0.01)。在扦插的前8天愈伤组织形成期IAAO活性缓慢上升,高活性的IAAO有利于降低内源IAA活性,促进愈伤组织的形成;催芽抽生嫩枝在8~12天愈伤组织膨大期,IAAO活性明显下降,可见在皮部生根前IAAO的瞬时低谷有利于豫楸1号生根(Hausman,1993;Jay-allemand et al., 1995)。在12~16天生根期间,IAAO活性急剧上升,高活性的IAAO降低体内的IAA含量,有利于豫楸1号生根;在16~20天根伸长期间要求较高浓度的IAA以促进根的伸长和生长,IAAO活性则明显降低,这与前人研究完全一致(宋金耀等,2001)。大田抽生嫩枝IAAO活性在扦插的前16天均缓慢上升,但上升幅度很小,随后急剧下降。这可能是IAAO在愈伤组织形成过程中起到一定的作用,但是由于大田抽生嫩枝长期不生根,并且在12~16天期间大部分开始从地下部分腐烂,地上部分萎蔫,从而导致IAAO活性的持续升高,16~20天大田抽生嫩枝大部分死亡,从而导致IAAO活性的急剧下降。
|
图 3 插穗内吲哚乙酸氧化酶活性变化 Figure 3 IAAO activity change in ear |
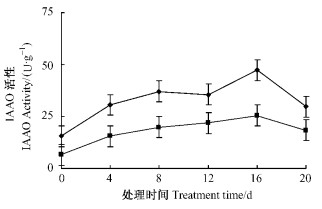
2)过氧化物酶(POD)活性变化 POD活性在插穗生根不同时期呈现的规律性变化(图 4)。整个扦插阶段,催芽抽生嫩枝POD含量明显高于大田抽生嫩枝;催芽抽生嫩枝POD活性在扦插后0~4天上升,4~8天下降,8~12天上升,12~16天下降,16天后持续上升;大田抽生嫩枝中POD活性在扦插后前16天变化不明显,16天后急剧上升。两者之间POD活性差异达到显著水平(P < 0.05),不同天数之间POD活性差异也达到显著水平(P < 0.05)。已有研究发现:POD活性在扦插生根过程中会出现2个高峰(宋金耀等, 2001;Gebhardt,1982),分别参与根的诱导及表达,POD作用的某些产物可能是不定根发生和发展所必须的辅助因子,促进不定根的形成。扦插初期到第1个高峰(前4天)是根的诱导期,POD活性的上升氧化IAA,消除体内过多的内源IAA,有利于诱导根原基发育。其后4~8天,POD活性下降,导致体内IAA含量上升,有利于不定根的表达,这与李明等(2000)研究桉树(Eucalyptus)的结论类似。第8~12 d的肩峰与根的表达有关,短期产生不定根。12~16天生根期间,此时POD活性缓慢下降,促进不定根的形成。根伸长期间POD活性由急剧增加,以促进根伸长生长。
|
图 4 插穗内过氧化物酶活性变化 Figure 4 POD activity change in ear |
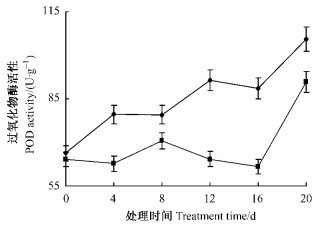
3)多酚氧化酶(PPO)活性变化 无论是催芽抽生嫩枝还是大田抽生嫩枝PPO活性在整个扦插阶段均呈现出先上升后下降的趋势(图 5)。催芽抽生嫩枝PPO活性明显高于大田抽生嫩枝;催芽抽生嫩枝PPO活性在扦插前4天上升,4~8天平缓下降,8~12天上升,达到峰值后平缓下降;大田抽生嫩枝则在0~8天缓慢上升,8~16天急剧上升,随后急剧下降。催芽抽生嫩枝与大田抽生嫩枝间PPO活性差异显著(P < 0.05)。催芽抽生嫩枝PPO活性在第4天出现第1个小高峰,这是愈伤组织产生的前兆,在第12天出现了第2个高峰,此时正是愈伤组织膨大和皮孔生根的交错期,PPO活性的增加参与合成大量的生根辅助因子,有利于根源基的发育和不定根的诱导,促进不定根的形成。PPO活性下降,促进不定根伸长。而大田抽生嫩枝插穗中PPO活性在扦插初期较低,合成的生根辅助因子少,不利于根的诱导,在不定根表达期(16天)达到了高峰,愈伤组织越来越多,大量的愈伤组织抑制了插穗生根,在不定根伸长期(16~20天),PPO活性急剧下降,愈伤组织逐渐老化、腐烂,从而抑制不定根的表达。
|
图 5 插穗内多酚氧化酶活性变化 Figure 5 PPO activity change in ear |
通过对豫楸1号1年生苗干催芽抽生嫩枝扦插试验发现,其扦插生根类型属于皮部生根型。插穗生根时需要一定的营养物质,一般脂肪利用得少,而碳水化合物和氮素化合物则利用得多。许多试验证明:发育良好粗壮的插穗进行扦插比生长较差纤细的插穗容易生根。采用曲枝、环剥及刻伤等方法处理插穗,其生根率大大提高。这说明插穗内的营养物质对根原始体的分化有重要意义。豫楸1号在扦插进行到第8~16天期间,正是插穗从愈伤组织膨大向根诱导期发展阶段,是决定插穗是否生根的关键时期,催芽抽生嫩枝插穗体内的可溶性蛋白含量、总糖含量均持续增加,而大田抽生嫩枝体内这2种指标变化不显著,总糖含量甚至有所下降。大田抽生嫩枝插穗虽然产生大量的愈伤组织,但最未能大量生根,可能与此有关。由此可认为充足的营养物质为插穗的生根提供有力的物质保障。自Kraybill(1923)以番茄为试材报道了C/N值与生根的关系以来, C/N值高时能促进生根的情况有许多试验报告,均认为插穗生根与碳水化合物(C)和含氮化合物(N)的比率有关,C/N比率高,则生根率高(王立,1993;Kim et al., 1995)。本研究中豫楸1号催芽抽生嫩枝内总糖/全氮值在愈伤组织膨大期和根诱导期持续上升,与大田抽生嫩枝差异达到显著水平,这与前人研究结果完全一致,说明催芽抽生嫩枝能够大量生根与插穗体内的营养物质含量的高低存在密切关系。
IAAO是分解IAA的专一性酶,有人认为它属于POD同工酶的一种,该酶利用O2对IAA进行氧化,试验表明:离体生根过程中,高活性的IAAO使内源IAA水平降低是生根诱导期的特点之一(Gaspar et al., 1982)。Nag等(2001)、Gyana(2006)、曹帮华等(2008)等也认为易生根插条内的IAAO可以氧化IAA,而难生根的IAAO活性较高,IAA被破坏较多,向下输送的IAA含量很少,因而对诱导生根不利。催芽抽生嫩枝体内的IAAO活性在8~16天时出现降-升的过程,在根诱导期其活性明显增加。在此期间,大田抽生嫩枝体内的IAAO活性虽然增加,但总的来说还是远低于催芽抽生嫩枝的IAAO活性。因此,后者有足够的IAAO活性来减少IAA含量,从而诱导插穗产生大量的新根。
POD是普遍存在于植物体内的含铁卟啉辅基的酶,它参与植物体内的多种生理生化过程,与一些高等植物的发育进程有密切关系,在细胞分化发育中有重要作用(Kieliszew,1989)。POD能够造成某些阻碍插穗生根的抑制剂受到破坏,Garspar等(1992)等将其视为生根标志之一,同时高等植物中普遍存在,它是一种含铜的酶,不仅在植物的生长、发育中起重要的作用,而且对植物的器官形态建成也起到非常重要的作用(Al Barazi,1984)。在插条生根过程中,PPO的一个重要生理功能就是催化酚类物质与IAA形成一种“IAA-酚酸复合物”(Haissig,1974;Bouillenne et al., 1955),这种复合物是一种生根辅助因子,具有促进不定根形成的活性(Bassuk et al., 1981)。本试验进行到8~16天时,催芽抽生嫩枝的POD,PPO活性有明显升-降过程,这2种酶活性的升高,破坏、分解某些抑制生根的物质,或者利用抑制生根物质合成转化为促进生根的复合物,从而极大地提高扦插生根率。大田插穗嫩枝体内POD活性一直呈现下降趋势,PPO活性尽管持续增加,但其活性明显低于催芽抽生嫩枝,这说明POD,PPO活性的增加,能够显著提高插穗的生根率。
研究表明:催芽抽生嫩枝插条在根诱导期可溶性蛋白含量、总糖含量、总糖/全氮值及IAAO、POD、PPO活性均大幅度上升,这些物质在生根过程中的作用可能是既相互独立又相互联系的,通过相互作用来共同影响生根。
曹帮华, 扈红军, 张大鹏, 等. 2008. 桑树硬枝扦插生根能力及其生根关联酶活性的研究, 蚕业科学, 34(1): 96-100. 蚕业科学, 34(1): 96-100. DOI:10.3969/j.issn.0257-4799.2008.01.019 |
郭从俭, 刘梅花, 张新胜, 等. 1993. 楸树扦插繁殖技术研究. 河南农业大学学报, (4): 380-384. |
李合生. 2000. 植物生理生化实验原理和技术. 高等教育出版社.
|
李玲. 1997. GT生根剂对扶桑扦插生根及碳水化合物分配的影响. 园艺学报, 24(1): 71-74. DOI:10.3321/j.issn:0513-353X.1997.01.014 |
李明, 谭绍满. 2000. 难易生根桉树的过氧化物酶活性及其同工酶多型性比较研究. 华南农业大学学报, 21(3): 59-62. |
梁明武. 2002. 楸树嫩枝扦插繁育技术研究. 河北林业科技, (5): 12-15. |
梁玉堂. 1993. 树木营养繁殖原理和技术. 北京: 中国林业出版社.
|
宋金耀, 何文林, 李松波, 等. 2001. 毛白杨嵌合体扦插生根相关理化特性分析. 林业科学, 37(5): 64-67. DOI:10.3321/j.issn:1001-7488.2001.05.011 |
田维敏.2002.树木营养贮藏蛋白质的细胞学、生物化学和生物学功能的研究.西安: 西北大学植物研究所. http://cdmd.cnki.com.cn/Article/CDMD-10697-2002070775.htm
|
王凤宝, 付金锋, 董立峰, 等. 2006. 多酚氧化酶活性与小麦抗穗发芽的关系及抗穗发芽新品种秦麦3号的选育. 麦类作物学报, 26(5): 97-100. DOI:10.3969/j.issn.1009-1041.2006.05.022 |
王立. 1993. 茶树扦插生根的理论与实践. 中国茶叶, 15(b): 2-4. |
王新建, 严东波, 侯俊霞, 等. 2008. 豫楸1号扦插技术模式研究. 河南林业科技, 28(3): 1-5. DOI:10.3969/j.issn.1003-2630.2008.03.001 |
王新建, 张秋娟, 方芳, 等. 2005. 楸树新品种——豫楸1号研究. 河南林业科技, (4): 26-30. DOI:10.3969/j.issn.1003-2630.2005.04.012 |
杨晓华, 于广利, 赵峡, 等. 2006. 灰树花糖蛋白中总糖含量的测定. 中国海洋大学学报:自然科学版, (6): 929-931. |
张志良. 2003. 植物生理学实验指导. 2版. 北京: 高等教育出版社.
|
Al Barazi Z, Schwabe W W. 1984. The possible involvement of polyphenol-oxidase and the auxin-oxidase system in root formation and development in cuttings of Pistacia vera. J Hort Sci, 59(3): 453-461. DOI:10.1080/00221589.1984.11515218 |
Bagatharia S B, Chanda S V. 1998. Changes in peroxidase and IAA oxidase activities during cell elongation in Phaseolus hypocotyls. Aeta Physiol Plant, 20(1): 9-13. DOI:10.1007/s11738-998-0037-x |
Bassuk N L, Hunter L D, Howard B H. 1981. The apparent of polyphenol oxidase and phloridzin in the production of apple rooting cofactors. J Hort Sci, 56(4): 313-322. DOI:10.1080/00221589.1981.11515007 |
Bouillenne R, Bouillenne-Walrand M.1955. Auxines et bouturages. Proc 14 Int Hort Cong.
|
Devi S R, Prasad M N V. 1996. Ferulic acid mediated changes in oxidative enzymes of maize seedings implication in growth. Biol Plant, 38(3): 387-395. DOI:10.1007/BF02896668 |
Garspar T, Kevers C, Hausman J F, et al. 1992. Total practical uses of peroxidase activity as a predictive maker of rooting performance of micropropagation. Agronomic, 12: 757-765. DOI:10.1051/agro:19921003 |
Gaspar T, Penel C L, Thorpe T, et al. 1982. A survey of their biochemical andphysiological roles in higher plants. Geneva Switzerland: Univ Geneva, 83-88.
|
Gebhardt K. 1982. Activation of indole-3-acetic acid oxidase from horser adish and prunus by phenols and hydrogen peroxide. Plant Growth Regul, 1(2): 73-84. DOI:10.1007/BF00024500 |
Gyana R R. 2006. Effects of auxins on adventitious root development fromsingle node cuttings of Camellia sinensis(L.)Kuntze and associated biochemicalchanges. Plant Growth Regulation, 48: 111-117. DOI:10.1007/s10725-005-5665-1 |
Haissig B E. 1974. Influence of auxins and synergists on adventitious root primordium in initiation and development. New Zealand J For Sci, 4: 311-323. |
Hausman J A. 1993. Contingent valuation: A Critical Assessment. Contributions to Economic Analysis No.220, Amsterdam: North-Holland.
|
Jay-allemand C, Capelli P.1995.International new advanced in hybrid walnut micropropagation (Juglans nigra×Julans regia).Walnut Congress, 13-16.
|
Kieliszew ska-Rokicha B. 1989. Effect of treating scots pine (Pinus sylvestris L.) seedlings with phytohorm one on the growth of the root system and on the peroxidase and IAA oxidase enzyme activities in roots. Arbortum-Kornckie, 32: 207-219. |
Kim J W, Kim T S. 1995. Rooting promotion in cutting propagation of tea. Korean Journal of Medicinal Crop Science, 3(3): 195-199. |
Kraybill H R. 1923. Efect of shading and tifing upon chemical composition of apple and peach trees. New Hampshire Agir Expt Sta, Techn Bull, 23: 8-27. |
Nag S, Saha K, Choudhuri M A. 2001. Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting. J Plant Growth Regul, 20: 182-194. DOI:10.1007/s003440010016 |
Park Y K, Sato H H, Almeid T D, et al. 1980. Polyphenol oxidase of mango (Mangifera indica var. Haden). J Food Sci, 45: 1619-1621. DOI:10.1111/jfds.1980.45.issue-6 |
 2009, Vol. 45
2009, Vol. 45