文章信息
- 高志民, 刘成, 刘颖丽, 彭镇华.
- Gao Zhimin, Liu Cheng, Liu Yingli, Peng Zhenhua
- 毛竹捕光叶绿素a/b结合蛋白基因cab-PhE1的克隆与表达分析
- Cloning and High Prokaryotic Expression of the Light Harvesting Chlorophyll a/b-Binding Protein Gene from Bamboo (Phyllostachys edulis)
- 林业科学, 2009, 45(3): 145-149.
- Scientia Silvae Sinicae, 2009, 45(3): 145-149.
-
文章历史
- 收稿日期:2008-03-13
-
作者相关文章
2. 中国科学院植物研究所 北京 100093;
3. 中国林业科学研究院林业研究所 北京 100091
2. Institute of Botany, the Chinese Academy of Sciences Beijing 100093;
3. Research Institute of Forestry, Chinese Academy of Forestry Beijing 100091
光合作用是地球上生命现象的基础,高等植物光合作用光能的捕获与传递主要是通过捕光色素蛋白复合体(LHCⅠ,LHCⅡ)来完成的,其中LHCⅡ是绿色植物叶绿体类囊体中含量最丰富的一种天线蛋白(孙钦秒等,2000a)。LHCⅡ的多肽主要是由lhcb1,lhcb2,lhcb3,lhcb4,lhcb5和lhcb6六种同源性较高的核基因编码,它们分别与色素非共价结合形成LHCB1,LHCB2,LHCB3,LHCB4,LHCB5和LHCB6色素蛋白复合体来行使光能传递、转化、分配等功能(Klimmek et al., 2006; Liu et al., 2008)。随着电子晶体学研究方法的发展,对LHCⅡ复合体的晶体结构的分析日趋深入(徐伟等, 1998;Liu et al., 2004),对其功能的研究倍受关注。
LHCⅡ是一个重要的膜蛋白,在植物光合作用过程中起着关键的作用。从基因的分离、光调控表达、其编码蛋白前体运输到叶绿体的过程、对激发能在2个光系统之间的分配及类囊体膜超微结构的调控,以及蛋白质的磷酸化和色素与蛋白的重组等诸多方面,并作为模型系统,对LHCⅡ进行了广泛的研究(Caffarri et al., 2004),这为开展竹子的相关研究提供了良好的借鉴。已有的研究表明,通过在大肠杆菌内表达的色素蛋白与色素在体外可以进行重组,并且所获得的色素蛋白复合体在色素的组成和光谱特性上都与天然的LHCⅡ非常相似,并且其晶体的结构与天然的LHCB1的结构也基本一致(Paulsen et al., 1990; 孙钦秒等,2000b)。因此,通过在大肠杆菌中表达LHCB蛋白是研究其结构和功能的一种有效途径。
竹子具有生长快、产量高等特点,竹笋可以食用,竹竿可以材用,是木材的有益补充(江泽慧,2002)。本研究以重要的经济竹种毛竹(Phyllostachys edulis)为材料,利用RT-PCR的方法从中克隆到lhcb2类基因cab-PhE1,并将cab-PhE1基因编码成熟蛋白的序列部分插入到载体pET-32a的相应位点,构建成原核表达载体pET-cab-PhE3-mature,在大肠杆菌BI21(DE3)中诱导表达,以期为研究竹子捕光叶绿素a/b结合蛋白与色素的体外重组特性奠定基础,从而进一步揭示竹子光合作用的分子机制,为人类有效开发和永续利用竹子提供理论依据。
1 材料与方法 1.1 植物材料用购自江西省柳州地区的毛竹种子播种,培养成盆栽实生苗存于国家林业局竹藤科学与技术重点开放实验室的培养间,取其新鲜叶片用于试验。
1.2 总RNA提取与cDNA合成采用Invitrogen公司的Trizol reagent提取毛竹实生苗幼嫩新鲜叶片的RNA(Gao et al., 2006),用Promega公司的反转录试剂盒合成cDNA。
1.3 基因的克隆、测序与分析根据绿竹捕光叶绿素a/b结合蛋白基因家族中的同源基因序列(高志民等, 2007)设计PCR引物,引物1:5′-ATGGCCGC GTCGGCGCTGC-3′和引物2:5′-TCACTTCCCTGGG ACGAAG-3′;由上海生工生物工程技术服务有限公司合成。以毛竹cDNA为模板,进行梯度PCR。引物1和引物2反应条件为:94 ℃,5 min;94 ℃ 1 min,55~65 ℃ 1 min,72 ℃ 1.5 min,35个循环;72 ℃延伸10 min。PCR产物克隆到pGEM-Teasy载体检测后,送北京三博远志科技有限公司测序。利用DNASTAR、SMART和Clustl W等生物软件分析测定的cDNA序列及其编码蛋白质的结构特点,并与国际核酸和蛋白质数据库联网进行blast比较分析。
1.4 cab-PhE1基因的组织特异性表达检测以毛竹Actin基因(FJ601918)作内标,利用RT-PCR法确定cab-PhE1基因在不同器官中的表达量。PCR反应条件:94 ℃,5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,28个循环;72 ℃延伸10 min。
1.5 cab-PhE1基因重组表达载体的构建根据cab-PhE1基因编码成熟的序列和原核表达载体(pET-23a)的多克隆位点,采用直接添加酶切位点的方法设计了引物7:5′- catatgGCGACCACCACCATGA -3′和引物8:5′- ctcgagCTTGCCGGGCACGAAG -3′,引物8不带终止密码子,以保证与His\5Tag的正常衔接。选用了NheⅠ和XhoⅠ双酶切将目的基因片段插入到pET-23a的多克隆位点,形成重组表达载体。
1.6 cab-PhE1基因的原核表达将cab-PhE1基因的重组质粒应用电转化法转入感受态细胞BL21(DE3),选取单克隆,经菌落PCR检测后,培养过夜。再将细菌100倍稀释于含氨苄青霉素的LB培养基中,待菌液生长至A600为0.6~0.8时,加入IPTG进行诱导培养后,收集菌体进行蛋白电泳分析。
2 结果与分析 2.1 基因的克隆与分析以毛竹cDNA为模板,引物1和引物2的PCR产物在1%的琼脂糖凝胶中电泳,EB染色结果显示,在800 bp左右有一条亮带(图略),与预测的基因片段基本相符,初步确定为目的基因片段。用上海申能博彩生物科技有限公司试剂盒回收PCR产物,按照Promega的pGEM-T easy载体快速连接试剂盒操作流程,将回收的DNA片段加A后连接到载体上,转化大肠杆菌(Escherichia coli)DH5α菌株,经蓝白斑筛选,提取阳性克隆质粒并酶切图谱分析后,送北京三博远志科技有限公司测序。
测序结果表明,插入片段包含一个完整的编码区,编码263个氨基酸(GeneBank No. EF207229)。进一步分析表明,EF207229序列的编码区第62-230位包含典型的捕光叶绿素a/b结合蛋白功能域,第34-36,38-40,232-234位为蛋白激酶C的磷酸化位点,第214-217位为氮糖基化位点,203-206位为酪氨酸激酶Ⅱ磷酸化位点,30-35,106-111,120-125,176-181位为N-豆蔻酰化位点,34-36,38-40,232-234位为蛋白激酶C的磷酸化位点。cab-PhE1基因编码的蛋白的等电点和分子质量分别为5.44和28 460.34 u。该基因命名为cab-PhE1 (cab gene 1 from Ph. edulis)。应用Blast在线软件将cab-PhE1的序列与已报道的基因进行同源性比较,结果显示cab-PhE1基因属于lhcb2类基因家族,编码捕光叶绿素a/b结合蛋白。经在线软件(http://www.cbs.dtu.dk/services/chloroP/)预测,其编码的氨基酸第1-34为导肽,之后为成熟蛋白(图 1)。

|
图 1 cab-PhE1编码区核酸序列及其推导出的氨基酸序列 Figure 1 Nucleotide sequence and deduced amino acids sequence of cab-PhE1  导肽Precursor; 导肽Precursor; 成熟蛋白Mature protein. 成熟蛋白Mature protein. |
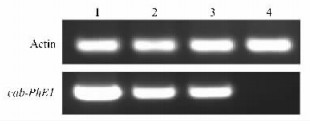
提取毛竹叶片、叶鞘、幼茎和根的RNA,反转录成cDNA第一链,毛竹Actin基因作内标,调整cDNA用量和循环数,使内标基因的表达丰度一致。以调整后的cDNA模板量进行cab-PhE1基因的扩增。结果(图 2)表明:cab-PhE1基因在叶片、叶鞘、幼茎均有表达,其中在叶片中的表达丰度最高,在叶鞘和幼茎中的表达比较接近;而在根中几乎检测不到表达。
|
图 2 cab-PhE1基因的RT-PCR分析 Figure 2 RT-PCR analysis of cab-PhE1 gene 1:叶片Leaf; 2:叶鞘Sheath; 3:幼茎Stem; 4:根Root. |
采用高保真酶(pyrobest polymerase)进行PCR。扩增产物的凝胶电泳显示,引物7和引物8的产物在700 bp左右有一条清晰的亮带(图省略),与预测的基因片段相符。将回收的DNA片段加A后连接到T-easy载体后测序,结果表明插入片段为705 bp,包含酶切位点NheⅠ和XhoⅠ和成熟蛋白的编码区。以pET23a为载体,用NheⅠ和XhoⅠ双酶切,将cab-PhE1基因编码成熟的序列部分(cab-PhE1-mature)直接插入到pET23a载体的多克隆位点,即构建了含有T7启动子、cab-PhE1-mature、组氨酸序列标签(His·5Tag)的原核表达载体pET-cab-PhE1-mature(图 3)。对重组质粒进行酶切检测(电泳图略)验证后,电击入感受态细胞BL21(DE3),用于蛋白的诱导表达。

|
图 3 原核表达载体pET-cab-PhE1-mature Figure 3 Prokaryotic expression vector pET-cab-PhE1-mature |
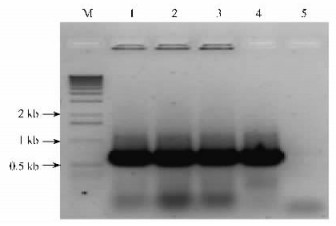
以cab-PhE1基因重组表达载体的单克隆菌落为模板,用引物3和引物4进行检测,同时以重组质粒和水为对照。菌落PCR产物的电泳结果(图 4)表明,单克隆菌落含有目的基因片段,可用于下一步试验。
|
图 4 单克隆菌落PCR电泳结果 Figure 4 PCR products with single clony checked by electrophoresis 1, 2, 3:单克隆菌落Single clony product;4:质粒对照Plasmid control;5:水对照H2O control;M:1 kb分子量标记1 kb molecular marker. |
按照文献方法(Liu et al., 2008)接种单克隆,分别在25、30、37 ℃条件下培养,至A600为0.6~0.8时,加入IPTG进行诱导培养4 h后,收集菌体,用1%的SDS剧烈振荡破菌后,离心,上清电泳分析显示(图略),重组蛋白均能被IPTG诱导,其诱导表达的蛋白分子质量约为28.0 ku,与LHCB1的结构模型相一致(Kühlbrandt et al., 1994),但是不同温度间差异不明显。
选用37 ℃培养,在诱导培养时分别加入IPTG(终浓度)10,25,30,35,40,45,50,100,1 000 μmol·5L-1,结果显示随着IPTG浓度的增加重组蛋白的表达量明显呈现下降趋势(图略),其中以加入(终浓度)10 μmol·L-1IPTG样品的表达效果最好,重组蛋白表达量高,非目的蛋白表达量最低。
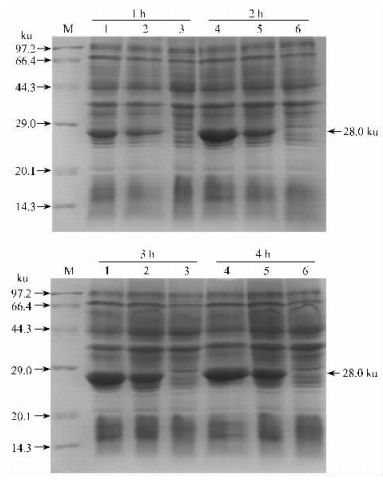
以含有空载体质粒(pET23a)的克隆为对照,相同培养条件下(37 ℃,240 r·min-1)培养3 h后,用10 μmol·L-1 IPTG(终浓度)进行诱导培养(37 ℃,170 r·min-1),分别在诱导1, 2, 3, 4 h后取样进行蛋白电泳分析,结果(图 5)显示含有重组质粒载体的克隆,其目的蛋白(28.0 ku)的表达量随着时间的延长是明显增加的,且经IPTG诱导的目的蛋白的表达丰度非常高;而对照pET23a在28.0 ku没有条带,进一步说明了表达产物的正确性。
|
图 5 pET-cab-PhE1-mature在大肠杆菌中的表达 Figure 5 Expression of pET-cab-PhE1-mature in E. coli 1, 4:阳性克隆加IPTG诱导Positive clone induced by IPTG;2, 5:阳性克隆不加IPTG的对照Positive clone control without IPTG;3, 6:加IPTG诱导的pET23a对照pET23a induced by IPTG;M:蛋白质分子质量标记Protein marker. |
cab-PhE1基因属于lhcb2类基因家族,其编码的蛋白与来自单子叶植物毛竹的ABQ02464、水稻(Oryza sativa)的BAA00537、铁炮百合(Lilium longiflorum)的ABO20852、小果野蕉(Musa acuminata)的ABF70157以及来自双子叶植物烟草(Nicotiana tabacum)的P2749、苋菜(Amaranthus hypochondriacus)的CAA52750、人参(Panax ginseng)的BAE46383、矮牵牛(Petunia hybrida)的P12062、番茄(Solanum lycopersicum)的P14278的一致性都在86%以上,充分显示了基因家族在进化上的保守性。在同一植物中lhcb2有多个基因拷贝,其编码的蛋白质之间有微小的差异(Allen et al., 1992),但是蛋白的结构与功能却存在一定的差异。同是来自毛竹的lhcb2类基因cab-PhE1与cab-PhE2(EF207230)在蛋白水平的一致性为96%,它们是否存在结构和功能上的差异,其差异是由于其共同的前体经过不同氨基酸位点的加工,还是由不同基因型编码产生的,需要对其作进一步的分离、纯化研究。
cab-PhE1基因的组织特异性表达结果表明,在绿色组织部分(叶片、叶鞘和幼茎)cab-PhE1基因的表达丰度比较高,而在根中却几乎检测不到。cab-PhE1基因作为捕光色素结合蛋白基因,其表达是在光合作用的光反应场所——叶绿体的类囊体中(Allen et al., 1992),这与叶绿体在不同组织中的分布相一致。cab-PhE1基因在大肠杆菌BI21(DE3)中诱导表达时发现,不同温度(25,30,37 ℃)条件下均能高效表达,这将有利于重组蛋白的进一步分离与纯化。在研究中发现随着培养时间的延长,不经IPTG诱导的含cab-PhE1基因的大肠杆菌中也能产生目的蛋白条带(图 5),用在培养基中添加葡萄糖的方法来降低基础表达的试验证明,所产生的目的蛋白条带属于基础水平表达。另外,一般pET载体的诱导IPTG浓度在0.4~1 mmol·L-1之间,本研究中诱导最佳浓度为10 μmol·L-1,远远低于pET载体推荐的诱导浓度,这可能与该基因在BI21(DE3)中的基础表达水平较高有关。
高志民, 李雪平, 彭镇华, 等. 2007. 竹子捕光叶绿素a/b结合蛋白基因全长的克隆和序列分析. 林业科学, 43(3): 34-38. |
江泽慧. 2002. 世界竹藤. 沈阳: 辽宁科学技术出版社.
|
孙钦秒, 冷静, 李良璧, 等. 2000a. 高等植物光系统Ⅱ捕光色素蛋白复合体结构与功能研究的新进展. 植物学通报, 17(4): 289-301. |
孙钦秒, 李良璧, 毛大璋, 等. 2000b. 豌豆Lhcb2基因在大肠杆菌中的高效表达及其表达产物色素的重组. 中国科学, 30(4): 363-369. |
徐伟, 张兴, 娄世庆, 等. 1998. 黄瓜和菠菜LHCⅡ的二维结晶及其结构的初步分析. 中国科学, 28(4): 343-348. |
Allen K D, Staehelin L A. 1992. Biochemical characterization of photosystem Ⅱ antenna polypeptides in grana and stroma membranes of spinach. Plant Physiology, 100: 1517-1526. DOI:10.1104/pp.100.3.1517 |
Caffarri S, Croce R, Cattivelli L, et al. 2004. A look within LHC Ⅱ:differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry, 43: 9467-9476. DOI:10.1021/bi036265i |
Gao Zhimin, Li Xueping, Li Lubin, et al. 2006. An effective method for total RNA isolation from bamboo. Chinese Forestry Science and Technology, 5(3): 52-54. |
Klimmek F, Sjödin A, Noutsos C, et al. 2006. Abundantly and rarely expressed Lhc protein genes exhibit distinct regulation patterns in plants. Plant Physiology, 140(3): 793-804. DOI:10.1104/pp.105.073304 |
Kühlbrandt W, Wang D N, Fujiyoshi Y. 1994. Atomic model of plant light-harvesting complex by electron crystallography. Nature, 367: 614-621. DOI:10.1038/367614a0 |
Liu Cheng, Zhang Yajie, Cao Derong, et al. 2008. Structural and functional analysis of the antiparallel strands in the lumenal loop of the major light-harvesting chlorophyll a/b complex of photosystem Ⅱ (LHCⅡb) by site-directed mutagenesis. Journal of Biological Chemistry, 283(4): 487-495. |
Liu Zhenfeng, Yan Hanchi, Wang Kebin, et al. 2004. Crystal structure of spinach major light harvesting complex at 2.72Å resolution. Nature, 428(18): 287-292. |
Paulsen H, Ruler U, Ruiger W. 1990. Reconstitution of pigment containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta, 181: 204-211. DOI:10.1007/BF02411539 |
Robert L, Grzegorz J. 2006. The structure, functions and degradation of pigment-binding proteins of photosystem Ⅱ. Acta Biochimica Polonica, 53(4): 693-708. |
 2009, Vol. 45
2009, Vol. 45

