文章信息
- 林明涛, 储富祥, 王基夫, 蒋秋娜, 王春鹏.
- Lin Mingtao, Chu Fuxiang, Wang Jifu, Jiang Qiuna, Wang Chunpeng
- 丙烯酸松香(β-丙烯酰氧基乙基)酯的本体聚合动力学
- Kinetics of Bulk Polymerization of Acrylic Rosin (β-Acryloxyl Ethyl) Ester
- 林业科学, 2009, 45(3): 105-110.
- Scientia Silvae Sinicae, 2009, 45(3): 105-110.
-
文章历史
- 收稿日期:2007-12-05
-
作者相关文章
2. 中国林业科学研究院林业新技术研究所 北京 100091;
3. 南京林业大学化学工程学院 南京 210037
2. Institute of New Technology of Forestry, CAF Beijing 100091;
3. College of Chemical Engineering, Nanjing Forestry University Nanjing 210037
丙烯酸松香是松香重要的衍生物之一,它是松香与丙烯酸在适宜的温度下,经过Diels-Alder加成反应生成,加成物占产物的50%以上。丙烯酸松香可用于合成不饱和聚酯树脂,用作橡胶胶黏剂、压敏胶或热熔胶黏剂,其胶粘效果和防老效果都很好。丙烯酸松香也可用于醇酸树酯中,以改善由它所组成的涂料的物理和化学性质(宋湛谦,2002;任天瑞等,2006)。
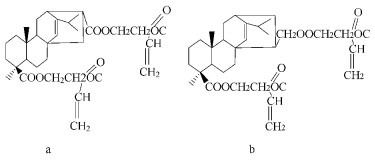
丙烯酸松香(β-丙烯酰氧基乙基)酯(AR-2-HEA)是将丙烯酸松香与丙烯酸-2-羟基乙基酯(2-HEA)进行酯化反应制备。AR-2-HEA中的主要组成成分结构如图 1所示,结构式a和b为丙烯海松酸二(β-丙烯酰氧基乙基)酯的同分异构体,在其分子结构上含有2个不饱和双键,可自由基聚合反应生成交联聚合物。鉴于AR-2-HEA中主成分结构上的特点,AR-2-HEA可作为交联单体,以改善胶黏剂、涂料和油墨的性能。但对于AR-2-HEA的聚合行为和聚合反应动力学,目前尚未有文献报道。
|
图 1 丙烯海松酸(β-丙烯酰氧基乙基)酯的分子结构 Figure 1 Molecule structure of bi-(β-acryloxyl ethyl) esters of acrylic pimaric acid |
差示扫描量热(differential scanning calorimeter, DSC)分析作为一种基本热分析方法,通过对DSC曲线进行分析,可以得到总的反应动力学的定量数据(Ramis et al., 2003;Worzakowska,2007)。本研究采用非等温和等温聚合方法,以偶氮二异丁腈(AIBN)为引发剂,研究AR-2-HEA本体聚合动力学关系,并以之为基础对AR-2-HEA的等温聚合过程的动力学进行模拟。
1 材料与方法 1.1 原料与试剂丙烯酸松香(β-丙烯酰氧基乙基)酯(AR-2-HEA),按文献(林明涛等,2007)自制;偶氮二异丁腈(AIBN),分析纯,购于上海四试赫维化工有限公司。
1.2 丙烯酸松香(β-丙烯酰氧基乙基)酯聚合反应过程DSC热分析将含有引发剂AIBN的AR-2-HEA约6 mg置于铝皿中,聚合反应在Perkin Elmer Diamond DSC中进行,以氮气作为保护气体。非等温过程:按不同升温速率升温至预定温度并对聚合过程进行监控,分析随着温度或者时间的变化对热焓变化的影响;等温过程:采用快速升温至预定温度并恒温的方法对聚合过程进行监控,分析反应温度或者反应时间的变化对热焓变化的影响。
2 结果与分析 2.1 DSC研究本体聚合的理论分析对于用DSC曲线进行动力学分析,首先要遵循以下几点假设:1)放热曲线总面积正比于反应总放热量;2)反应过程的反应速率与热流速率成正比,
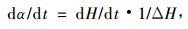
|
(1) |
式中:ΔH代表整个反应的放热量,dH/dt为热流速率,dα/dt为反应速率。
反应速率方程可用
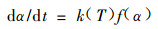
|
(2) |
表示,其中α为反应程度,f(α)为α的函数,其形式由反应机理决定,k(T)为反应速率常数,形式由Arrhenius方程决定,即
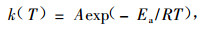
|
(3) |
式中:T为Kelvin温度,Ea为活化能,R为气体常数,A为频率因子。
自由基引发烯类单体聚合时的速率方程为(潘祖仁,2007):
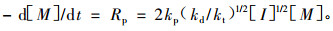
|
由上述方程可以假定AR-2-HEA的自由基引发聚合的反应速率方程符合n级反应动力学方程,即
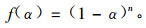
|
(5) |
Diamond DSC具有快速升温且升温速率平稳的特点,可以用来对单体的等温聚合进行深入研究。采用DSC研究AR-2-HEA本体聚合动力学有2种方法:非等温方法和等温方法。
非等温方法 本方法主要通过假设反应为n级反应,将Kissinger(1957)和Crane式(Crane,1973;徐卫兵等,2002)用于DSC数据的归一化,二者都是从DSC曲线最高点对应于最大反应速率出发的。
Kissinger方程:
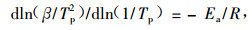
|
(6) |
Crane方程:
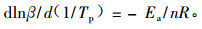
|
(7) |
式中:β为升温速率,Tp为DSC峰顶温度,R为气体常数,n为反应级数。
在一组不同加热速率DSC曲线中找出所对应的峰顶温度,并将ln(β/Tp2)对1/Tp作线性回归,求得聚合反应活化能。将所得Ea值代入Crane公式,就可得到体系的聚合反应级数n,将所得到的Ea和n按照Kissinger方法,由式(8)可近似求得各聚合体系的前置因子A:
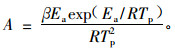
|
(8) |
等温方法 按照n级反应动力学方程的基本原理,对反应速率方程可用dα/dt=k(T)f(α)取对数,有:
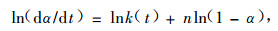
|
(9) |
ln(dα/dt)~ln(1-α)将为直线关系,斜率为n,截距为lnk(t)。
对Arrhenius方程k(T)=Aexp(-Ea/RT)取对数,有:
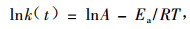
|
(10) |
lnk(t)~1/T将为直线关系,斜率为-Ea/R,截距为lnA。
2.2 引发剂AIBN的存在与否对AR-2-HEA的聚合性能的影响以及聚合产物的热分析通常自由基引发烯类单体聚合是一个放热反应,采用DSC分析方法可以准确测量聚合过程中的热焓变化。
首先考察AR-2-HEA在没有引发剂的作用下是否能够聚合。采用升温速率为10 K·min-1的程序升温方式对样品在303~453 K区间进行热分析,研究发现在此温度区间AR-2-HEA没有放热,意味着AR-2-HEA在此试验条件下没有聚合。
当样品中加入质量分数为2%的AIBN后,采用相同的升温速率对样品进行热分析,从图 2中可以观察到在353~413K有一个放热峰,聚合反应焓变为-110 J·g-1,此数据与聚甲基丙烯酸甲酯生成焓变在同一数量级上。对上述聚合后样品采用相同速率进行再次扫描,研究发现在353~413 K区间热流曲线没有波动,说明上次扫描过程样品的聚合达到最大可能,进一步的升温过程并不能使聚合程度加大。研究还发现上述样品在281 K有一明显的玻璃化转变。
|
图 2 AR-2-HEA在有无AIBN存在下的DSC分析结果 Figure 2 DSC analysis results of AR-2-HEA with or without AIBN 1.没有AIBN Without AIBN;2. 2% AIBN;3.含有2%AIBN样品的二次扫描Second scan of 2% AIBN. |
对上述试验结果的分析证明了DSC对于AR-2-HEA及其类似化合物的聚合过程的研究是一个很好的工具。
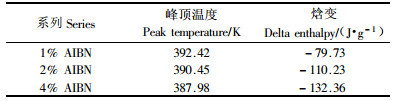
对于不同AIBN含量的样品采用10 K·min-1的升温速率在303~458 K温度区间进行扫描,分析聚合反应的峰顶温度与聚合焓变,具体分析结果见表 1。表中数据显示随着AIBN用量的增加,峰顶温度向低温方向偏移,反应焓变逐步上升,由此可以判断出聚合反应的程度随着引发剂用量的增多而加大。在AR-2-HEA的本体聚合反应中,引发剂用量增多,聚合反应速率加快,反应速率达到最大所需时间减小,反映在DSC曲线上就是峰顶温度的下降;AR-2-HEA的本体聚合中引发剂量增多,聚合反应发生的程度得到提高,由此造成反应焓变的上升。本文以下的研究以AIBN用量为2%的情况为研究对象。
|
|
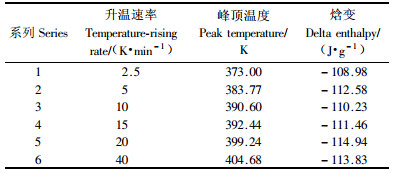
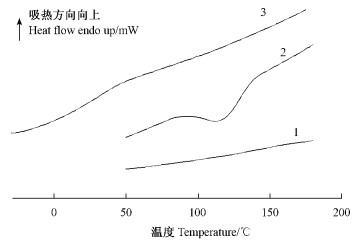
采用DSC研究AR-2-HEA的等速升温聚合过程时,升温速率也是一个重要的影响因素。对于2%AIBN含量的AR-2-HEA分别采用2.5,5,10,15,20和40 K·min-1的速率在313~453 K温度区间范围内扫描,结果见图 3。试验结果表明,在恒定引发剂含量下,不同的升温速率,聚合反应焓变基本相同,见表 2。
|
图 3 不同升温速率条件下AR-2-HEA在313~453 K之间的DSC曲线 Figure 3 DSC curves of AR-2-HEA polymerized from 313~453 K at different temperature-rising rate |
|
|
对于AR-2-HEA的非等温方法测定的AR-2-HEA自由基本体聚合体系的DSC曲线,可以采用Kissinger和Crane方法对热力学数据进行分析,以确定反应动力学参数。
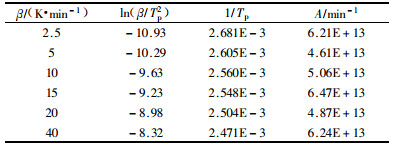
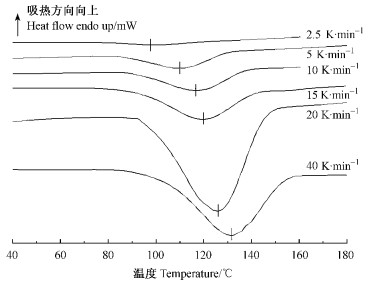
图 4为不同升温速率条件下聚合反应焓变百分比的积分曲线,从图中可以直观的看出随着升温速率的提高聚合反应的速率也加快。表 3中数据经线性拟合,得ln(β/Tp2)=-12 406·1/Tp+22.216,R2=0.974 9。即Ea/R=12 406,由此可得聚合反应的表观活化能Ea= 103 143 J·mol-1=103.1 kJ·mol-1。
|
图 4 不同升温速率下聚合反应程度与时间的关系 Figure 4 Polymerization degree vs time with different temperature-rising rate 1: 2.5 K·min-1;2: 5 K·min-1;3: 10 K·min-1;4: 15 K·min-1;5: 20 K·min-1;6: 40 K·min-1. |
|
|
表 3数据ln(β)和1/Tp经线性拟合,得lnβ=-13 182·1/Tp+36.14,R2=0.977 6,即Ea/nR=13 182,由此可得聚合反应的表观反应级数n=0.941。
由上述所得的动力学参数可得出体系的n级聚合反应动力学模型,如下式:
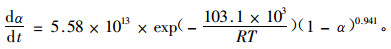
|
以AIBN为引发剂,用量为AR-2-HEA质量的2%。当升温速率为10 K·min-1时,峰顶温度为390.60 K,聚合过程时间为6 min。故选择378,383,388,393和398 K对AR-2-HEA做等温聚合。图 5为5个温度下等温聚合的DSC曲线。
|
图 5 含有2%AIBN的AR-2-HEA在不同温度下等温聚合的DSC曲线 Figure 5 Isothermal DSC curves of AR-2-HEA with 2% AIBN polymerized at different temperature |
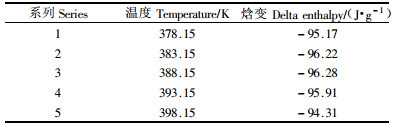
对上述等温聚合过程的热焓曲线进行积分,发现在不同聚合温度下聚合反应的焓变基本相同,如表 4所示。
|
|
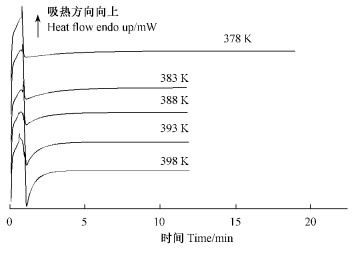
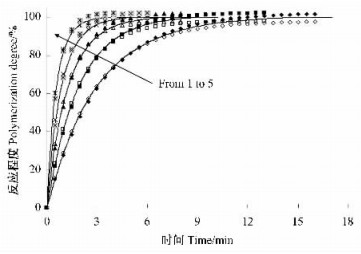
按图 5 DSC的热流信号与基线间的峰面积进行换算,得聚合反应程度α和时间t的关系如图 6所示。图 6结果表明,随着等温聚合温度的提高,聚合反应速率得到较大的提高,聚合时间从15 min缩短至4 min以内。
|
图 6 聚合反应程度与时间的关系 Figure 6 Relationship between polymerization degree and time 1: 378 K; 2: 383 K; 3: 388 K; 4: 393 K; 5: 398 K. |
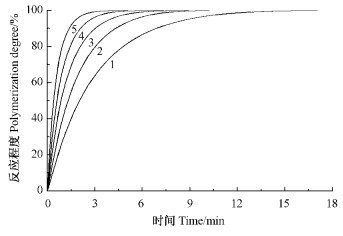
按方程(1)对图 6中的反应程度α数值对时间t求导数,即dα/dt,它表示AR-2-HEA本体聚合速率。以dα/dt对t做图,如图 7所示,从图 7可以看出反应速率在起始阶段很快上升,到达最高点后,即缓慢下降。在自由基聚合反应的初始阶段,由于体系中含有的一些阻聚成分导致存在一个诱导期,即聚合反应速率不能马上达到最大。但一旦达到最大速率后,由于引发剂的分解以及单体的消耗导致反应速率逐步下降。
|
图 7 聚合反应速率与时间的关系 Figure 7 Relationship between polymerization rate and time 1: 378 K; 2: 383 K; 3: 388 K; 4: 393 K; 5: 398 K. |
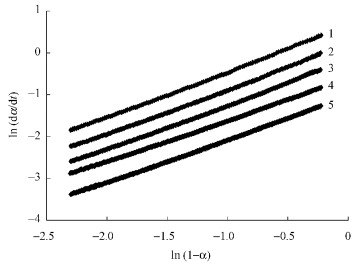
根据方程(9),以ln(dα/dt)对ln(1-α)作图,在α介于(0.1,0.9)的范围内均存在良好的线性关系,如图 8所示,表明该聚合体系遵循n级反应动力学机理,可以用n级反应动力学模型处理,计算聚合反应动力学参数。
|
图 8 ln(dα/dt)与ln(1-α)之间的关系 Figure 8 Relationship between ln(dα/dt) and ln(1-α) 1: 378.15 K; 2: 383.15 K; 3: 388.15 K; 4: 393.15 K; 5: 398.15 K. |
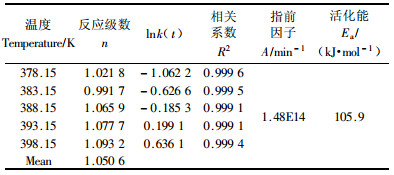
在α介于(0.1,0.9)的范围内对试验1,2,3,4和5的ln(dα/dt)和ln(1-α)的关系曲线进行归一化处理(相关系数介于0.999 1~0.999 6),结果如表 5所示,从试验结果可以看出,α介于(0.1,0.9)的范围内,反应级数n变化不大,取其平均值,n=1.05。按方程式(10),将表 5中数值lnk(t)和1/T的数值进行归一化处理,得到频率因子A为1.48×1014 min-1, 活化能Ea为105.9 kJ·mol-1。
|
|
再根据方程(2),可以得到AR-2-HEA的等温条件下的本体聚合的动力学方程:
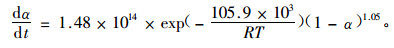
|
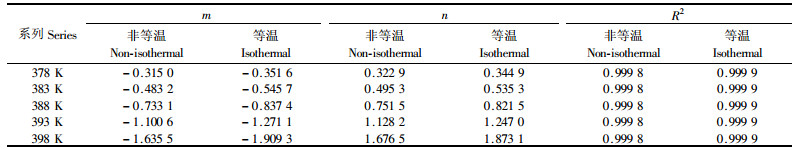
上述二方程在α∈[0.1,0.9]区间内以0.02为步进单位,对T=378.15,383.15,388.15,393.15和398.15 K时的dα/dt进行计算,并对之进行线性拟合,得到形式如dα/dt=mα+n的方程式,其中m, n和相关系数R2的值列于表 6。
|
|
对于方程dα/dt=mα+n,可以通过解微分方程得到形式如α=n/m×(emt-1)的方程式,该方程式直接阐明了α与t之间的关系。以α对t做图得图 9。图 9中的实线为前文中的不同聚合反应温度下的α与t的试验数据关系,形状不同的点组成了由上述二个方程推导得到的数据。综观所有试验,拟合数据与试验数据还是相当吻合的,说明该动力学方程与实际情况是比较吻合的。
|
图 9 AR-2-HEA的等温聚合反应程度与时间的关系 Figure 9 Reaction degree versus reaction time at different temperatures of AR-2-HEA 实线是试验曲线,符号是预测的点(实心为非等温方程模拟点、空心为等温方程模拟点)。The solid lines are the experimental curves and the symbols are the predicted data(solid symbols are deduced from non-isothermal equation, empty symbols are deduced from isothermal equation). 1. ◆ ◇: 378.15 K; 2. ■ □: 383.15 K; 3. ▲ △: 388.15 K; 4. × ×: 393.15 K; 5. * *: 398.15 K. |
以AIBN为引发剂,在313~458 K之间AR-2-HEA进行本体聚合,随着AIBN用量的增加,反应焓变逐步上升。在非等温条件下,引发剂用量不变,不同的升温速率,焓变基本相同;n级反应法的动力学方程为:dα/dt=5.58×1013×exp(-103.1×103/RT)(1-α)0.941;在等温条件下,不同温度的本体聚合的反应焓变基本相同,聚合反应速率随着聚合温度的提高而提高;AR-2-HEA在等温条件下本体聚合的动力学方程为:dα/dt=1.48×1014×exp(-105.9×103/RT)(1-α)1.05。以上述二方程为基础对聚合过程的模拟与实际情况是比较吻合的。
林明涛, 储富祥, 马丽, 等. 2007. 基于松香基的交联单体及甲基丙烯酸甲酯共聚物的制备与性能研究. 林产化学与工业, 27(5): 25-30. DOI:10.3321/j.issn:0253-2417.2007.05.006 |
潘祖仁. 2007. 高分子化学(增加版). 北京: 化学工业出版社.
|
任天瑞, 李永红. 2006. 松香化学及其应用. 北京: 化学工业出版社.
|
宋湛谦. 2002. 松香的精细化工利用(Ⅰ)——松香的组成与性质. 林产化工通讯, 36(4): 29-33. DOI:10.3969/j.issn.1673-5854.2002.04.009 |
徐卫兵, 鲍素萍, 沈时俊, 等. 2002. 酚醛树脂/蒙脱土纳米复合材料的制备及固化反应动力学研究. 高分子学报, (4): 457-461. |
Crane L W, Dynes P J, Kaelble D H. 1973. Analysis of curing kinetics in polymer composites. Polymer Letters, 11: 533-540. DOI:10.1002/pol.1973.130110808 |
Kissinger H E. 1957. Reaction kinetics in differential thermal analysis. Analytical Chemistry, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
Worzakowska M. 2007. The kinetic study of the curing reaction of mono- and di-epoxides obtained during the reaction of divinylbenzene and hydrogen peroxide with acid anhydrides. Polymer, 48: 1148-1154. DOI:10.1016/j.polymer.2006.12.020 |
Ramis X, Cadenato A, Morancho J M, et al. 2003. Curing of a thermosetting powder coating by means of DMTA, TMA and DSC. Polymer, 44: 2067-2079. DOI:10.1016/S0032-3861(03)00059-4 |
 2009, Vol. 45
2009, Vol. 45