文章信息
- 刘华, 臧润国, 张新平, 丁易, 江晓珩, 张炜银, 郭仲军, 白志强, 张毓涛.
- Liu Hua, Zang Runguo, Zhang Xinping, Ding Yi, Jiang Xiaoheng, Zhang Weiyin, Guo Zhongjun, Bai Zhiqiang, Zhang Yutao
- 天山中部3种自然生境下天山雪莲的光合生理生态特性
- Photosynthetic and Ecophysiological Characteristics of Snow Lotus (Saussuea in volucrata) in Its Natural Conditions in the Central Part of Tianshan Mountains
- 林业科学, 2009, 45(3): 40-48.
- Scientia Silvae Sinicae, 2009, 45(3): 40-48.
-
文章历史
- 收稿日期:2008-02-29
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所国家林业局森林生态与环境重点实验室 北京 100091;
3. 新疆林业科学研究院森林生态研究所 乌鲁木齐 830000
2. Key Laboratory of Forest Ecology and Environment, State Forestry Administration Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091;
3. Institute of Forest Ecology, Xinjiang Academy of Forestry Urumqi 830000
新疆地处欧亚大陆腹地,独特的地理、气候条件和土壤类型,使其成为特色中药材资源的生产宝地。天山雪莲(Saussuea involucrata)属菊科凤毛菊属(Saussurea)雪莲亚属的多年生草本植物。作为一类珍稀药用植物资源,天山雪莲通常生长在海拔2 400~4 100 m之间的高山地带,生存环境十分恶劣,高山上强烈的紫外线照射和极大的昼夜温差,其生长非常缓慢。而过度收购、乱采乱挖现象,使得野生天山雪莲遭到严重破坏,天然资源面临枯竭,目前已被国家列为一级保护植物。野生植物是自然生态系统中不可替代的重要组成部分(Coates et al., 2007)。雪莲资源的生存现状及保护问题已引起社会的重视(李晓玲,2003),而研究多数是围绕天山雪莲化学成分(陈发菊等,1999)及药理功能(黄继红等,2002;贾景明等,2005;陈玉珍等,2005;庄丽等,2006)、组织培养(瓦·古巴诺娃等,1990;徐春明等,2006)、资源利用和保护策略(李君山等,1997;庄丽等,2006)以及生殖生态(谭敦炎等,1998;黄继红,2004)等方面。关于天山雪莲的生态适应性少见报道(卓娅等,1993),而天山雪莲适应性的指标及其野生植株适应自然环境的生理生态特性等方面未见相关研究。
高山植物在长期的自然选择过程中,不断与环境相互协调,形成一系列对严酷自然条件的适应机制(Zhao et al., 2006;Wielgolaski et al., 2007)。其光合器官能够对环境影响作出快速的反应(Lepedus et al., 2005;Weng et al., 2005;Zhang et al., 2007),研究光合作用过程中植物叶片对光强变化有助于阐明植物对环境变化的适应性(孙谷畴等,2002;Galen,2006;Wang et al., 2007);选择气体交换指标来解释高山植物叶片的生物学响应机理是研究者关注的重点之一(史作民等,2004)。本文以天山中部3个海拔野生天山雪莲为研究对象,从海拔变化纵向梯度和光合速率日变化的角度,根据其叶片气体交换指标对其自然分布的环境特别是对直射光照强度的响应特征,分析其光合生理生态特征与自然环境的关系。
1 研究方法 1.1 研究区概况及材料的选择研究地点位于天山中部北坡的国家林业局天山森林生态系统定位站(43°09′—43°28′N,87°12′—87°50′E)内。该站是天山中部森林生态系统的典型代表,位于新疆乌鲁木齐市南部乌鲁木齐县水西沟乡,占地面积369 hm2,其中林业用地266 hm2,有林地面积139 hm2。海拔1 908~2 970 m。年平均气温5 ℃,极端最低气温-38 ℃,最高气温30 ℃;年降水量600~800 mm,无霜期150~160 d,属温带大陆性气候。土壤为山地灰褐色森林土。天山森林生态系统定位站具有天山中部保存较为完好而完整的植被垂直分布,主要植被类型自下而上依次分布着黑果小檗(Berberis heteropoda)+宽翅蔷薇(Rosa platyacantha)灌丛、天山云杉(Picea schrenkiana var. tianschanica)纯林、天山云杉+天山花楸(Sorbus tianschanica)混交林、天山云杉+新疆方枝柏(Juniperus pseudosabina)、亚高山草甸。其中,天山雪莲主要分布于天山云杉+新疆方枝柏及亚高山草甸植被带内。
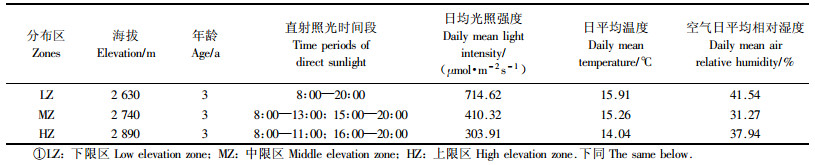
天山雪莲在该研究区分布于海拔2 600~2 970 m之间的高山草甸及悬崖、峭壁的石缝等处。依海拔的不同,将天山雪莲在此研究范围内的自然分布划分为3个典型区域,即分布下限区、中部区和上限区。其中,下限区海拔≤2 650 m,中部区海拔在2 651~2 849 m之间,上限区海拔≥2 850 m。本文分别在3种生境(分布下限区的2 630 m海拔处,分布中部区的2 740 m海拔处,分布上限区的2 890 m海拔处)的石崖间,各选择5株3年生的天山雪莲,进行光合特性的测定。其中,在下限区的天山雪莲在整个测定时段内均可接受直接的太阳辐射;在中部区的天山雪莲未接受太阳直接辐射的时间为13:00—15:00;上限区处的天山雪莲,只有在11:00之前和16:00时之后的时段内才可以接受直接的太阳辐射。天山雪莲分布的3个地段内,随着海拔的变化,其光照、温度、湿度等小气候和土壤养分和水分状况等均存在一定的差异,因此天山雪莲的3个自然分布区段可以是3种不同自然生境的代表。测定雪莲的3个区域概况见表 1。
|
|
于2006年8月6—8日,每天从8:00到20:00时段内,使用LI-6400便携式光合作用测定系统(Li-Cor,Lincoln,NE,USA)对天山雪莲各项光合生理指标进行测定。首先选择生长良好无虫害的叶片为测定叶片,并标记以保证1 d中测定部位的一致性。天山雪莲的生长缓慢,其年龄可根据其茎轴心处致密的横隔加以判断(卓娅等,1993)。因雪莲生长地条件对测量的难度有一定影响,本试验在每个地点选择5株3年生天山雪莲,每株选一成熟叶片进行测定,结果取平均值,完成天山雪莲净光合速率(Pn)的测定。同时测定的气体交换指标还有蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)和叶温下蒸汽压亏缺(Vpdl)以及外界光合有效辐射(PAR)、叶片光合有效辐射(PARi)、空气温度(Ta)、叶片温度(Tl)、大气CO2浓度(Ca)等环境因子。根据测定的气体交换指标计算叶片气孔限制值(Ls)、水分利用效率(WUE)和叶片的光能利用率(PE) (Berry et al., 1982)。
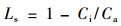
|
(1) |

|
(2) |

|
(3) |
在2006年8月2日—3日上午10:00—12:00时之间,用便携式光合作用测定系统LI-6400-02B叶室,按照设定的2 000,1 800,1 600,1 400,1 000,800,600,400,200,100,50,20,10,0 μmol·m-2s-1光照梯度序列,测定天山雪莲叶片净光合速率的大小,自动完成光响应曲线。测定设置3次重复,依据方程(4)计算最大净光合速率(P max),并确定其光补偿点(LCP)和光饱和点(LSP)(Bassman et al., 1991):
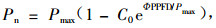
|
(4) |
式中:Φ为弱光下光化学量子效率,C0为度量弱光下净光合速率趋于0的指标,通过适合性检验,拟和效果良好。测定时的空气温度为(16.57±1.57)℃,空气中CO2浓度为(376.94±3.77)μmol·m-2s-1,相对湿度为(39.56±5.13)%。根据测定200,100,50,20,10,0 μmol·m-2s-1光照梯度下的净光合速率值,进行回归所得曲线的初始斜率为表观光量子效率(AQY)。与净光合速率所在的轴相交的截距为暗呼吸速率(Rd)。
1.4 A-Ci曲线的测定2006年8月4,5日10:00—12:00时,将由光曲线所确定的光饱和点作为最适光照强度,利用CO2注入系统,按照设定的400,300,200,100,50,0,400,400,600,800,1 000,1 200,1 400,1 800,2 000 μmol·mol-1的CO2浓度梯度序列,测定天山雪莲叶片净光合速率的大小,自动完成A-Ci曲线。确定CO2补偿点(CCP)和CO2饱和点(CSP)。在CO2浓度低于200 μmol·mol-1以下时测定的净光合速率值,进行回归后所得直线方程的斜率为羧化效率(CE)。与净光合速率所在的轴相交的截距为光呼吸速率(Rp)。由于光下暗呼吸很小,可以近似将光下叶片向无CO2的空气中释放CO2的速率看作光呼吸速率(蔡时青等,2000)。
1.5 气体交换指标与环境因子的相关性分析根据高山自然环境的特点,分析不同海拔天山雪莲净光合速率与叶温和大气温度的关系,定量分析温度对Pn的影响。同时,分别以Pn,Tr,Gs为因变量,用SPSS 13.0分析其与环境因子PAR,Ta,Tl,Ca和空气相对湿度(RH,%)等为自变量的各因子间的相关性;以及与Pn相关的各气体交换指标间的相关性。
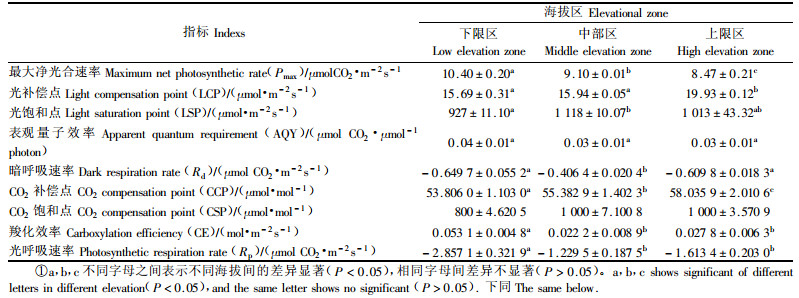
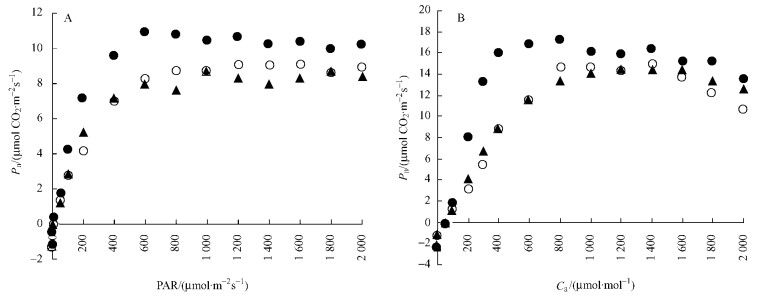
2 结果 2.1 天山雪莲的光响应曲线和A-Ci曲线3个不同海拔天山雪莲Pn的大小随着光强的增加而增加,到一定光强保持基本的稳定;而Pn随着CO2浓度的增加表现出先增加后有所降低的趋势(图 1)。其中,3个海拔的Pmax之间差异显著(P<0.05),上限区天山雪莲的LCP分别与中部区和下限区的LCP间的差异显著(P<0.05),但天山雪莲的LSP在上限区和中限区间差异不显著(P>0.05),在下限区与中限区间差异显著(P<0.05);在弱光下,3个海拔天山雪莲的AQY之间没有显著的差异。而不同海拔天山雪莲的CCP之间差异均显著(P<0.05),下限区天山雪莲的CSP和CE分别与其他2个海拔的差异显著(P<0.05)(表 2)。
|
图 1 不同海拔天山雪莲光响应曲线(A)和A-Ci曲线(B) Figure 1 Pn-PPFD (A) and A-Ci (B) curves of S. involucrata in different altitude zones in Tianshan Mountains ●上限区High elevation zone, ○中限区Middle elevation zone, ▲下限区Low elevation zone.下同The same below. |
|
|
天山雪莲在不同海拔的Rp要高于Rd,但下限区的Rp分别与中部、上限区的差异显著(P<0.05);而中部区天山雪莲的Rd分别与下限和上限区的Rd之间存在显著差异性(P<0.05) (表 2)。
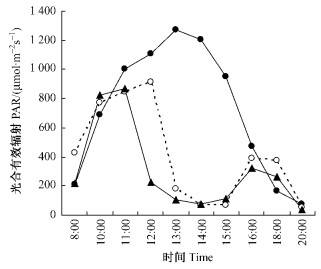
2.2 天山雪莲的净光合速率(Pn)和光能利用率(PE)的日变化在同纬度地区,PAR值随着海拔升高而增大。本试验所测样本由于接受照光时间的不同,3个区域天山雪莲接受的PAR的变化规律也不同(图 2),3个海拔区天山雪莲叶片的Pn的日变化规律也有差异(图 3A)。在下限区天山雪莲Pn的日变化为单峰曲线,8:00—13:00,Pn随时间呈直线增加,并在13:00达到一天中的最大值,为(9.702 2±0.590 4)μmol CO2·m-2s-1。13:00时之后Pn值又开始下降,20:00时的光合值要明显低于8:00时。中部区和上限区的天山雪莲分别在13:00—15:00,12:00—15:00时段内没有接受到直射光,其Pn在此时段的值明显下降;两者在曲线上表现为双峰曲线,并未出现真正意义上的“午休”现象。从结果可以看出,在8:00时3个海拔区天山雪莲的Pn有差异,这可能与接受太阳辐射时间长短和光照强度及所处的环境因子有关。正常情况下,高海拔的植物较低海拔植物能更早接受太阳辐射,由于山体之间的相互遮挡,低海拔的植物接受照光时间会晚些。
|
图 2 不同海拔光照强度的日变化 Figure 2 Diurnal variations of PAR in three elevation zones |
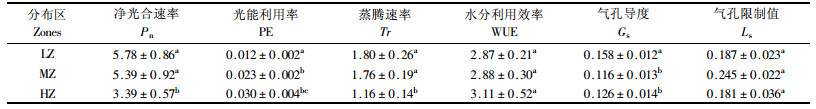
天山雪莲叶片PE在一天的变化见图 3B。3个海拔处天山雪莲的PE在1 d中的最高值要低于0.05%。其中,下限区天山雪莲的PE在1 d中的变化幅度较小,且其平均值为(0.012 6±0.001 5)%;中部区的天山雪莲在8:00—16:00时段内的PE在0.2%~0.3%之间,之后有所降低;而上限区的PE在1 d中的变化较大,10:00时的PE是1 d中的最低值,之后随着时间推移,呈波浪式上升趋势,16:00时达到1 d中的最大光能利用率。1 d中,下限和中部区天山雪莲的Pn平均值均高于上限区的,且差异显著;而PE是随海拔的增加而增加,3者之间具有显著的差异性(表 3)。
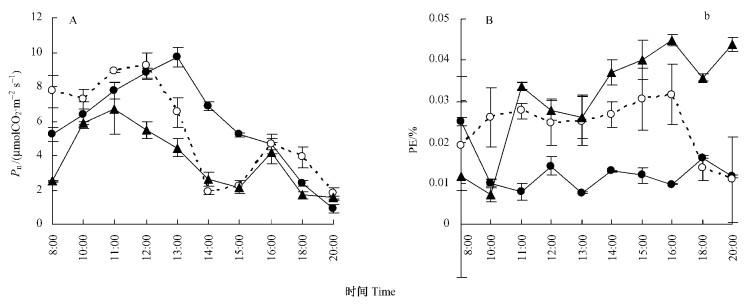
|
图 3 不同海拔天山雪莲Pn和PE的日变化 Figure 3 Diurnal variations of Pn and PE of S. involucrata in three elevation zones |
|
|
不同海拔的天山雪莲的Tr的日变化曲线见图 4A。在下限区,8:00—11:00时段内的Tr是逐渐增加,但在12:00时随Pn增加的同时,其Tr值突然下降,之后在Pn达到最大时刻的13:00时,Tr又上升到最大,13:00时之后随着时间推移逐渐下降;中部区的Tr在11:00时出现低谷,在13:00时之后开始缓慢下降;而上限区的Tr在11:00时出现峰值之后也呈现缓慢下降的趋势,且该海拔处天山雪莲Tr的日均值最低,为(1.16±0.14)mmol H2O·m-2s-1,分别与其他2个海拔处的Tr值之间具有显著的差异性(表 3)。1 d中,3个海拔处天山雪莲WUE的日变化规律不明显(见图 4B)。上限区的WUE在数值上要高于中部和下限区的,但3者之间的差异不显著(表 3)。
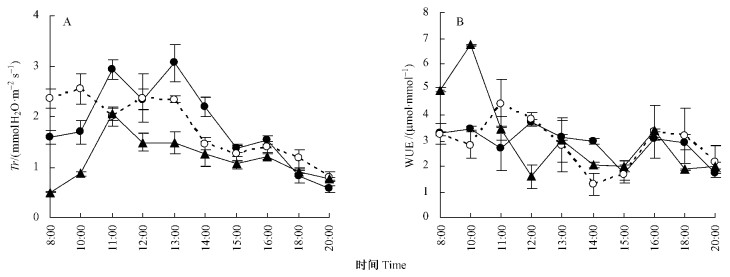
|
图 4 不同海拔天山雪莲Tr和WUE的日变化 Figure 4 Diurnal variations of Tr and WUE of S. involucrata in three elevation zones |
由于光照时段的差异,在对应的时间点,3个海拔处天山雪莲的Gs日变化比较明显(图 5A)。下限区的天山雪莲Gs在14:00时达到最高,之后随着时间的推移,Gs在下降,但20:00时的Gs值要明显低于8:00时的。中部区天山雪莲的Gs在12:00时达到最大值,之后在没有太阳直接辐射的时段内迅速下降。上限区天山雪莲在10:00时之前的Gs值在0.5 molH2O·m-2s-1左右,明显低于其他2个海拔处天山雪莲在此时刻的值;在8:00时,低温将导致CO2扩散能力的降低,从而使叶片的Gs值较低(Gale,1973);随着照光强度的增加,叶面温度略有增加,表现为Gs值的缓慢上升,而在11:00—16:00时该海拔的天山雪莲不能接受直接的太阳辐射,但其Gs还在增加,中部和上限区Gs随光强变化的趋势与下限区连续性光照条件下Gs的变化趋势具有很显著的差异,说明气孔对非连续时段光照的反应具有一定的滞后性。1 d中,下限区天山雪莲的Gs分别与中部和上限区的Gs具有显著的差异(P<0.05);而中部和上限区天山雪莲的Gs之间无显著的差异性(P>0.05)(表 3)。
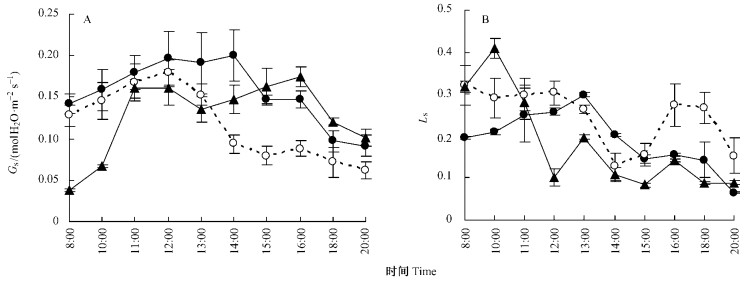
|
图 5 不同海拔天山雪莲Gs和Ls的日变化 Figure 5 Diurnal variations of Gs and Ls of S. involucrata in three elevation zones |
下限区天山雪莲Ls的日变化与Gs的一致,为单峰型;在13:00时达到最大限制值。中部区在未接受光照的13:00—15:00时段内,14:00时的气孔限制最小。上限区天山雪莲Ls在10:00时达到最大限制值之后,其1 d内的变化呈现随时间推移一直递减的趋势(图 5B)。1 d中,3个海拔天山雪莲的Ls之间无明显差异(P>0.05)(表 3)。
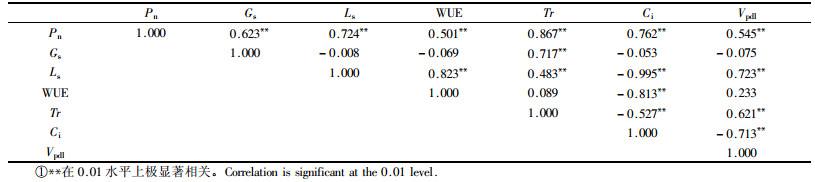
2.5 天山雪莲气体交换指标与环境因子的相关性天山雪莲Pn的大小与环境因子中的叶温(Tl)、大气温度(Ta)和光照强度(PAR)具有极显著的正相关性(P<0.01),相关系数分别为0.736,0.618和0.538;与海拔呈显著的负相关(P<0.05),相关系数为-0.385;与空气相对湿度(RH)和大气CO2浓度(Ca)之间均不具有显著相关性(P>0.05)。Tr与Ta,Tl和PAR具有极显著的正相关性(P<0.01),相关系数分别为0.802,0.790和0.670;与RH之间存在显著的负相关(P<0.05;r=-0.382)。Gs只与Ca浓度之间呈极显著的负相关(P<0.01,r=-0.601),与其他因子间无显著相关性(P>0.05)。
天山雪莲气体交换指数间的相关分析见表 4。Pn与Tr,Ls,Gs,WUE和Vpdl分别具有极显著的正相关性(P<0.01),相关系数分别为0.867,0.724,0.623,0.545和0.501;与Ci呈极显著的负相关(P<0.01),相关系数分别为-0.762。Tr和Gs之间也存在极显著的相关性(r=0.717)。Ls的大小直接影响到叶片的WUE,Tr,Ci和Vpdl,但对Ci的影响要明显高于其他因子的(r=-0.995),而且Ls是通过对Ci的限制,进而控制叶片的WUE,Tr和Vpdl。
|
|
1) 海拔梯度能够反应植物的生理特性对环境的响应(Hovenden et al., 2000)。研究区内3个海拔天山雪莲均具有较低的光补偿点和较高的光饱和点。上限区的光补偿点和光饱和点均显著高于下限区的,说明天山雪莲对光照的适应性较强。卢存福等(1995)研究认为同一物种在高海拔处的光饱和点和光补偿点大于其在低海拔处的,与本试验的结果相似。而且Ledig等(1983)认为高海拔地区的植物有较高的光合潜力。本文研究的天山雪莲的最大光合速率平均值为(9.32±0.98)μmol CO2·m-2s-1,较其他高山植物如唐古特大黄(Rheum tanguticum)、唐古特山莨菪(Anisodus tanguticus)(师生波等,2006)。对于长势良好的植物,AQY一般在0.04~0.07之间(Long et al., 1994),通过降低空气中O2浓度或提高CO2浓度均可提高C3植物的AQY。AQY较高,表明植物的光合能力强,不仅对弱光的适应性较强,也能够利用很高的光强。本研究区内,下限区的天山雪莲对光能和CO2的利用率相对较高,其AQY和CE分别为0.041 4和0.053 1 mol·m-2s-1,中部和上限区天山雪莲对光能和CO2的利用效率均低于下限区。就羧化效率而言,Krner等(1987)较早研究的27种高山植物表明:集中分布于高海拔植物的羧化效率明显大于集中分布于低海拔植物的,而天山雪莲的分布海拔范围较广,从本研究区的结果还不能证明其羧化效率与海拔的确切关系,需要在天山雪莲分布区内继续延伸海拔方面的相关研究来证实。
2) 下限区天山雪莲植株的光合日变化为单峰型曲线,没有出现平原植物常见的“午睡”现象,这是增加高山植物的光合强度,提高其生物学产量的重要途径之一,与部分高原作物的变化一致(刘志民等,2001;旺姆等,2006),而高寒草甸植物麻花艽(Gentiana straminea)和美丽风毛菊(Saussurea superba)在午间的光合速率有降低现象(师生波等,2001)。但是由于天山雪莲生长和分布环境的特殊性,在无直射光照的时段,不论是否在午间时刻,其光合速率迅速下降,体现出其对光照的敏感性。但从接受非直接太阳辐射到接受直接太阳辐射的转变过程中,净光合速率的增加时间略有滞后。这也是植物对自然环境中光照的一种适应方式。
3) 天山雪莲的Pmax和日平均Pn值随不同海拔的增加是降低的,其光能利用率随海拔的变化却与此相反。虽然高海拔植物有较高的潜在光合能力,但在自然条件下,充足的光照和相对不足的CO2供应导致高山植物的光合效率有所降低(卢存福等,1995),也有试验证明光合速率随海拔的升高而增加(Friend et al., 1989),但天山雪莲的Pn随海拔的降低也不是绝对的,因为这与天山雪莲自然分布及生长地点有关,中部和上限区天山雪莲在一天中接受的太阳直接辐射有限,在一定程度上影响了日均值的大小。因此,还可以从光能利用率角度分析不同海拔天山雪莲对光的反应的差异,下限区天山雪莲接受全天的太阳辐射,Pn较高,但对接受的太阳辐射的光能利用率相对较低,而中部和上限区的天山雪莲,由于接受直射光照时间短,为了维持其正常的生长发育,必须保存较高的能量,这种能量就来源于短时间的太阳直射,体现出其较高的光能利用率。从这一点更加说明雪莲在变化的光环境下的生存能力很强。
4) 在自然条件下,影响天山雪莲光合生理特性的因子较多。从天山雪莲自然分布的生境特征看出,其保持水分的能力足以维持自身的正常生长发育。同样,高海拔、强太阳辐射、低气温和低气压仍是其面临的主要环境因子。其中,Tl是影响研究区内天山雪莲P n大小的首要因素,其次为Ta和PAR;温度的变化与叶片表面蒸汽压亏缺一致,2者呈线性相关关系,Tl和Ta与Vpdl的相关系数分别为0.725 9和0.634 9。而海拔高度与Pn之间存在负相关关系,不同海拔的气体交换指标的日变化趋势一致,说明生长海拔的改变并不是影响植物气体代谢过程的唯一因素(Rawat et al., 1991)。通常认为高山植物能成功地适应高山逆境的关键是发育和代谢能够在低温和较大日温差下维持正常功能(Dear et al., 1985),随着环境因子的改变,天山雪莲的光合生理特征也会相应的改变,Vitousek等(1990)认为在野外条件下气孔导度随海拔的升高而降低,不同海拔天山雪莲的气孔导度的变化与此结论一致,而且Pn的大小和Tr与Gs均呈极显著的正相关性。
5) 在研究区的3个海拔,天山雪莲的光合生理特性具有如上所述的差异,且在下限区和上限区间比较明显。而天山雪莲垂直分布范围广,在海拔2 600~4 000 m之间,但是由于其分布数量限制和立地条件,使得测定自然状态下更高海拔的天山雪莲光合特性具有相当的难度。这也成为准确判定不同海拔天山雪莲的光适应性的限制条件之一。因此,要探究分布高度的2个极限地带,天山雪莲光合生理及其适应环境的方式,还需要从人工培育的角度进一步开展相关试验研究。同时,由于全球人口的剧增和人类对野生植物资源的掠夺性开发利用,使野生植物的自然分布区缩小,生境遭到破坏,许多植物种类已遭绝迹,更多的种类濒临灭绝的威胁(Rozdilsky et al., 2001)。随全球气候的变化,臭氧层的衰减使达到地表面的紫外辐射量迅速增加,而UV-B辐射对种子植物特别是高山植物和作物的影响也成为植物科学研究中活跃的领域之一(Li et al., 2000;Sullivan et al., 2003;任健等,2005)。本文通过对3种自然生境下野生天山雪莲植物的光合生理特性进行研究,了解其适应自然环境的基本特征,可以为高寒地区类似经济作物的栽培及天然植物资源的保护和合理利用提供理论依据。
蔡时青, 许大全. 2000. 大豆叶片CO2补偿点和光呼吸的关系. 植物生理学报, 26: 545-550. DOI:10.3321/j.issn:1671-3877.2000.06.015 |
陈发菊, 杨映根, 赵德修, 等. 1999. 我国雪莲植物的种类、生境分布及化学成分的研究进展. 植物学通报, 16(5): 561-566. DOI:10.3969/j.issn.1674-3466.1999.05.013 |
陈玉珍, 李凤兰. 2005. 药用资源植物雪莲化学成分及药理作用. 中国野生植物资源, 24(3): 1-4. DOI:10.3969/j.issn.1006-9690.2005.03.001 |
黄继红, 谭敦炎. 2002. 雪莲的研究进展. 新疆农业大学学报, 25(2): 8-13. DOI:10.3969/j.issn.1007-8614.2002.02.002 |
黄继红. 2004. 雪莲的生殖生态学研究. 新疆农业大学硕士学位论文.
|
贾景明, 吴春福, 于海, 等. 2005. 新疆雪莲组织培养物的抗辐射作用. 沈阳药科大学学报, 22(6): 444-448, 462. DOI:10.3969/j.issn.1006-2858.2005.06.013 |
李君山, 朱兆依, 蔡少青. 1997. 新疆风毛菊属雪莲花类药用植物资源的保护. 中国民族医药杂志, 3(1): 35-36. |
李晓玲. 2003. 新疆雪莲遭盗采, 人工培育路漫漫. 生态经济, 8: 18-23. |
刘志民, 杨甲定. 2001. 青藏高原大田青稞叶片的净光合速率日变化. 西北植物学报, 21(4): 775-778. DOI:10.3321/j.issn:1000-4025.2001.04.030 |
卢存福, 贲桂英, 韩发, 等. 1995. 矮嵩草光合作用与环境因素关系的比较研究. 植物生态学报, 19: 72-78. DOI:10.3321/j.issn:1005-264X.1995.01.008 |
任健, 李春阳. 2005. 种子植物对中波紫外辐射胁迫的响应研究. 生态学杂志, 24(3): 315-320. DOI:10.3321/j.issn:1000-4890.2005.03.017 |
师生波, 韩发, 李红彦. 2001. 高寒草甸麻花艽和美丽风毛菊的光合速率午间降低现象. 植物生理学报, 27(2): 123-128. DOI:10.3321/j.issn:1671-3877.2001.02.005 |
师生波, 王学英, 李惠梅, 等. 2006. 青藏高原药用植物唐古特山莨菪和唐古特大黄光合作用对强光的响应. 植物生理与分子生物学学报, 32(3): 387-394. |
史作民, 程瑞梅, 刘世荣. 2004. 高山植物叶片δ13C的海拔响应及其机理. 生态学报, 24(12): 2901-2906. DOI:10.3321/j.issn:1000-0933.2004.12.035 |
孙谷畴, 赵平, 曾小平, 等. 2002. 不同光强下焕镛木和观光木的光合参数变化. 植物生态学报, 26(3): 355-362. DOI:10.3321/j.issn:1005-264X.2002.03.016 |
谭敦炎, 朱建雯, 姚芳, 等. 1998. 雪莲的生殖生态学研究(Ⅰ). 新疆农业大学学报, 21(1): 1-5. |
瓦·古巴诺娃, 刘杰龙, 石玉瑚. 1990. 新疆雪莲的组织培养. 新疆农业科学, (5): 221-222. |
旺姆, 卓嘎, 次卓嘎. 2006. 南美藜叶片光合作用特性研究. 西藏科技, (2): 4-6. DOI:10.3969/j.issn.1004-3403.2006.02.001 |
徐春明, 赵兵, 耿楠, 等. 2006. 植物激素和活性炭对新疆雪莲组培苗生根的影响. 中国农学通报, 22(2): 41-43. |
庄丽, 李卫红, 孟丽红. 2006. 新疆雪莲资源的利用、研发与保护. 干旱区资源与环境, 20(2): 195-202. DOI:10.3969/j.issn.1003-7578.2006.02.038 |
卓娅, 刘杰龙, 古巴诺娃, 等. 1993. 天山雪莲生态适应特性及人工繁殖的研究. 新疆师范大学学报, 13(2): 81-84. |
Bassman J, Zwier J C. 1991. Gas exchange characteristics of Populus trichocarpa, Populus deltoids and Populus trichocarpa× P. deltoids clone. Tree Physiol, 8: 145-159. DOI:10.1093/treephys/8.2.145 |
Berry J A, Downton W J S. 1982. Environmental regulation of photosynthesis//Govind J. Photosynthesis (Vol Ⅲ), 263-343.
|
Coates D J, Dixon K W. 2007. Current perspectives in plant conservation biology. Australian Journal of Botany, 55: 187-193. DOI:10.1071/BT07037 |
Dear B S, Zorin M. 1985. Persistence and productivity of Trifolium ambiguum M. Bieb. (Caucasian clover) in a high altitude region of South-eastern Australia. Australian Journal of Experimental Agriculuture, 25(1): 124-132. DOI:10.1071/EA9850124 |
Friend A D, Woodward F I, Switsur V R. 1989. Field measurements of photosynthesis, stomatal conductance, leaf nitrogen and 13C along altitudinal gradients in Scotland. Functional Ecology, 3: 117-122. DOI:10.2307/2389682 |
Gale J. 1973. Availability of carbon dioxide for photo synthesis at high altitudes: theoretical considerations. Ecology, 53: 594-597. |
Galen C. 2006. Solar furnaces or swamp coolers: costs and benefits of water use by solar-tracking flowers of the alpine snow buttercup, Ranunculus adoneus. Ecophysiology, 148: 195-201. |
Hovenden J M, Brodribb T. 2000. Altitude of origin influences stomatal conductance and therefore maximum assimilation rate in southern Beech, Nothofagus cunninghamii. Aust J Plant Physiol, 27: 451-456. |
Krner C, Diemer M. 1987. Insitu photosynthetic responses to light, temperature and carbon dioxide in herbaceous plants from low and high altitude. Functional Ecology, 1: 179-194. DOI:10.2307/2389420 |
Ledig F T, Korbobo D R. 1983. Adaptation of sugar maple populations along altitudinal gradients: photosynthesis, respiration, and specific leaf weight. Amer J Bot, 70(2): 256-265. DOI:10.1002/j.1537-2197.1983.tb07866.x |
Lepedus H, Viljevac M, Cesar V, et al. 2005. Functioning of the photosynthetic apparatus under low and high light conditions in chlorotic spruce needles as evaluated by in vivo chlorophyll fluorescence. Russian Journal of Plant Physiology, 52(2): 165-170. DOI:10.1007/s11183-005-0024-7 |
Li Y, Zu Y Q, Chen J J, et al. 2000. Intraspecific differences in physiological response of 20 wheat cultivars to enhanced ultraviolet-B radiation under field conditions. Environ Exp Bot, 44: 95-103. DOI:10.1016/S0098-8472(00)00057-5 |
Long S P, Humphries S, Falkowski P G. 1994. Photo-inhibition of photosynthesis in nature. Annu Rev Plant Physiol Mol Biol, 45: 633-662. DOI:10.1146/annurev.pp.45.060194.003221 |
Rawat A S, Purohit A N. 1991. CO2 and water vapour exchange in four alpine herbs at two altitudes and under varying light and temperature conditions. Photosynthesis Research (Historical Archive), 28: 99-108. DOI:10.1007/BF00054123 |
Rozdilsky I D, Chave J, Levin S A, et al. 2001. Towards a theoretical basis for ecosystem conservation. Ecological Research, 16: 983-995. DOI:10.1046/j.1440-1703.2001.00446.x |
Sullivan J H, Gitz D C, Peek M S, et al. 2003. Response of three eastern tree species to supplemental UV-B radiation: Leaf chemistry and gas exchange. Agricultural and Forest Meteorology, 120: 219-228. DOI:10.1016/j.agrformet.2003.08.016 |
Vitousek P M, Field C B, Matson P A. 1990. Variation in foliar 13C in Hawaiian Metrosid erospolymorpha: A case of internal resistance?. Oecologia: 362-370. |
Wang H, Wang F L, Wang G, et al. 2007. The responses of photosynthetic capacity, chlorophyll fluorescence and chlorophyll content of nectarine (Prunus persica var. Nectarina Maxim) to greenhouse and field grown conditions. Sci Horticult, 112(1): 66-72. DOI:10.1016/j.scienta.2006.12.007 |
Weng J H, Lai M F. 2005. Estimating heat tolerance among plant species by two chlorophyll fluorescence parameters. Photosynthetica, 43(3): 439-444. DOI:10.1007/s11099-005-0070-6 |
Wielgolaski F E, Karlsen S R. 2007. Some views on plants in polar and alpine regions. Rev Environ Sci Biotechnol, 2007: 33-45. |
Zhang S B, Zhou Z K, Hu H, et al. 2007. Gas exchange and resource utilization in two alpine oaks at different altitudes in the Hengduan Mountains. Can J For Res, 37: 1184-1193. DOI:10.1139/X06-303 |
Zhao Z G, Du G Z, Zhou X H, et al. 2006. Variations with altitude in reproductive traits and resource allocation of three Tibetan species of Ranunculaceae. Australian Journal of Botany, 54(7): 691-700. DOI:10.1071/BT05015 |
 2009, Vol. 45
2009, Vol. 45