文章信息
- 袁金玲, 顾小平, 李潞滨, 岳晋军, 姚娜, 郭广平.
- Yuan Jinling, Gu Xiaoping, Li Lubin, Yue Jinjun, Yao Na, Guo Guangping
- 孝顺竹愈伤组织诱导及植株再生
- Callus Induction and Plantlet Regeneration of Bambusa multiplex
- 林业科学, 2009, 45(3): 35-39.
- Scientia Silvae Sinicae, 2009, 45(3): 35-39.
-
文章历史
- 收稿日期:2008-09-25
-
作者相关文章
2. 中国林业科学研究院林业研究所国家林业局林木培育重点实验室 北京 100091
2. Key Laboratory of Tree Breeding and Cultivation of State Forestry Administrat ionResearch Institute of Forestry, CAF Beijng 100091
孝顺竹(Bambusa multiplex)为禾本科(Poaceae)竹亚科(Bambuseae) NFDB4竹属竹种,广泛分布于亚洲的热带至温带、非洲、大洋州以及南美洲的部分地区(Clayton et al., 2006),并已成功引种至欧洲、北美等地,是一种优良的广适性丛生竹种。在年均温14 ℃以上,最冷月平均气温3 ℃以上,年均湿度70%~80%,极端低温-7~-9 ℃的地区均可生长,为丛生竹中最耐寒的非高山竹种(江泽慧,1996)。孝顺竹姿态飘逸、四季常绿,自古以来为园林绿化不可或缺的造景植物,被广泛用作绿篱、栅栏竹种;竹秆细长强韧,可用于编织、造纸等。
竹类植物因具开花周期长,且难以预测、结实率低下等特殊的生物学习性,使得人们无法像其他植物那样对其进行有计划地选种、育种和多世代遗传改良,比较现实和具发展前景的途径是引进现代生物技术来加快竹子遗传改良的进程。但要想采用生物技术进行竹子的遗传育种,目前最关键的是必须攻克作为基础手段的竹子组织培养中的植株再生难关。尽管早在1982年Mehta等(1982)就报道了印度竹(Bambusa arundinacea)植株再生成功,在随后的20多年中,也有关于此类的多项研究报导(Rao et al., 1985;Yeh et al., 1986a;1986b;Lin et al., 2004;Gillis et al., 2007),但中国作为竹子生产与利用大国在竹子再生方面却鲜有成功的实例。在对孝顺竹的研究中,已报道了采用孝顺竹竹笋或小穗等作为外植体诱导出愈伤组织(Huang et al., 1993;梁群健,1996;吴益民等,2000;顾小平等,2006),但却未见有再生植株的报道。本研究利用孝顺竹小穗、种胚作为外植体材料,诱导出愈伤组织并实现了植株再生,为实现竹子的转基因育种提供了技术平台。
1 材料与方法 1.1 试验材料于2007和2008年7月份在安吉竹博园采集孝顺竹小穗,选择即将开放、健壮饱满的小穗接种,种胚来源于四川泸州的孝顺竹开花竹丛。
1.2 外植体消毒先用体积分数为75%乙醇处理外植体1 min,再用1 g·L-1 HgCl2(每升加5~6滴Tween-80)浸泡15 min,无菌水冲洗4~5次,用无菌滤纸吸干表面水分,接种。由于野外采集的小穗和种实含杂菌较多,故要求消毒必须彻底。
1.3 培养基筛选 1.3.1 愈伤组织诱导和分化的基本培养基筛选愈伤组织诱导及分化的5种基本培养基为MS(Murashige et al., 1962)、NB(吴传银等,1987)、N6(朱至清等,1975)、B5(Gamborg et al., 1968)、CC(Potrykus et al., 1979),激素浓度参照文献(Rao et al., 1985;Yeh et al., 1986a;1986b;)的报导,并根据作者前期试验进行了调整。
诱导培养基:基本培养基+500 mg·L-1脯氨酸+500 mg·L-1谷氨酰胺+300 mg·L-1水解酪蛋白+8 g·L-1卡拉胶(Carrageenan)+4 mg·L-1 2,4-D(MS、NB、N6、B5分别添加30、30、50、20 g·L-1蔗糖,CC添加30 g·L-1蔗糖+20 g·L-1麦芽糖+36.43 g·L-1甘露糖,下同)。pH 5.8,下同。预分化培养基:基本培养基+10 g·L-1卡拉胶+4 mg·L-1 KT。分化培养基:基本培养基+10 g·L-1卡拉胶。
1.3.2 愈伤组织诱导的2,4-D浓度选择诱导培养基:NB+500 mg·L-1脯氨酸+500 mg·L-1谷氨酰胺+300 mg·L-1水解酪蛋白+30 g·L-1蔗糖+8 g·L-1卡拉胶,分别附加1,2,4,6,10 mg·L-1的2,4-D形成D1,D2,D3,D4,D5,共5种愈伤组织诱导培养基。
预分化培养基:MS+30 g·L-1蔗糖+10 g·L-1卡拉胶+4 mg·L-1 KT。
分化培养基:MS+30 g·L-1蔗糖+10 g·L-1卡拉胶。
1.3.3 种胚愈伤组织预分化培养基的优化取D3培养基诱导出的淡黄色致密种胚愈伤组织,增殖后分切成约5 mm大小较均一团块,接种到不同预分化培养基上对培养基进行筛选。
预分化培养基的参试因子包括:MS大量元素、6-BA、KT和GA3 4因素,分别设置3个水平,其中MS大量元素包括1MS(MS培养基中的大量元素取其标准量)、3/4MS(大量元素取其标准量的3/4)、1/2MS(大量元素取其标准量的1/2)3个水平;6-BA为1,3,6 mg·L-1 3水平,KT为1,3,6 mg·L-1 3个水平,GA3为0,1,3 mg·L-1 3个水平,采用正交设计L9(34),共9个处理。各处理接种5个培养皿,每培养皿接入10块愈伤组织。
分化培养基:MS+30 g·L-1蔗糖+10 g·L-1卡拉胶。
1.3.4 生根培养基MS+30 g·L-1蔗糖+10 g·L-1卡拉胶+2 mg·L-1 NAA。
1.4 培养条件与统计方法小穗和种胚外植体接种后及时挑出受污染部分,没污染的经暗培养20 d,统计愈伤组织诱导率及褐变率,然后将愈伤组织转入预分化培养基光照培养7 d,转接到分化培养基光照培养14 d统计丛芽分化情况。诱导与继代增殖阶段皆为黑暗培养;其余阶段在12 h·d-1光照条件下进行,光照强度2 000 lx,温度26 ℃。
诱导率=诱导出愈伤组织的外植体数/无菌外植体数×100%,褐变率=愈伤组织褐变数/愈伤组织总数×100%;芽分化率=分化芽的愈伤组织数/愈伤组织总数×100%;分化根率=分化根的愈伤组织数/愈伤组织总数×100%;白化率=白化苗数/再生苗数×100%。
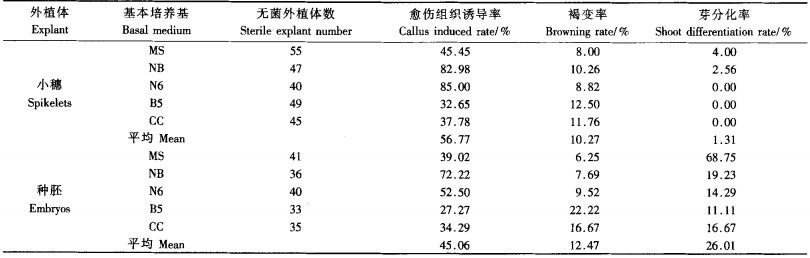
2 结果与分析 2.1 基本培养基种类对孝顺竹愈伤组织诱导和分化的影响孝顺竹小穗、种胚外植体在5种培养基上的愈伤组织诱导和芽分化情况如表 1所示。小穗接种后一般7 d出现愈伤组织,10 d愈伤组织普遍发生;多数愈伤组织为表面疏松颗粒状,白色,质地松软,增殖速度快,继代培养容易褐变;少数为质地坚硬,表面光滑,白色或浅黄色,继代培养不易褐变(图版Ⅰ-1)。小穗轴最易形成愈伤组织,子房、花丝、内外稃片基部等也能形成愈伤组织,其诱导难易顺序为小穗轴>花丝>子房>内外稃片基部,花药、花粉未发现愈伤组织形成。种胚一般接种后3 d出现愈伤组织,7 d后多数种胚形成愈伤组织;产生的愈伤组织分淡黄色致密和白至灰色松软2种,前者具有较高的分化潜能(图版Ⅰ-2);后者极少能分化出芽苗。
|
|

|
图版Ⅰ Plate Ⅰ |
从表 1可以看出,就愈伤组织诱导而言,小穗外植体以N6,NB培养基的诱导率最高,分别达85.0%,82.98%;种胚外植体以NB培养基诱导率最高,达72.22%,而N6培养基的诱导率也达到52.50%;2种外植体在MS,CC,B5培养基的诱导率均较低。故N6,NB培养基可作为孝顺竹愈伤组织诱导的理想培养基。2种外植体愈伤组织在NB,N6,MS培养基上的褐变率较低,在B5,CC培养基上褐变率稍高,小穗愈伤组织平均褐变率略低于种胚愈伤组织。小穗愈伤组织分化芽极少,仅在MS,NB培养基上各分化1块,分化率分别为4.0%和2.56%,在N6,B5,CC培养基上均没有分化植株;种胚愈伤组织在5种培养基上均能分化出芽,以MS分化效果最好,高达68.75%,其他4种培养基的分化率均<20%。
比较试验结果可以看出:小穗外植体更容易诱导出愈伤组织,但分化绿芽困难,再生率极低;种胚外植体愈伤组织诱导较为容易,芽分化率较高。愈伤组织诱导阶段选用NB或者N6作为基本培养基较为适合,分化阶段可选用MS基本培养基。
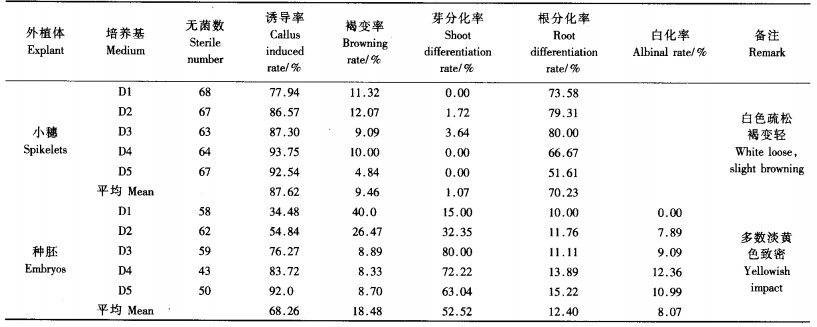
2.2 2,4-D质量浓度对愈伤组织诱导质量的影响为筛选孝顺竹愈伤组织诱导的最佳2,4-D质量浓度,将小穗、种胚2种不同的外植体分别接种到D1~D5培养基上。由表 2可以看出,小穗外植体愈伤组织的诱导率较高,为77.94%~93.75%,且随2,4-D质量浓度提高诱导率呈上升趋势;褐变率较低,为4.84%~12.07%,随2,4-D质量浓度提高褐变率略有下降。但小穗愈伤组织芽分化率极低,5种培养基诱导出的愈伤组织仅有3块分化出苗:其中D3培养基诱导的愈伤组织中有2块分化成苗,D2培养基诱导出的愈伤组织中有1块分化成苗,其他培养基诱导的愈伤组织无分化,分化率平均为1.07%(图版Ⅰ-3);较为特别的是小穗愈伤组织具有较高的根分化率,众多愈伤组织在分化培养条件下无法分化出芽,却能分化成根,分化率51.61%~80.0%(图版Ⅰ-4)。
|
|
种胚在不同培养基上的愈伤组织诱导率为34.48%~92.00%,表现出随2,4-D质量浓度增加而提高的趋势,D1培养基愈伤组织诱导率只有34.48%,而D3培养基达到76.27%。D1,D2培养基诱导出的愈伤组织褐变率分别为40.00%,26.47%,D3~D5培养基诱导出的愈伤组织褐变率均≤9%,表明2,4-D在4 mg·L-1及以上浓度褐变减少。种胚愈伤组织在预分化培养基上培养7 d,开始变绿(图版Ⅰ-5,6),转到分化培养基上14 d分化出完整丛芽(图版Ⅰ-7~9),分化率为15.0%~80.0%,以D3培养基诱导的愈伤组织分化率最高;种胚愈伤组织分化过程中也出现部分团块不能分化出芽、却能分化成根的现象,分化率10.0%~15.22%;另外再生苗中常出现白化苗,部分白化苗由独立的愈伤组织分化而成,也有的白化苗与绿色苗由同一愈伤组织团块分化产生,不同培养基上白化苗发生的比例为0~12.36%,平均为8.07%;偶尔也会出现花叶苗(绿色叶片上出现白色条纹)(图版Ⅰ-10),这些白化苗和花叶苗的出现可能与培养条件有关。
2.3 种胚愈伤组织预分化培养基的优化对种胚愈伤组织预分化培养基进行正交优化试验的L9(34)结果如表 3所示。可以看出,在分化率方面,GA3处理的极差最大,且以不添加GA3的预分化培养基最终分化率最高,表明GA3的添加不利于愈伤组织分化;6-BA极差次之,随着6-BA浓度升高最终分化率升高,表明6-BA对愈伤组织分化起促进作用;基本培养基以3/4MS预分化后,分化率最高,KT以3 mg·L-1预分化效果最好。在丛芽分化数方面,愈伤组织一次发生丛芽最多的为9株,平均每块3.50株;KT的极差最大,且以3 mg·L-1质量浓度时丛芽数最多;6-BA极差次之,3 mg·L-1时分化丛芽数最多;GA极差最小,对丛芽发生数影响不大;MS大量元素降低时丛芽发生数也随之降低。4种因子不同水平间分化率和丛芽数的方差分析均未达显著水平。试验中也发现,部分愈伤组织块甚至仅分化1株芽苗,所以综合考虑分化率及丛芽数,认为在能够实现分化的前提下,增加丛芽数较为关键。在6-BA质量浓度为6 mg·L-1的培养基上,虽然分化率较高,但却容易分化为细碎叶状物,成苗质量差。因此认为孝顺竹种胚愈伤组织最佳预分化培养基为MS培养基+3 mg·L-1 6-BA+3 mg·L-1 KT。
|
|
愈伤组织分化丛芽在MS+30 g·L-1蔗糖+10 g·L-1卡拉胶+2 mg·L-1 NAA培养基上生根良好(图版Ⅰ-11)。孝顺竹再生试管苗在生根培养基中培养1周后,开瓶炼苗3 d,取出小苗在自来水下洗净根部的培养基,用低浓度高锰酸钾溶液润洗根部,然后栽植到灭菌的介质中〔山地黄壤土:蛭石:泥炭土(质量比)=1:1:1〕,遮荫散射光照射,1个月统计成活率为72%(图版Ⅰ-12)。
3 结论与讨论利用孝顺竹小穗和种胚为外植体开展愈伤组织诱导和分化试验,结果表明,NB、N6基本培养基添加4 mg·L-1 2,4-D对小穗和种胚愈伤组织诱导效果较好;种胚愈伤组织预分化较适宜的培养基为MS附加3 mg·L-1 KT和3 mg·L-1 6-BA。小穗外植体愈伤组织的诱导率较高,可达87.30%,但芽分化率≤4.0%,这可能与愈伤组织的状态有关,诱导愈伤组织的培养基有待进一步优化;种胚外植体的愈伤组织诱导率稍低于小穗外植体,达76.27%,但芽分化率高达80.0%。
试验过程中发现孝顺竹愈伤组织大致可分为3种类型:第1种是胚性愈伤组织,表面颗粒状,质地松脆,白色至淡黄色,多数能够分化;第2种是非胚性愈伤组织,表面颗粒状或光滑,质地疏松,水渍状,白色,继代增殖速度快,不易分化;第3种非胚性愈伤组织,表面光滑发粘,质地疏松,暗黄色,继代后易褐变,分化困难。愈伤组织的分化若缺少预分化过程,直接在没有激素的MS培养基上培养,则芽头分化率显著降低;若在预分化培养基上延长时间至10 d以上,愈伤组织变绿后往往褐变死亡,因此及时将预分化的愈伤组织转移到无激素培养基上至关重要。分化芽苗在无激素的培养基上培养会有少量细根出现,而在添加2 mg·L-1 NAA的培养基上则生根较多且粗壮。另外,在试验过程中发现,部分致密松脆型愈伤组织经过1年多的继代培养后,虽然在多种培养基上均未能分化成苗,但个别培养基上的根分化率较高,有的甚至达100%,部分团块会出现黄绿色类似芽头的分化,尚有待进一步调整试验,进一步优化孝顺竹再生体系。
致谢:
部分试验用开花材料由周昌平先生提供,特致感谢。
顾小平, 苏梦云, 岳晋军, 等. 2006. 几种丛生竹愈伤组织诱导与防褐变技术研究. 林业科学研究, 19(1): 75-78. DOI:10.3321/j.issn:1001-1498.2006.01.014 |
江泽慧. 1996. 世界竹藤. 北京: 辽宁科学技术出版社, 358.
|
梁群健. 1996. 绿竹、麻竹和蓬莱竹的组织培养. 国立台湾大学硕士论文.
|
吴传银, 陈英. 1987. 粳稻花药培养基因型差异的研究. 遗传学报, 14(3): 168-174. |
吴益民, 边红武, 王君晖, 等. 2000. 竹子悬浮细胞系的建立和组织培养试管苗移栽观察. 竹子研究汇刊, 19(1): 52-56. DOI:10.3969/j.issn.1000-6567.2000.01.009 |
朱至清, 王敬驹, 孙敬三, 等. 1975. 通过氮源比较试验建立一种较好的水稻花药培养基. 中国科学, (5): 484-490. |
Clayton W D, Harman K T, Williamson H. 2006. GrassBase—The Online World Grass Flora[EB/OL]. [2006-11-08]. http: //www.kew.org/data/grasses-db.html.
|
Gamborg O L, Miller R A, Ojima K. 1968. Nutrient requirements of suspension cultures of soybean root cell. Experimental Cell Research, (50): 151-158. |
Gillis Koen, Gielis Johan, Peeters Hilde, et al. 2007. Somatic embryogenesis from mature Bambusa balcooa Roxburgh as basis for mass production of elite forestry bamboos. Plant Cell Tiss Organ Cult, 91: 115-123. DOI:10.1007/s11240-007-9236-1 |
Huang L C, Huang B L. 1993. Bamboo tissue culture//Recent Advances in Botany. Institute of Botany, Academia Sinica Monograph Series, (13): 203-212.
|
Lin C S, Lin C C, Chang W C. 2004. Effect of thidiazuron on vegetative tissue-derived somatic embryogenesis and flowering of bamboo Bambusa edulis. Plant Cell, Tissue and Organ Culture, 76: 75-82. DOI:10.1023/A:1025848016557 |
Mehta U I, Rao V R, Ram H Y M. 1982. Somatic embryogenesis in bamboo//Proc. 5th Int Congr Plant Tissue Cell Culture. Plant Tissue Culture. Tokyo, Japan, 109-110.
|
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant, (15): 473-497. |
Potrykus I, Harms C T, Lörz H. 1979. Callus formation from cell culture protoplasts of corn (Zea mays L.). Theor Appl Genet, (54): 209-214. |
Rao I U, Ramanuja Rao I V, Narang V. 1985. Somatic embryogenesis and regeneration of plants in the bamboo Dendrocalamus strictus. Plant Cell Reports, 4: 191-194. DOI:10.1007/BF00269286 |
Yeh M, Chang W. 1986a. Plant regeneration through somatic embryogenesis in callus culture of green bamboo (Bambusa oldhamii Munro). Theor Appl Genet, 73: 161-163. DOI:10.1007/BF00289269 |
Yeh M, Chang W. 1986b. Somatic embryogenesis and subsequent plant regeneration from inflorescence callus of Bambusa beecheyana Munro var. beecheyana. Plant Cell Reports, 5: 409-411. DOI:10.1007/BF00269628 |
 2009, Vol. 45
2009, Vol. 45