文章信息
- 卢江杰, 胜彦吉永, 方伟, 汤定钦.
- Lu Jiangjie, Katsuhiko Yoshinaga, Fang Wei, Tang Dingqin
- 3种竹类植物杂种的分子鉴定
- Identification of the Hybrid Bamboo F1 by SSR Markers
- 林业科学, 2009, 45(3): 29-34.
- Scientia Silvae Sinicae, 2009, 45(3): 29-34.
-
文章历史
- 收稿日期:2008-11-12
-
作者相关文章
2. 日本世界竹子研究所 Fukuoka 824-0076
2. World Bamboo Research Center Fukuoka 824-0076
竹类植物是禾本科(Gramineae)竹亚科(Bambusoideae)植物的总称。全世界有竹类植物70多属1 200多种,主要分布在亚洲、非洲和拉丁美洲的热带、亚热带区域。竹类资源作为陆地上森林资源的重要组成部分,约占世界森林总面积的1%。与其他重要经济林木相比,竹子的遗传育种研究与新品种选育工作相对落后,其主要原因是竹类植物很少开花,开展多世代遗传改良研究非常困难。为了改良竹笋、材的品质,加快竹子生长速度和增强抗逆性等特性,国内从20世纪70年代就尝试开展竹类植物的杂交育种工作,利用竹类植物自然开花的机会,主要开展了以麻竹(Dendrocalamus latiflorus)为父母本与版纳甜龙竹(D. hamiltonii)、毛笋竹(Gigantochloa levis)、吊丝竹(Dendrocalamus minor)、撑篙竹(Bambusa pervariabilis)的有性杂交,从杂种后代中选育出优良笋用竹撑麻7号等(张光楚,2000);以撑篙竹为母本,用麻竹和青皮竹(B. textilis)混合授粉选育出生长迅速、材质较好、抗逆性强、外形美观的撑麻青1号(张光楚等,1980);以撑篙竹为母本,大绿竹(B. grandis)为父本选育出径级大、无性繁殖力强和竹材造纸性能好的撑绿3、6、8、30号等(宁材强等,1995)。这些杂交,均为丛生竹种间的组合。另外也有竹子与水稻(Oryza sativa)成功地远缘杂交,获得高产、优质、中抗等优良性状竹稻的研究报道(张在忠等,2007)。
杂交种的基因交流程度、父母本对杂种的遗传贡献大小以及杂交后代的真实性鉴定,常用方法有形态学标记、细胞学标记、同工酶标记和DNA分子标记等。随着生物技术的不断发展,各种标记技术从单一应用到结合应用,越来越广泛地在杂种鉴定中发挥作用。如形态学标记是杂种鉴定的基础,在小麦(Triticum aestivum)中结合细胞学成功地进行表型分析和染色体计数(蔡华等,2008);在菊属(Dendranthema)中,结合细胞学和RAPD技术,鉴定菊属与亚菊属(Ajania)属间的杂种,并推测亲缘关系(D'Hont et al., 1995;赵宏波等,2007)。就单种技术RAPD来看,其实验操作简单,成本低,在甘蔗(Saccharum officinaram)、披碱草(Elymus dahuricus)和野大麦(Hordeum brevisubulatum)等很多物种的杂种鉴定中得到运用(肖关丽等,2003;李造哲等,2005);AFLP技术也应用于冬枣(Zizyphus jujuba)、梅(Prunus mume)、埃塞俄比亚芥(Brassica carinata)和白菜型油菜(Brassica rapa)远缘杂种的鉴定中(陈瑞丹等,2004;鹿金颖等,2005;江莹芬等,2007)。RAPD和AFLP为显性标记,SSR(Simple Sequence Repeat)标记是一种根据由2~5个核苷酸为单位多次串联重复的长达几十甚至几百个核苷酸的序列的两端的保守序列开发的一种共显性分子标记,数量丰富、多态性高、实验操作简单、结果稳定可靠,被认为是目前杂种鉴定的一种理想的分子标记。在水稻、棉花(Gossypium hirsutum)、玉米(Zea mays)、西红柿(Lycopersicon esculentum)和松(Pinus)等杂种的鉴定中SSR分子标记都得到很好的运用(Rajora et al., 2003;Xin et al., 2005; 李召华等,2006;吴玉香等,2007;薛艳颖等,2007)。
为了加速竹子的育种进程,浙江省现代森林培育技术重点实验室收集了近年开花的竹种,建立了开花竹种圃,并尝试着开展了竹种间的杂交,获得了一批疑似杂种。从NCBI的GenBank中的毛竹(Phyllostachys edulis) GSS(genome survey sequences)序列开发了一批SSR标记。本研究利用毛竹的SSR标记对几种竹子杂交种进行鉴定,以确定其杂种的真实性,为开展杂交竹种的其他研究工作奠定基础。这是有关丛生竹以外竹种杂交的首次报道,也是杂交竹种DNA分子鉴定的首次报道。
1 材料与方法 1.1 试验材料试验所用的材料见表 1。开花竹种Pleioblastus simonii, Sasa tokugawana, S. borealis和业已确认杂种Sinobambusa tootsik × Pl. distichus (1974年由岡山大学的村松幹夫完成杂交)收集于日本富士竹种园,早竹(Phyllostachys violascens)收集于浙江临安。开花竹种间进行人工授粉结实后获疑似杂交种子,育苗。采集亲本和杂种竹苗的嫩叶带回实验室,提取DNA以备SSR分子标记鉴定用。
|
|
各杂交竹种和亲本的DNA提取采用修改后的CTAB法(Doyle et al., 1987)。所提取的DNA用0.8%琼脂糖凝胶电泳检测片段大小,UV-2401PC(岛津)紫外分光光度计检测A260、A280值并定量。
1.2.2 PCR分析与SSR测序确认在已开发的毛竹SSR标记中,发现有10个SSR在其他的竹种中具有较高的通用性1)。选用这些SSR相应的引物(上海生物工程公司合成)对杂种及其父母本的DNA进行PCR扩增。PCR反应体系为20 μL,其中包括:10×Buffer 2 μL,MgCl2 (25 mmol·L-1) 1.2 μL,dNTPs (10 mmol·L-1) 0.6 μL,Taq聚合酶(5 U·μL-1)0.25 μL,DNA模板50~100 ng,引物(25 mmol·L-1)0.5 μL。PCR反应程序为:94 ℃预变性5 min,32个循环(94 ℃变性40 s,各引物退火温度下复性40 s,72 ℃延伸90 s),最后72 ℃延伸10 min后4 ℃保存。最后扩增产物中加变性缓冲液后,用4%变性聚丙烯酰胺胶(厚度0.4 mm)和1×TBE电泳缓冲液电泳分离。电泳是用美国C.B.S.测序胶电泳系统进行,预电泳30 min后上样100 W恒功率电泳约2 h后银染检测,银染方法参照Panaud等(1996)。
1) Tang Dingqin, Lu Jiangjie, Zhang Shan, et al. Development, characterization and utilization of microsatellite markers from GenBank database in Phyllostachys edulis and related species of Phyllostachys (in press).
对电泳分离后的SSR相应位点上的DNA条带进行测序确认,具体的步骤是:割下聚丙烯酰胺凝胶中的银染信号最强的SSR位点上的条带,用10 μL的TE溶液(10 mmol·L-1 Tris-HCl, 1 mmol·L-1 EDTA, pH8.0)在PCR仪上94℃ 30 min,然后离心取上清作为二次PCR模板,在与上述相同的PCR反应体系和反应程序下,用各位点相对应的SSR引物进行扩增,扩增产物用1%的琼脂糖凝胶进行分离,对目的条带用胶回收试剂盒(QIAquick Gel Extraction Kit, QIAGEN)进行回收,回收产物用pMD18-T vector (TAKARA)进行16 ℃过夜连接,转化Top10感受态细胞后(TAKARA)进行亚克隆,最后挑取阳性克隆培养,提取质粒后进行测序,测序工作在3100 Avant Genetic Analyzer (ABI)上完成。
2 结果与分析 2.1 毛竹SSR标记在杂种鉴定中的运用使用10个毛竹SSR标记,对3个杂交竹种的真实性进行鉴定,试验结果表明其中的3个SSR标记可有效地应用于上述杂种的分子鉴定。表 2列出了这3个SSR分子标记的来源及其PCR的试验条件等。这3个SSR分子标记在毛竹所在的刚竹属的多个竹种中也具有很高的通用性(数据未发表),并且在本研究中PBM014和PBM025可应用于多个竹种杂种的分子鉴定。
|
|
PCR产物经4%变性聚丙烯酰胺胶电泳分离后,银染观察各SSR标记在杂种及其亲本间的条带变化,疑似杂种的电泳条带应该是其父母本条带的组合。以业已从形态等证实为杂种的H7的分子鉴定为例(图 1),PBM014位点上扩增产物的电泳图(图 1左上)中可以看到,H7的条带2可能来自母本的1,条带3可能是父本中的4;在PBM025位点上的扩增产物的电泳图(图 1左下)中观察到同样扩增条带组合方式。进一步对PBM014位点上扩增的条带进行测序、序列比对(图 1右)结果发现:所有的条带均含有(CT)7-11和(CAT)3的SSR,母本条带H7-1的SSR重复数为11,父本中的H7-4的重复数为7,可确认为SSR分子标记;同时杂种H7的条带2与母本的条带1,H7的条带3与父本的条带4拥有共同的DNA序列,说明了杂种H7具有来自于父母本的DNA条带,在PBM014位点上表现为杂合体。此结果为杂种Sinobambusa tootsik × Pleioblastus distichus提供了新的分子证据。

|
图 1 SSR标记对杂交竹种H7的鉴定 Figure 1 Identification of the bamboo hybrid H7 by SSR markers 左图表示H7及其亲本在PBM014(上)和PBM025(下)位点上的电泳条带的分离; 右图表示H7及其亲本在PBM014 SSR位点上的等位基因的序列比对 Microsatellite DNA fingerprints of Sinobambusa tootsik × Pleioblastus distichus at the PBM014 (left-above) and PBM025 (left-nether) locus, and its alignment of allele sequences at PBM014 locus (right). |
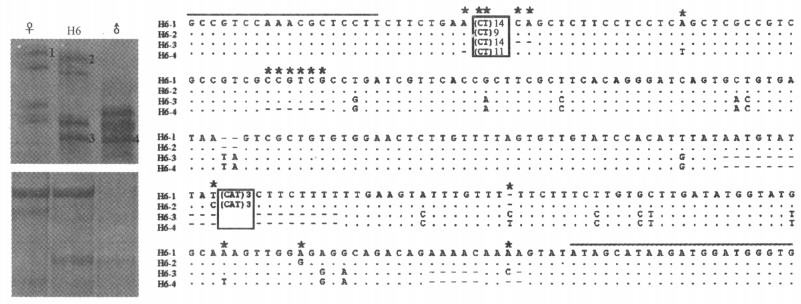
图 2为疑似杂种H6的鉴定分析。从PBM014位点上扩增产物的电泳图(图 2左上)中可以看到,H6的条带2可能来自母本的1,条带3可能是父本中的4;在PBM025位点上的扩增产物的电泳图(图 2左下)中观察到同样扩增条带组合方式。进一步对PBM014位点上扩增的条带进行测序、序列比对(图 2右)结果发现:所有的条带均含有(CT)9-14的SSR,确认为SSR分子标记,父母本的多态性由SSR重复数的变化和H6-4比H6-1缺失了序列AATGTATTAT(CAT)3CTTCTTTT和AAAAC形成;同时疑似杂种H6的条带2与母本的条带1,H6的条带3与父本的条带4拥有共同的DNA序列,说明了疑似杂种H6具有来自于父母本的DNA条带,在PBM014位点上表现为杂合体,可据此推断H6为Sasa tokugawana和S. borealis的杂种。
|
图 2 SSR标记对疑似杂交竹种H6的鉴定 Figure 2 Identification of the bamboo hybrid candidate H6 by SSR markers 左图表示H6及其亲本在PBM014(上)和PBM025(下)位点上的电泳条带的分离; 右图表示H6及其亲本在PBM014 SSR位点上的等位基因的序列比对 Microsatellite DNA fingerprints of Sasa tokugawana × S. borealis at the PBM014 (left-above) and PBM025 (left-nether) locus, and its alignment of allele sequences at PBM014 locus (right). |
图 3是利用SSR鉴定疑似杂种H4的结果。从图 3可以看出疑似杂种H4在PBM014和PBM025位点上扩增条带(图 3左)及其序列(图 3右)的变化与H7和H6的情况非常相近,亲本的多态性条带中,父母本H4-4和H4-1重复数都是(CT)4,相对于H4-1,H4-4缺失了TCACCG一段序列而产生了多态性,子代中的H4-2和H4-3同源于亲本的H4-1和H4-4(图 3右)。据此可推断H4为Pleioblastus simonii和Phyllostachys violascens的杂种。

|
图 3 SSR标记对疑似杂交竹种H4的鉴定 Figure 3 Identification of the bamboo hybrid candidate H4 by SSR markers 左图表示H4及其亲本在PBM014(上)、PBM018(中)和PBM025(下)位点上的电泳条带的分离; 右图表示H4及其亲本在PBM014 SSR位点上的等位基因的序列比对 Microsatellite DNA fingerprints of Pleioblastus simonii × Phyllostachys violascens at the PBM014 (left-above), PBM018 (left-middle) and PBM025 (left-nether) locus, and its alignment of allele sequences at PBM014 locus (right). |
SSR标记的引物是根据重复序列两端相对保守的单拷贝序列设计的,其扩增产物稳定;重复数在种间、种内都高度可变;为共显性的标记,比显性标记提供更多的信息(Powell et al., 1996)。在本试验中,利用毛竹SSR标记对其他杂交竹种开展分子鉴定,亲本的SSR位点等位基因多态性丰富,在对应位点上的等位基因在亲本和杂交子代上稳定遗传,表明确实有遗传物质的交流,直接证实了所待测疑似杂种的真实性。由于用于鉴定的疑似杂种为种间杂种,其亲本分属于刚竹属(Phyllostachys)、大明竹属(Pleioblastus)、唐竹属(Sinobambusa)和赤竹属(Sasa),它们之间以及与毛竹之间的亲缘关系较远;且SSR在不同物种间的通用性(transferability)不是很高(Rossetto, 2001),加上父母本间必须具有多态性等要求,筛选合适的位点比较困难。本试验筛选的3个SSR标记可以成功鉴定3个疑似杂种的真实性,其中PBM014和PBM025都可以鉴定3个杂种,PBM018可以鉴定1个杂种(表 2)。
理论上杂交子代的遗传物质应该都是来自亲本,那么相对应的位点上的杂交子代与亲本的序列应该都是一致的。在现有的3个杂种的分子鉴定过程中,在PBM014位点上同源序列分析发现H6 (即H6-1和H6-2, H6-3和H6-4)中SSR的重复次数、SSR两侧的序列有个别碱基发生变化等现象(见图 2中*所示),在H4和业已从形态上得以鉴定的杂种H7(与日本富士竹类植物园的多贺氏的交流)也出现后一种现象。这种现象是否具有普遍性需要进一步开展多位点序列分析。产生这一现象的原因仍未清楚,可能与SSR在亲子之间的传递特性有关,也可能与SSR位点的特性有关,本研究利用的PBM014位点上扩增的片段经NCBI上BLAST (http: //blast.ncbi.nlm.nih.gov/Blast.cgi)分析发现与水稻7号染色体上一段序列有很高的相似性,是一个功能不明确的基因片段
随着细胞生物学方法的不断发展,除传统的染色体数量特征、染色体核型(染色体数目、大小、随体和着丝点位置等)分析和带型(C带、N带和G带)分析等技术外,利用染色体组DNA作探针的原位杂交技术(GISH)可准确地鉴定杂种,如通过杂交插入小麦基因组中的大麦(Hordeum vulgare)(Malysheva et al., 2003)、黑麦(Secale cereale )(Silkova et al., 2006)、披碱草、大赖草(Leymus racemosus)和偃麦草(Elytrigria repens)(Tang et al., 1997)的染色体片段得到了准确的确认。竹类植物染色体的研究仍然局限在核型分析、染色体计数水平上(李秀兰等,1999;2001;陈瑞阳等,2002),分子标记、分子杂交技术的开发与应用刚刚起步,因此杂种的综合鉴定还有待于进一步开发和研究。
蔡华, 马传喜, 乔玉强. 2008. 小麦×玉米诱导小麦单倍体的形态学及细胞学鉴定. 核农学报, 22(2): 127-130. |
陈瑞丹, 张启翔. 2004. 梅花杂交育种中杂种F1代的早期鉴定. 北京林业大学学报, 26(增刊): 64-70. |
陈瑞阳, 李秀兰, 宋文芹, 等. 2002. 中国主要经济植物基因组染色体图谱. 北京: 科学出版社, 625-628.
|
江莹芬, 田恩堂, 陈伦林, 等. 2007. 埃塞俄比亚芥和白菜型油菜远缘杂交种F1的鉴定. 中国油料作物学报, 29(2): 103-106. |
李秀兰, 刘松, 宋文芹, 等. 1999. 40种散生竹的染色体数目. 植物分类学报, 37(6): 541-544. |
李秀兰, 林汝顺, 冯学琳, 等. 2001. 中国部分丛生竹类染色体数目报道. 植物分类学报, 39(5): 433-442. |
李召华, 朱克永, 陈祖武, 等. 2006. SSR分子标记技术在杂交水稻种子纯度鉴定中的应用. 杂交水稻, 21(4): 11-14. DOI:10.3969/j.issn.1005-3956.2006.04.003 |
李造哲, 云锦凤, 尹俊. 2005. 披碱草和野大麦及其杂种F1与BC1代的RAPD分析. 草业科学, 22(10): 31-35. DOI:10.3969/j.issn.1001-0629.2005.10.007 |
鹿金颖, 毛永民, 申莲英, 等. 2005. 用AFLP分子标记鉴定冬枣自然授粉实生后代杂种的研究. 园艺学报, 32(4): 680-683. DOI:10.3321/j.issn:0513-353X.2005.04.023 |
宁材强, 戴启惠. 1995. 撑篙竹×大绿竹杂交选育的研究. 广西林业科学, 24(4): 167-168. |
吴玉香, 高燕会, 祝水金, 等. 2007. 4个栽培棉种间四元杂种的SSR分子标记鉴定. 浙江大学学报:农业与生命科学版, 33(1): 56-60. |
肖关丽, 李富生, 杨清辉, 等. 2003. RAPD分子标记在甘蔗杂种鉴定中的应用研究. 西南农业大学学报, 25(3): 207-209. DOI:10.3969/j.issn.1673-9868.2003.03.006 |
薛艳颖, 陈兴奎, 樊严, 等. 2007. SSR分子标记技术在杂交玉米种子纯度鉴定中的应用. 杂粮作物, 27(1): 6-7. DOI:10.3969/j.issn.2095-0896.2007.01.003 |
张光楚, 陈富枢. 1980. 优良的竹子有性杂种—撑麻青1号. 林业科学, 16(增刊): 124-126. |
张光楚. 2000. 竹子育种工作近况. 竹子研究汇刊, 19(3): 13-15. DOI:10.3969/j.issn.1000-6567.2000.03.005 |
张在忠, 赵仁发, 钟章美, 等. 2007. 远缘杂交水稻竹稻966的杂交选育与性状表现. 安徽农业通报, 13(11): 121-122. |
赵宏波, 陈发棣, 郭维明, 等. 2007. 菊属与亚菊属属间杂种的鉴定及其分类学意义. 植物分类学报, 45(5): 661-669. |
D'Hont A, Rao P S, Feldmann P, et al. 1995. Identification and characterization of sugarcane intergeneric hybrids, Saccharum officinarum × Erianthus arundinaceus, with molecular markers and DNA in situ hybridization. Theoretical and Applied Genetics, 91: 320-326. |
Doyle J J, Doyle J L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemistry Bull, 19: 11-15. |
Malysheva L, Sjakste T, Matzk F, et al. 2003. Molecular cytogenetic analysis of wheat-barley hybrids using genomic in situ hybridization and barley microsatellite markers. Genome, 46: 314-322. DOI:10.1139/g02-117 |
Panaud O, Chen X, McCouch S R. 1996. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (Oryza sativa L.). Molecular General Genetics, 252: 597-607. |
Powell W, Machray G C, Provan J. 1996. Polymorphism revealed by simple sequence repeats. Trends Plant Sci, 1: 215-222. DOI:10.1016/S1360-1385(96)86898-0 |
Rajora P, Rahman H. 2003. Microsatellite DNA and RAPD fingerprinting, identification and genetic relationships of hybrid poplar (Populus × canadensis) cultivars. Theoretical and Applied Genetics, 106(3): 470-477. DOI:10.1007/s00122-002-1082-2 |
Rossetto M. 2001. Sourcing of SSR markers from related plant species// Henry R J. Plant genotyping: The DNA fingerprinting of plants. CABI Publishing, CAB International, Wallingford, Oxon OX 10 8DE, UK, 211-224.
|
Silkova O G, Dobrovolskaya O B, Dubovets N I, et al. 2006. Production of wheat-rye substitution lines and identification of chromosome composition of karyotypes using C-banding, GISH, and SSR markers. Russian Journal of Genetics, 42(6): 645-653. DOI:10.1134/S1022795406060093 |
Tang Shunxue, Zhuang Jiajun, Wen Yuxiang, et al. 1997. Identification of introgressed segments conferring disease resistance in a tetrageneric hybrid of Triticum, Secale, Thinopyrum, and Avena. Genome, 40(1): 99-103. DOI:10.1139/g97-013 |
Xin Yeyun, Zhang Zhan, Xiong Yiping, et al. 2005. Identification and purity test of super hybrid rice with SSR molecular markers. Rice Science, 12(1): 7-12. |
 2009, Vol. 45
2009, Vol. 45



