文章信息
- 李志真.
- Li Zhizhen
- 杨梅根瘤内生菌的生物学特性
- The Biological Characteristics of Actinomycetes Frankia Living in Roots of Myrica rubra
- 林业科学, 2009, 45(1): 81-87.
- Scientia Silvae Sinicae, 2009, 45(1): 81-87.
-
文章历史
- 收稿日期:2008-03-14
-
作者相关文章
2. 福建师范大学地理科学学院 福州 350007
2. College of Geographical Sciences, Fujian Normal University Fuzhou 350007
Frankia是一类能与非豆科植物共生结瘤的放线菌,在自然状态下通过共生体系固定大气中氮素,改善土壤肥力,增强宿主植物抗逆性,促进植物在贫瘠地区的生长(曾定,1987)。开展Frankia共生固氮研究,对提高共生固氮效率、改善生态环境有重要意义。杨梅(Myrica rubra)是我国南方的特产果树,与Frankia共生结瘤固氮,具有重要的生态和经济价值。杨梅地理分布广泛,能被不同类群的Frankia侵染,是混杂性宿主(Huguet et al., 2001;熊智等,2003)。目前分离培养的杨梅Frankia菌株来源及数量有限,研究较少。何新华等(2003)对3株浙江杨梅共生菌株进行形态培养、碳源利用、固氮活性的研究,范小明(2003)研究1株福建杨梅共生菌在不同接种条件下的回接侵染效果。大范围地收集不同生态类型的杨梅Frankia,系统研究其生物学特性,以期深入了解、保护和利用Frankia资源是十分必要的。本文是对福建山地和果园生长的12株杨梅根瘤内生菌生物学特性进行研究。
1 材料与方法 1.1 试验菌株12个供试杨梅根瘤内生菌和来自细枝木麻黄(Casuaria cunninghamiana)、短枝木麻黄(C.equisetifolia)、粗枝木麻黄(C.glauca)和四川桤木(Alnus crematogyne)根瘤的5个对照菌株基本情况见表 1,其中菌株2215和9550分别由中国科学院微生物研究所刘志恒先生和中国林业科学研究院热带林业研究所康丽华女士惠赠。
|
|
将供试菌株分别接种于NA2S基础培养基,简称S(Lechevalier et al., 1983)、BAP(Murry et al., 1989)和JA(Akkermans et al., 1983)液体培养基中,28 ℃培养4~12周,用光学显微镜和电子显微镜观察其形态结构。
1.2.2 培养特征观察将供试菌株接种于S,BAP,JA和Qmod(Lalonde et al., 1981)液体培养基及S斜面培养基中,28 ℃培养4~8周,观察其菌落特征。
1.2.3 细胞壁类型划分供试菌株在BAP中培养4周后,以梁蓉芳等(1990)、胡传炯等(1997)等方法提取细胞壁,用氨基酸自动测定仪测定细胞壁二氨基庚二酸、丙氨酸、谷氨酸和甘氨酸的含量,计算其比值,并确定细胞壁类型。丙氨酸与甘氨酸的分子比值低于3的划分为细胞壁类型Ⅱ,介于3.0~7.8的归为细胞壁类型Ⅲ。
1.2.4 固氮酶活性测定经同步预培养的供试菌株接种于无氮源的BAP液体培养基中,28 ℃暗处静置培养20 d,将菌丝体转移到10 mL玻璃小瓶内,密封,注入10%乙炔,振荡培养5 d,用气相色谱仪测定乙烯生成量,用考马斯亮兰法(Bradford,1976)测定各菌体蛋白,计算其固氮酶活性。
1.2.5 生理类群划分根据Lechevalier等(1983;1984)等生理类群划分方法,将经同步预培养的供试菌株接种于6种不同培养基:1) NAZS基础培养基(Lechevalier et al., 1983),简称S;2) S+1%葡萄糖,简称10S;3) S+2%葡萄糖,简称20S;4) S+0.2% Tween-80,简称T+S;5) S+0.2% Tween-80+1%葡萄糖,简称T+10S;6) T+ S+0.2% Tween-80+2%葡萄糖,简称T+20S。28 ℃暗处静置培养,每2,4,6,8周观察菌丝体生长状况,测定菌体生物量,根据菌株生长确定其生理类群。
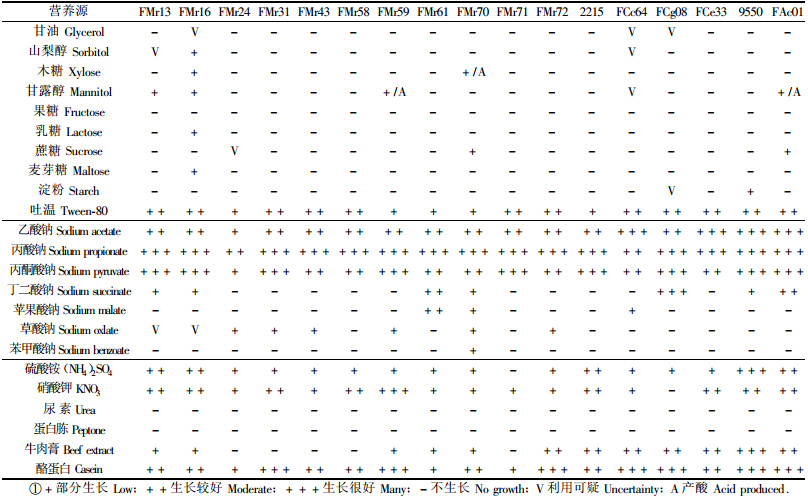
1.2.6 营养源利用1) 碳源:分别以1%的甘油、山梨醇、木糖、甘露醇、葡萄糖、果糖、乳糖、蔗糖、麦芽糖、吐温和0.1%可溶性淀粉代替BAP中的丙酸钠,其他成分不变。将等量菌体接种到上述不同培养基中,28 ℃培养4~6周,观察菌丝体生长,并加入1%溴甲酚紫数滴以检测菌株是否利用碳源产酸。以不含碳源培养基的菌株生长为对照。2)有机酸:分别以0.2%的乙酸钠、丙酮酸钠、丁二酸钠、苹果酸钠、草酸钠、苯甲酸钠等6种有机酸取代BAP中的丙酸钠,以加入丙酸钠和不含碳源的培养基的菌株生长为对照。3)氮源:以1%的硫酸铵、硝酸钾、尿素、蛋白胨、牛肉膏、酪蛋白代替BAP中的氯化铵,其他成分不变,以不含氮源的培养基菌株生长为对照。每处理重复3次。
1.2.7 其他生理特性以无碳源的BAP为基础培养基进行下列生理试验。1)纤维素酶:在基础培养基中加入滤纸条,如果菌体生长,说明菌体能分泌纤维素酶。2)蛋白酶:在基础培养基中加入0.1%酪素,如果菌体生长,说明菌体产生蛋白酶。3)尿素:在基础培养基中加入0.05%丙酸钠和0.1%尿素,培养4周后用酚红作指示剂检测。如果培养液变红为阳性反应,说明菌株能利用尿素。4)硫化氢:在基础培养基中加入0.05%丙酸钠、1%胰蛋白胨和0.05%柠檬酸钠,如果培养后有黑色产物出现,说明菌体能产生硫化氢。5)硝酸还原:在基础培养基中加入0.05%丙酸钠和0.1%KNO3,培养4周后加格里斯试剂测定硝酸盐还原反应。6)苯丙氨酸:在基础培养基中加入0.05%丙酸钠和0.2%苯丙氨酸,菌体培养4周后加入10%FeCl3观察培养液是否变绿色,变色的表明菌体能利用苯丙氨酸产生苯丙酮酸。7)明胶液化:在基础培养基中加入0.05%丙酸钠、20%明胶,培养4周后观察明胶是否液化。每处理重复3次。
1.2.8 宿主特异性供试内生菌培养10周,离心收集菌丝体,匀浆制备成菌液接种剂。用菌液分别浸泡杨梅、细枝木麻黄、短枝木麻黄、粗枝木麻黄、四川桤木和沙枣等无菌幼苗2 h,将苗木移栽至袋装灭菌珍珠岩中,菌体匀浆液均匀浇至根系周围。每个菌株处理11株幼苗,每株接种0.1 mg湿菌体。以冷开水浇育苗木,每3周浇100 mL无氮Sider-young苗木营养液(休伊特,1965),接种6个月后调查苗木结瘤状况。
2 结果与分析 2.1 形态特征供试菌株在液体培养基中均具有分枝状菌丝、孢囊、泡囊等Frankia特征性结构,杨梅不同菌株的形态特征与对照木麻黄和桤木菌株存在差异。
2.1.1 菌丝体供试菌株的菌丝体呈分枝丝状,粗细不均。武夷山杨梅根瘤的内生菌FMr43、福鼎的FMr58和云南的2215等菌丝体直径约为0.33~0.67 μm,波曲不高;来舟的FMr13,FMr16,FMr24,长汀的FMr31和福鼎的FMr59,FMr61,FMr70,FMr71,FMr72等菌丝体较细,直径小于0.35 μm,且分枝多。对照细枝木麻黄内生菌FCc64、粗枝木麻黄内生菌FCg08和短枝木麻黄内生菌FCe33,9550的菌丝体较粗,直径在0.45~1.00 μm之间,四川桤木内生菌FAc01菌丝体直径约为0.33~0.67 μm之间。
2.1.2 孢囊供试菌株在3种培养液中均形成数量不等的孢囊。培养4周时,除对照桤木内生菌FAc01在BAP中孢囊数量较少外,其他菌株在S,BAP和JA液体培养基中均形成大量孢囊,长约2.67~46.50 μm,径0.30~31.30 μm,形状多为球型、草莓型、纺锤型、豆荚型、棒型,也有不规则形状(图 1,2)。培养6周时孢囊成熟,开始发散形成大量圆型或卵型孢子,直径约1.00~1.67 μm。

|
图 1 FMr59的孢囊、孢子、泡囊(箭头所指) Figure 1 Sporangia, spores, vesicle (arrow) of FMr59 |

|
图 2 FMr59的不规则孢囊 Figure 2 Irregularly formed sporangia of FMr59 |
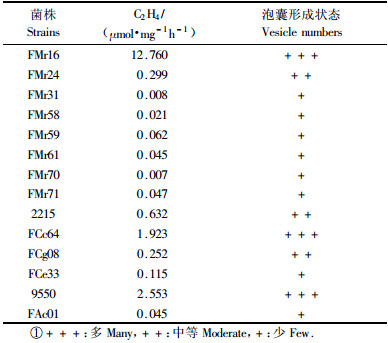
除FMr13,FMr59和FMr61外,其他杨梅菌株在含氮或无氮培养基中均产生泡囊,直径约0.70~2.00 μm,圆形(图 1箭头所示)。对照桤木菌株在含氮的S,JA中形成泡囊,其他菌株仅在无氮诱导培养基中可见泡囊。此外,菌株FMr13,FMr16虽来自同一株杨梅根瘤,但FMr13在含氮S,BAP中不形成泡囊,FMr16则形成大量泡囊,说明同一株植物根瘤共生菌的产泡囊特征有差异。
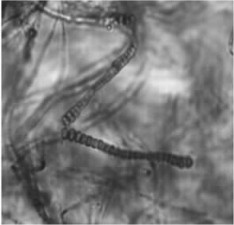
2.1.4 串珠状菌丝在杨梅内生菌FMr16,FMr43和对照木麻黄内生菌FCc64,FCe33的菌丝体中,发现部分菌丝具有长度不等的串珠状菌丝段,类似于链霉菌上的分生孢子链(图 3),有些串珠状菌丝的一端或中间还有膨大的椭圆形结构。Diem(1985)等认为这种串珠状生殖菌丝(reproductive torulose hyphe,简称RTH)有助于Frankia在不利环境下的生存和繁殖。现已报道木麻黄(Diem et al., 1985)、胡颓子(Elaegnus umbellata)(王晨光等,1993)、马桑(Coriaria sinica)等(胡传炯等,1999)的一些Frankia菌株存在串珠状菌丝结构,在杨梅Frankia中尚未见报道。
|
图 3 FCc64的串珠状菌丝 Figure 3 Reproductive torulose hyphe produced by FCc64 |
FMr31, FMr58, FMr59, FMr61, FMr70, FMr71和对照2215等7个杨梅菌株在BAP液体培养基中呈浅红色,在S, JA中为浅白色,FMr13, FMr16, FMr24, FMr43, FMr72以及对照桤木、木麻黄菌株为荔肉白,供试菌株均不分泌可溶性色素。菌落多数生长在试管的底部或附着于试管壁,呈致密颗粒状,FMr16, FMr24呈疏松絮状。菌株在不同培养基中的生长有差异,在BAP, S, JA培养基中生长较好,在Qmod中生长较差。
2.2.2 固体培养杨梅不同菌株在S斜面培养基上的菌落特征差异较大,菌株FMr13,FMr31菌落凸起,细密;FMr16, FMr43, FMr58, FMr59, FMr61, FMr71, FMr72等菌落致密,呈放射状;FMr24菌落松软、无光泽、放射状。对照菌株菌落特征较为一致,凸起、致密、光滑。供试菌株均不产生气生菌丝,不分泌可溶性色素,菌落多呈灰色、灰黄色或乳黄色。
2.3 细胞壁类型7株Frankia的全细胞壁氨基酸含量测定结果见表 2。除菌株FMr16的丙氨酸和甘氨酸的分子比值为1.767外,其他菌株2种氨基酸的比值均在3.067~7.876之间。根据胡传炯等(1997)对Frankia细胞壁类型的划分方法,7个供试菌株的细胞壁类型为Ⅲ型,仅菌株FMr16为Ⅱ型。
|
|
供试菌株在无氮诱导离体培养下均具有乙炔还原活性(表 3),不同菌株的固氮酶活性差异很大,菌株FMr16固氮酶活性最高,达12.760 μmol·mg-1h-1,其次是9550, FCc64和2215,其他菌株固氮酶活性较低。显微镜观察发现,固氮酶活性与泡囊的数量有关,乙炔还原活性越高的菌株,泡囊的数量也越多。
|
|
Lechevalier等(1983;1984)根据Frankia在葡萄糖和Tween-80中的生长状况进行生理类群划分:能较好地利用葡萄糖,加入Tween-80后葡萄糖利用受到抑制的菌株归为生理类群A,添加Tween-80后呈现协同生长特性的菌株划为生理类群B,不论Tween-80存在与否,菌株对葡萄糖的利用不受影响的归为生理类群AB。从表 4看,FMr16菌株在加入Tween-80后生长受到抑制,属生理A类群,相反FMr13, FMr24, FMr31, FMr58, FMr59, FMr61, FMr70, 2215及对照FCc64, FCe33, FCg08, 9550, FAc01菌株在Tween-80加入后生长得到促进,归为生理B类群;菌株FMr71无论吐温存在与否,其生长没有大的变化,呈现出AB类群的特点,说明杨梅根瘤中存在着A, B, AB等不同生理类群的内生菌。从单株杨梅根瘤分离得到的FMr58和FMr71分别为生理B和AB类群,说明同一株植物根瘤中有不同生理代谢类群的内生菌共存,证实Dobritsa等(1989)和Baker等(1994)的观点。
|
|
由表 5可知,不同菌株在碳氮源和有机酸的利用上存在差异。菌株在无碳源培养基中不生长,添加吐温生长良好,对单糖、双糖或多糖利用差,少数菌株如FMr16可少量利用山梨醇、木糖、甘露醇、乳糖和麦芽糖,FMr59和对照FAc01利用甘露醇并产酸,FMr13利用甘露醇不产酸,FMr70少量利用木糖和蔗糖。供试菌株在乙酸钠、丙酸钠和丙酮酸钠等有机酸培养基中生长良好,说明这些菌株能利用短链脂肪酸参与碳代谢,与其他试验结果一致(Benson et al., 1993);部分菌株如FMr61,FCg08,FAc01,FMr70能利用丁二酸钠、苹果酸钠、草酸钠等三羧酸循环的中间产物,说明这些菌株可能含有三羧酸代谢中的一些酶(如苹果酸脱氢酶、琥珀酸脱氢酶、异柠檬酸脱氢酶等),有机酸被吸收后可直接进入三羧酸循环参与菌丝体内的碳代谢。从表 5还可知,供试菌株不利用蛋白胨和尿素,利用酪蛋白较好,部分利用铵态氮和硝态氮。FMr72和对照菌株能较好利用牛肉膏,其他参试杨梅菌株利用较差。
|
|
有关生理代谢试验结果表明:供试菌株不能使明胶液化,不分解纤维素,不产生硫化氢,不利用苯丙氨酸,可水解尿素;FMr16,FMr24,FMr43,FMr58,FMr59,FMr61,FMr70,FMr71,FCg08等9个菌株能分解酪素,说明这些菌株可以分泌一些蛋白酶;FMr16,FMr24,FMr31,FMr59,2215和对照FAc01,9550等7个菌株能还原硝酸盐,表明这些菌株可产生硝酸还原酶。
2.8 宿主特异性以8株杨梅内生菌接种杨梅、木麻黄、沙枣(Elaeagnus angustifolia)、四川桤木等苗木,侵染结瘤结果见表 6。供试8株杨梅内生菌能成功侵染原宿主杨梅结瘤,而且还能侵染四川桤木和沙枣结瘤,但都不能感染细枝木麻黄或短枝木麻黄、粗枝木麻黄,说明供试杨梅Frankia菌株有一定的宿主特异性。
|
|
1) 根据国际上公认的Frankia属的定义,“Frankia内生菌纯培养呈放线菌样,在液体培养中产生不动孢子的孢囊,有可能形成泡囊”(Lechevalier et al., 1989),本研究的12个供试杨梅根瘤内生菌在液体培养基中具有典型的分枝状菌丝、孢囊和泡囊等Frankia特征性结构,与对照菌株一样属于Frankia的成员。菌株FMr16, FMr43和对照菌株FCc64, FCe33还具有串珠状生殖菌丝。与对照木麻黄和四川桤木菌株相比,杨梅菌株的形态培养特征差异较大,多数菌株菌丝体较细小,在含氮源的培养基中能形成泡囊。在斜面培养基上不产生气生菌丝,不分泌可溶性色素,菌落呈灰色、灰黄色或乳黄色。在液体培养基中,菌落为浅红色或荔肉白,多为致密颗粒,在BAP, S, JA培养基中生长较好,在Qmod培养基中生长较差,这与Lalonde等(1981)研究认为Qmod是Frankia生长的适宜培养基结果相异,其原因有待进一步探讨。菌株细胞壁类型多为Ⅲ型。
2) 根据Lechevalier等(1983; 1984)建立的Frankia生理类群划分方法,将供试杨梅菌株分为A、B、AB等3种生理类群,其中主要为B类群,与国际上报道的菌株多为生理A类群的结果有差异(Lechevalier et al., 1983;Benson et al., 1993),据此推测杨梅共生Frankia类群可能与地域有关。同一株植物根瘤内有不同生理类群的内生菌共存,如从单株杨梅根瘤分离的内生菌FMr58和FMr71分别属生理B和AB类群。
3) 杨梅不同菌株在碳氮源和有机酸的利用上存在差异。所有菌株在无碳源的培养基中均不生长,利用糖类少,利用吐温良好,少数菌株可少量利用甘油、山梨醇、甘露醇、木糖、乳糖和麦芽糖。菌株能很好地利用乙酸钠、丙酸钠和丙酮酸钠等有机酸,部分菌株还能利用丁二酸钠、苹果酸钠、草酸钠等三羧酸循环的中间产物。菌株对氮源的利用差异较大,能良好利用酪蛋白水解物,部分利用硝态氮、铵态氮或牛肉膏,不利用蛋白胨和尿素。此外,供试菌株均不使明胶液化,不分解纤维素,不产生硫化氢,不利用苯丙氨酸,可水解尿素,少数菌株能分解酪素或还原硝酸盐。
4) 泡囊是Frankia的鉴别性结构,通常在无氮源、或含一些无法降解为氨的氮源培养基中产生(Benson et al., 1993),但研究发现一些木麻黄(Gauthier et al., 1981)和香蕨木(Meesters et al., 1985)Frankia菌株在NH4+的存在下也能形成泡囊。显微观察发现,杨梅不同Frankia菌株在无氮离体培养条件下有数量不等的泡囊形成,经测定菌丝体固氮酶活性与泡囊的形成数量呈正相关,且不同菌株的固氮酶活性差异大。此外,多数杨梅供试菌株和对照桤木菌株在含NH4+和酪蛋白水解物的S、JA和BAP培养基中也形成泡囊,这些泡囊是否存在固氮酶,能否起固氮作用,有待进一步研究。
5) 相对于根瘤菌的宿主专一性,Frankia具有跨越科、属界限侵染植物结瘤的能力(Baker,1987;Torrey,1990)。本研究中供试杨梅内生菌都能侵染原宿主杨梅结瘤,部分能侵染沙枣和四川桤木,但不能感染细枝木麻黄、粗枝木麻黄或短枝木麻黄,说明杨梅Frankia菌株有明显的宿主特异性,这为Frankia的选择和接种应用提供基础。
范小明. 2003. 杨梅根瘤内生菌的回接侵染特性. 江西农业大学学报, 25(5): 738-741. DOI:10.3969/j.issn.1000-2286.2003.05.021 |
何新华, 陈力耕, 柴春燕, 等. 2003. 杨梅根瘤Frankia菌的分离和培养特性研究. 浙江大学学报:农业与生命科学版, 29(6): 609-613. |
胡传炯, 周平贞, 周启. 1997. 一株马桑根瘤内生菌纯培养物的分类鉴定. 微生物学报, 37(6): 417-422. |
胡传炯, 周平贞, 周启, 等. 1999. 马桑根瘤内生菌纯培养物的分离、回接及其生物学特性. 华中农业大学学报, 32(2): 481-486. |
梁蓉芳, 袁德军. 1990. 放线菌细胞壁化学组分分析方法的研究. 微生物学通报, 17(4): 247-249. |
王晨光, 宋尚直, 阮继生. 1993. 弗兰克氏菌生物学特性的研究. 微生物学报, 33(4): 297-303. |
熊智, 张忠泽, 姜成林. 2003. 固氮放线菌Frankia与放线菌根植物共生进化的研究进展. 应用与环境生物学报, 9(2): 213-217. DOI:10.3321/j.issn:1006-687X.2003.02.025 |
休伊特E J. 1965.植物营养研究的砂培和水培法.崔微, 译.北京: 科学出版社, 91-98.
|
曾定. 1987. 固氮生物学. 厦门: 厦门大学出版社, 182-212.
|
Akkermans A D L, Roelofsen W, Blom J, et al. 1983. Utilization of carbon and nitrogn compounds by Frankia in synthetic media and in root nodules of Alnus glutinosa, Hippophae rhamnoides, and Datisca cannabina. Can J Bot, 61: 2793-2800. DOI:10.1139/b83-309 |
Baker D D. 1987. Relationships among pure cultured strains of Frankia based on host specificity. Physiol Plant, 70: 245-248. DOI:10.1111/ppl.1987.70.issue-2 |
Baker D D, Mullin B C. 1994. Diversity of Frankia nodule endophytes of the actinorhizal shrub Ceanothus as assessed by RFLP patterns from single nodule lobes. Soil Biol Biochem, 26: 547-552. DOI:10.1016/0038-0717(94)90241-0 |
Benson D R, Silvester W B. 1993. Biology of Frankia strains actinomycete symbionts of actinorhizal plants. Microbiol Rev, 57: 293-319. |
Bradford M M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein principle of protein dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Diem H G, Dommergues Y R. 1985. In vitro production of specialized reproducrive torulose hyphae by Frankia strain ORS021001 isolated from Casuarina junghuhniana root nodules. Plant and Soil, 187: 1-29. |
Dobritsa S V, Stupar O S. 1989. Genetic heterogeneity among Frankia isolates from root nodules of individual actinorhizal plants. FEMS Microbiol Lett, 58: 287-292. DOI:10.1111/fml.1989.58.issue-2-3 |
Gauthier D, Diem H G, Dommergues Y R. 1981. In vitro nitrogen fixation by two actinomycete stains isolated from Casuarina nodules. Appl Enviro Microbiol, 41: 306-308. |
Huguet V, Batzli J M, Zimpfer J F, et al. 2001. Diversity and specificity of Frankia strains in nodules of sympatric Myrica gale, Alnus incana, and Shepherdia canadensis determined by rrs gene polymorphism. Appl Environ Microbiol, 67(5): 2116-2122. DOI:10.1128/AEM.67.5.2116-2122.2001 |
Lalonde M, Calvert H E, Pine S. 1981. Isolation and use of Frankia strains in actinorhizae formation//Gibson A H, Newton W E. Current perspectives in nitrogen fixation. Austratian Academy of Sciences, 296-299.
|
Lechevalier M P, Baker D, Horriere F. 1983. Physiology, chemistry, serology, and infectivity of two Frankia isolates from Alnus incana subsp. rugosa. Can J Bot, 61: 2826-2833. DOI:10.1139/b83-314 |
Lechevalier M P, Ruan J S. 1984. Physiology and chemical diversity of Frankia spp isolated from nodules of Comptonia peregrina (L) Coult. and Ceanothus americanus L. Plant and Soil, 78: 15-22. DOI:10.1007/BF02277836 |
Lechevalier M P, Lechevalier H A. 1989. Genus Frankia brunchorst 1886, 174AL// Williams S T, Sharpe M E, Holt J G. Beygey's manual of systematic bacteriology. The Williams Wilkins Co, Baltimore, 4: 2410-2417.
|
Meesters T M, van Genesen S T, Akkermans A D L. 1985. Growth, acetylene reductin activity and localization of nitrogenase in relation to vesicle formation in Frankia strains Cc1.17 and Cp1.2. Arch Microbiol, 143: 137-142. DOI:10.1007/BF00411036 |
Murry M A, Lopez M F. 1989. Interaction between hydrogenase, nitrogenase and respiratory activities in a Frankia isolate from Alnus rubra. Can J Microbiol, 35: 636-641. DOI:10.1139/m89-102 |
Torrey J G. 1990. Cross-inoculation groups within Frankia and host-endosymbiont associations//Schwintzer C R, Tjepkema J D. The Biology of Frankia and Actinorhizal Plants. Academic Press Inc, San Diego, 83-60.
|
 2009, Vol. 45
2009, Vol. 45