文章信息
- 程云清, 刘剑锋, 陈智文.
- Cheng Yunqing, Liu Jianfeng, Chen Zhiwen
- 平榛组织培养与快速繁殖
- Tissue Culture and Rapid Propagation of Corylus heterophylla
- 林业科学, 2008, 44(12): 57-61.
- Scientia Silvae Sinicae, 2008, 44(12): 57-61.
-
文章历史
- 收稿日期:2008-01-16
-
作者相关文章
平榛(Corylus heterophylla)属桦木科(Betulaceae)榛属。榛属在世界上约有20余种,我国原产7个种。平榛是榛属中分布最广、资源最丰富、产量最多的一种。目前市场出售和出口的商品榛子主要来自平榛。平榛是我国重要的坚果树种之一,也是我国珍贵的乡土经济林树种,综合利用价值极高,十分适合在东北广大林间空地栽培。但近年来其产品质量及数量均有不同程度的下降,难以满足国内外市场的需求。在平榛苗木的生产方面,目前主要以榛果实播种与分株压条繁殖(杨青珍等,2006;宋锋惠等,2004)为主,但通过播种生产的实生苗难以保持母株的优良结果习性,分株压条繁殖速度很慢,这导致苗木市场售价达到每株10~15元,每公顷苗木投入需15 000~22 500元,苗木的高成本已成为制约吉林省榛子产业的瓶颈问题,但平榛的组织培养和快速繁殖至今未见报道。因此,建立平榛的组织培养与快繁体系对于降低平榛苗木成本,促进平榛产业的发展具有十分重要的现实意义。鉴于此,本研究以吉林省四平市野生平榛优良植株为试材,建立其离体培养体系,并采取措施扩大繁殖系数,为平榛试管苗的工厂化生产提供理论依据。
1 材料和方法 1.1 试验材料2007年3月上旬取四平市叶赫满族镇(124°27′E,43°2′N)优良1年生平榛枝条为材料。此时芽体尚未萌动,取30余枝,每个枝条带腋芽10余个,长35~45 cm,湿毛巾包裹带回实验室。平榛枝条的催芽按Nas(2004)的方法进行。2~3周时,多数腋芽萌发,取产生3片以上新叶的嫩梢作为组织培养的外植体。
1.2 方法 1.2.1 材料表面消毒处理平榛叶片与茎段有大量绒毛,因此表面消毒除菌不易(Diaz et al., 1990)。在去掉新生嫩梢的叶片和叶托后,流水冲洗1 h,嫩梢用体积分数为70%的乙醇浸泡30 s进行表面消毒,然后用灭菌去离子水冲洗4~5次,浸泡于体积分数为12%的漂白液中,每升漂白液加Tween-20 10滴,浸泡15 min,用灭菌去离子水冲洗4~5次。用含1~2个腋芽茎段作为接种外植体。
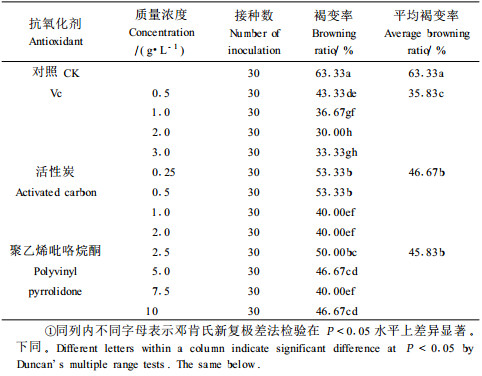
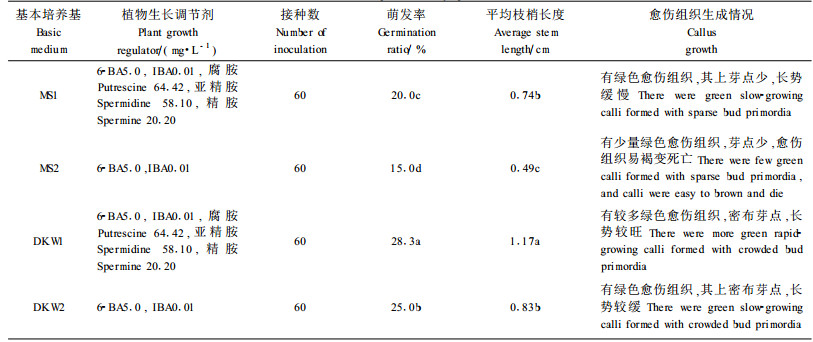
1.2.2 抗氧化处理与初代培养基筛选抗氧化处理:以DKW+5 mg·L-1 6-BA+0.01 mg·L-1IBA为基本培养基,并添加以下抗氧化剂:1)维生素C(VC)0.5、1.0、3.0 g·L-1;2)活性炭(AC)0.25、0.5、1.0 mg·L-1;3)聚乙烯吡咯烷酮(PVP)2.5、5.0、10.0 g·L-1。接种后48 h内置黑暗培养,此后转入光照培养,在接种后1周统计褐变率。褐变率(%)=褐变数/接种数×100。初代培养基的筛选:DKW1:DKW+5 mg·L-1 6-BA+0.01 mg·L-1 IBA,并附加64.42 mg·L-1腐胺、58.10 mg·L-1亚精胺和20.20 mg·L-1精胺;DKW2:DKW1中不含多胺;MS1:MS+5 mg·L-1 6-BA+0.01 mg·L-1 IBA,并附加64.42 mg·L-1腐胺,58.10 mg·L-1亚精胺和20.20 mg·L-1精胺;MS2:MS1中不含多胺。此外,每种初代培养基中加入Vc 2.0 g·L-1。
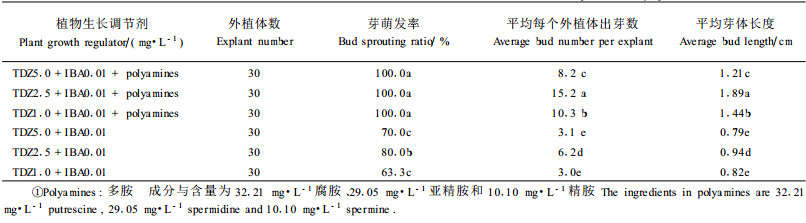
1.2.3 增殖培养基将初代培养过程中产生的愈伤组织转入芽增殖培养基中,每块愈伤组织质量约0.2 g。增殖培养基1:DKW+0.01 mg·L-1 IBA+(1,2.5,5 mg·L-1)TDZ,附加32.21 mg·L-1腐胺、29.05 mg·L-1亚精胺和10.10 mg·L-1精胺;增殖培养基2:DKW+0.01 mg·L-1 IBA+(1,2.5,5 mg·L-1)TDZ。1个月后统计芽萌发与生长情况。
1.2.4 生根培养与移栽将平榛试管苗切成带1~2个节位的小段,分别接种于附加IBA0.1、0.5、1.0、2.0 mg·L-1的1/2 MS培养基上。试管苗生根后,将生根苗的瓶盖打开,于25 ℃、散射光下炼苗3~4 d,取出小苗后,洗净根部培养基,将生根的试管苗移植于蛭石:草炭(1:1)基质中,并加盖透光塑料杯,1周后去杯并移栽至大田。
1.2.5 培养条件以上培养基pH值均为5.8,琼脂粉(济南普朗特公司生产)5.0 g·L-1,葡萄糖30 g·L-1,在1.4 kg·cm-2压力下灭菌20 min。如果培养基中加入多胺或Vc,则经过滤除菌后在无菌条件下加入到灭菌后温热的培养基中。材料接种后置于培养温度25 ℃、光照强度为3 000 lx、光周期为16 h(光照)/8 h(黑暗)的GXZ-160型智能光照培养箱(北京北方科仪)中培养。
1.2.6 统计分析应用SAS8.2统计软件中ANOVA模块进行邓肯氏新复极差显著性分析。如结果为百分率数据,经过反正弦转化后进行统计分析。
2 结果与分析 2.1 不同抗氧化剂抑制平榛褐变的效果平榛在初代培养过程中,材料褐变率很高,不加任何抗氧化剂的对照,褐变率达到60%以上(表 1)。当培养基中加入Vc、活性炭和聚乙烯吡咯烷酮等抗氧化剂后,褐变率明显下降,其中,活性炭与聚乙烯吡咯烷酮抗褐变效果较为接近,平均褐变率在45%左右,这2种抗氧化剂浓度分别以1 g·L-1和7.5 g·L-1为最佳,此时褐变率均为40%。Vc抗褐变效果明显好于活性炭与聚乙烯吡咯烷酮处理,平均褐变率为35.83%,其最佳处理浓度为2.0 mg·L-1,此时褐变率为30%,明显低于活性炭与聚乙烯吡咯烷酮处理的最低褐变率。综上所述,平榛初代培养过程中材料的褐变非常严重,Vc、活性炭和聚乙烯吡咯烷酮处理都能降低褐变率,但以2.0 g·L-1Vc处理抗氧化效果为最佳。
|
|
平榛茎段在不同培养基初代培养的差异如表 2所示。平榛带芽茎段在MS与DKW培养基中均可萌发,但萌发率均较低,在30%以下,其中,平榛在DKW培养基上的萌发率要明显高于MS培养基。同一种基本培养基处理,多胺的有无对茎段芽体的萌发有重要的影响,总的说来,附加多胺的处理芽体萌发率较高,芽体生长相对迅速。值得注意的是,在6周时,正常萌芽的茎段70%的试管苗切口处尤其是叶柄基部的切口处常可长出愈伤组织。图 1-1为茎段产生的愈伤组织经继代培养后的生长情况。其中,培养基中加多胺的处理其愈伤组织有较多的芽点。综上,选用DKW+5 mg·L-1 6-BA+0.01 mg·L-1 IBA,并附加64.42 mg·L-1腐胺、58.10 mg·L-1亚精胺和20.20 mg·L-1精胺对于促进平榛茎段上芽体的生长以及愈伤组织的生长、芽分化均具有重要的促进作用,而外植体茎段上产生的密布芽点的愈伤组织为平榛的快速繁殖提供了良好的材料。
|
|

|
图 1 平榛愈伤组织的分化过程 Figure 1 Differentiation process of Corylus heterophylla calli 1.茎段产生的愈伤组织经继代培养后的生长情况;2.愈伤组织芽点萌发情况;3.多胺可促进芽体快速生长;4.平榛试管苗形成。 1.Growth after subculture of calli induced from stem segment; 2.Bud germination from calli; 3.Polyamine promoting bud growth; 4.Corylus heterophylla plantlets formed. |
以上述最佳的愈伤组织诱导培养基对存活愈伤组织进行1次继代培养后,愈伤组织生长较旺盛。此时将愈伤组织转移到不同的芽分化培养基上进行培养,结果表明在不同的芽分化培养基上愈伤组织上面芽点的萌发率差异较大,而且每个外植体出芽数与芽体的生长速度均存在很大的差异(表 3)。芽分化培养基中加多胺的处理,芽点的萌发率很高,均达到100%(图 1-2),没加多胺的处理芽点萌发率在60%~80%不等。从平均每个外植体出芽数和平均芽体长度来看,培养基中加多胺的处理均显著高于不加多胺的处理(P<0.05),其中,在培养基为DKW+2.5 mg·L-1 TDZ+0.01 mg·L-1 IBA,并附加32.21 mg·L-1腐胺、29.05 mg·L-1亚精胺和10.10 mg·L-1精胺时,芽体生长速率最快,因此用其作为平榛诱芽培养基较为适宜。
|
|
将生长健壮、高约2.0 cm左右的芽切下(图 1-3),接种于1/2MS培养基(表 3)上培养,转接后60 d左右可形成完整小植株(图 1-4)。转接10 d左右开始生根,到转接后的第60天,对生根率等数据进行统计(表 4)。结果表明:生长素能促进平榛试管苗生根,但生长素种类及其浓度的差异明显,生根效果IBA好于NAA,二者均以0.25 mg·L-1的生根率最高,浓度过高易产生畸形根;从每苗平均根数、平均根长与平均苗高来看,两者均以0.25 mg·L-1处理的效果最佳。因此,生根较为理想的培养基为1/2MS + IBA 0.25 mg·L-1。
|
|
移栽前将生根苗的瓶盖打开,于25 ℃、散射光下炼苗3~4 d,然后用镊子取出小苗后,洗净根部培养基,将生根的试管苗移植于蛭石:草炭(1:1)基质中,并加盖透光塑料杯,1周后去杯并移栽至大田,成活率在90%以上。
3 讨论榛属植物组织中酚类物质含量较高,易出现外植体或培养物的褐化、枯死现象,这种褐化现象又称为酚污染,会对外植体的脱分化和营养物质的再分化产生严重的影响(Ozdemir et al., 2004;Yu et al., 1995; Rodrigue et al., 1988),甚至对其初代培养能否成功起决定作用。榛属植物在茎段培养中,外植体一般在接种24 h后就开始出现褐变,最后导致外植体死亡,因此难以建立无性繁殖体系(Nas et al., 2004a;2004b)。褐化在许多木本植物组织培养中也较为常见(蒋林等,2004),然而关于榛属植物的抗褐化研究少有报道。Vc是一种抗氧化剂,它能与空气中的氧生成脱氢抗坏血酸,从而减轻O2与氧化物质的结合,达到抗褐化的目的。从本研究的结果来看,Vc、活性炭和聚乙烯吡咯烷酮处理都能降低褐变率,但以2.0 g·L-1Vc处理抗氧化效果最佳。建议在榛属植物的组织培养过程中,初代培养加入Vc以降低褐化的比率,提高材料的成活率。
以DKW为基本培养基时,多采用6-BA和IBA的激素组合。近年来,有研究表明6-BA对榛属植物诱芽作用似乎并不明显,而新型高活性植物生长调节剂TDZ在榛属植物的组织培养过程中被陆续采用(刘家宁等,2006a;2006b)。此外,组培苗的生长速度也是限制榛属植物组培体系成功的巨大障碍,有研究表明,多胺具有促进芽体伸长与芽体增殖的作用(Nas,2004)。从本研究的结果来看,初代培养基中采用6-BA和IBA的组合,外植体可产生愈伤组织,偶尔还可在切口处直接成芽,这表明6-BA在初代培养过程中促进组织的分化是有效的。在增殖培养基中采用TDZ替代6-BA,此外附加一定量的多胺,结果表明芽点的萌发、芽体的生长情况较好。考虑到TDZ目前在国内每克的价格是6-BA的100倍以及初代培养过程中常出现较高的污染率,在初代培养过程中采用6-BA,而在增殖培养基中采用TDZ似乎是一个比较明智的选择。多胺对芽体的增殖与生长都十分有利,虽然它需经过滤除菌才能加入培养基,增加了培养基制作的复杂性,建议在初代培养与增殖培养中使用。
蒋林, 黄清春, 张晚风, 等. 2004. 五指毛桃组织培养研究. 中药材, 27(8): 547-549. DOI:10.3321/j.issn:1001-4454.2004.08.001 |
刘家宁, 秦岭, 高遐虹. 2006a. 榛属植物组织培养研究进展. 北京农学院学报, 21(1): 62-66. |
刘家宁, 高遐虹, 秦岭. 2006b. 平欧杂交榛的组织培养. 果树学报, 23(3): 471-474. |
宋锋惠, 史彦江, 卡德尔. 2004. 杂交榛子压条苗繁殖技术研究. 经济林研究, 22(4): 56-58. DOI:10.3969/j.issn.1003-8981.2004.04.016 |
杨青珍, 王锋, 季兰. 2006. 榛子的繁殖技术. 山西果树, 17(3): 14-16. DOI:10.3969/j.issn.1005-345X.2006.03.008 |
Diaz S C, Rey M, Rodriguez R. 1990. In vitro establishment of cycolclonal chain from nodal segments and apical buds of adult hazel (Corylus avellana L). Plant Cell, Tissue and Organ Culture, 23: 151-157. |
Nas M N. 2004. Inclusion of polyamines in the medium improves shoot elongation in hazelnut (Corylus avellana L.) micropropagation. Turkish Journal of Agriculture and Forestry, 28(3): 189-194. |
Nas M N, Mutlu N, Read P E. 2004a. Random amplified polymorphic DNA (RAPD) analysis of long-term cultured hybrid hazelnut. Hortscience, 39: 1079-1082. |
Nas M N, Read P E. 2004b. A hypothesis for the development of a defined tissue culture medium of higher plants and micropropagation of hazelnuts. Scientia Horticulturae, 101: 189-200. |
Ozdemir F, Akinei I. 2004. Physical and nutritional properties of four major commercial Turkish hazelnut varieties. Journal of Food Engineering, 63: 341-347. DOI:10.1016/j.jfoodeng.2003.08.006 |
Rodrigue R C, Diaz-Sala C, Anncora G. 1988. Sequential cultures of explants taken from adult corylus avellana L. Acta Horticulturae, 227: 460-463. |
Yu X I, Reed B M. 1995. A micropagation system for hazelnut (Corylus species). Hortscience, 30: 120-123. |
 2008, Vol. 44
2008, Vol. 44