文章信息
- 胡孝义, 谭晓风, 田晓明, 刘巧, 罗茜, 陈鸿鹏, 胡芳名.
- Hu Xiaoyi, Tan Xiaofeng, Tian Xiaoming, Liu Qiao, Luo Qian, Chen Hongpeng, Hu Fangming
- 油茶种子水通道蛋白CoPIP1-1的鉴定与分析
- Identification and Analysis of an Aquaporin(CoPIP1-1) in the Seeds of Camellia oleifera
- 林业科学, 2008, 44(12): 48-56.
- Scientia Silvae Sinicae, 2008, 44(12): 48-56.
-
文章历史
- 收稿日期:2007-12-24
-
作者相关文章
细胞间的水分转运需要跨越质膜和液泡膜,而水通道蛋白(aquaporin, AQP)形成跨脂双层的水扩散特异孔道,有利于这种跨膜的水分运动,也有利于渗透作用的调节(Kjelbom et al., 1999)。植物AQP广泛调控着从根到叶的随蒸腾流的水分运输,也调节其他一些生理过程,如,韧皮部吸收物的转运、叶片气孔的开启与关闭、叶片运动、胞质的动态平衡。此外,部分动物和植物水通道蛋白可以介导甘油运输,植物AQP按序列同源性和亚细胞定位可分为4个主要的亚族(Luu et al., 2005):1)质膜内在蛋白(plasma membrane intrinsic protein,PIP),分布于细胞质膜上;2)液泡膜内在蛋白(tonoplast membrane intrinsic protein, TIP),主要分布于液泡膜上;3)结瘤蛋白样主要内在蛋白(nodulin 26 like major intrinsic protein, NIP),如根瘤蛋白(nodulin)分布于豆科根瘤的共生膜上及内质网上;4)在玉米(Zea mays)中发现的小分子碱性内在蛋白(small basic intrinsic protein, SIP),定位于内质网与质膜上,该类AQP大部分成员如SIP1;1、SIP1;2有水转运活性(Maeshima et al., 2007)。植物根系细胞的PIP在控制自由水的吸收方面发挥关键的作用,而TIP则在胞质中缓冲渗透波动(Maurel et al., 2002)。有证据显示PIP在转录水平上受到脱水胁迫的调节(Mariaux et al., 1998)。目前认为,在干旱胁迫下,在大多数细胞和组织中,AQP丰度或水转运活性的提高是有害的(Aharon et al., 2003),细胞和组织的合理水分状态的维持既需某些AQP的水通道活性的提高,也需要在另一些细胞和组织中AQP水分转运活性的下降(Comparot et al., 2000; Jang et al., 2007)。
油茶(Camellia oleifera)种子在成熟过程中水分含量急剧下降,处于脱水状态,而通常情况下,植物的脱水胁迫会诱导活性氧分子(reactive oxygen species, ROS)的迸发。从油茶近成熟种子cDNA文库中发现超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)为中高丰度表达(谭晓风等, 2006),还发现有产生活性氧的NADPH氧化酶,以及谷胱甘肽硫转移酶(GST)、脂氢过氧化物裂解酶(HPL)、脱水素等多种保护蛋白与解毒蛋白,暗示近成熟的油茶种子中有较多ROS的积累。为探讨油茶种子内脱水胁迫(或氧化胁迫)与油脂合成的关系,以揭示油茶油脂生物合成的影响因素,有必要研究油茶种子脱水胁迫的成因。在油茶cDNA文库中还发现了26条TIP及1条PIP的EST序列,在完成这个PIP的cDNA序列的全长克隆后,通过三维同源建模等生物信息学手段分析了其定位与活性调控机制,发现它是一个组成型低活性的PIP类水通道蛋白,抑制胞外水分的进入,因此推测油茶种子细胞的质膜水通道蛋白的表达低丰度及组成型低活性是油茶种子近成熟期脱水的成因之一。
1 材料与方法 1.1 材料中南林业科技大学经济林育种与栽培国家林业局重点实验室构建的油茶近成熟种子cDNA文库,所有单克隆保存于-80 ℃冰箱中;提取RNA的植物材料为油茶优良无性系湘林1号和湘林4号的近成熟种子,采自于湖南省林业科学研究院油茶采穗圃。
1.2 方法 1.2.1 质粒DNA提取SDS碱裂解法的小量制备(Sambrook et al., 2002)。
1.2.2 质粒中目的片段大小的PCR检测PCR反应体系(20 μL):Taq(5 U·μL-1)0.2 μL,10×PCR buffer2.0 μL,MgCl2(25 mmol·L-1)1.2 μL,dNTPs(10 mmol·L-1)0.4 μL,T3(5′-ATTAACCCTCACTAAAGGGA-3′)、T7(5′-TAATACGACTCACTATAGGG-3′)引物各0.8 μL,质粒模板0.2 μL,ddH2O 14.4 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃继续延伸5 min;4 ℃保存。取2 μL扩增产物于1.0%琼脂糖凝胶上电泳检测。
1.2.3 双向测序T3、T7双向测序,采用VectorNTI (AdvanceTM 9)软件进行校正和拼接从而得到该克隆的全部DNA序列信息;利用NCBI网页上的Blast程序对该序列进行同源性分析。
1.2.4 总RNA提取采用Invitrogen公司的RNA提取试剂盒:PureLinkTM Micro-to-Midi Total RNA Purification System (Catalog No. 12183-018),按照说明指南进行。
1.2.5 RT-PCR与5′-RACE采用Clontech公司的SMARTTM RACE cDNA Amplification试剂盒(Cat.No.634914),按其使用说明合成cDNA第一链。利用primer premier 5软件设计基因特异的5′-RACE引物GSP与NGSP。
反向引物GSP:5′-AGTAGCAGCCCAAATGTCACCGCC-3′ (24 bp,10 μmol·L-1);
反向巢式引物NGSP:5′-ATGTCCCCCTGAGATGCCAGCGGT-3′ (24 bp,10 μmol·L-1)。
GSP与NGSP反向引物分别与EST序列的138~161 bp、106~129 bp互补。
5′-RACE PCR反应体系(50 μL)及降落PCR(退火温度依次为72 ℃、70 ℃、68 ℃)的扩增程序参照试剂盒的说明进行设置,但电泳检测结果无任何条带;保存RACE的反应产物,增加10次68 ℃退火的热循环,再次电泳检测,有弱的条带和拖带;接着用巢式PCR特异扩增该目的条带,其反应体系(50 μL)为:LA Taq(5 U·μL-1)0.6 μL,10×LA PCR bufferⅡ5.0 μL,MgCl2(25 mmol·L-1)5 μL,dNTPs(10 mmol·L-1)1 μL,NUP(10 μmol·L-1)、NGSP(10 μmol·L-1)引物各1 μL,RACE产物模板1 μL,ddH2O 34.9 μL。热循环程序(降落PCR):94 ℃ 5 min;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 90 s,5个循环;94 ℃ 30 s,66 ℃ 30 s,72 ℃ 90 s,5个循环;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,25个循环;72 ℃ 5 min;4 ℃保存。
1.2.6 目的条带的回收、连接与转化用安比奥公司(长沙)的DNA回收试剂盒和TaKaRa公司的pMD18-T载体连接试剂盒,按照各自的说明进行DNA目的片段的回收及与含有氨苄青霉素抗性基因的pMD18-T载体的连接,转化DH5α大肠杆菌,在含有IPTG(400 μg·mL-1)及X-gal(160 μg·mL-1)的固体LB平板上进行蓝白斑筛选,挑取白色的单菌落培养,抽提重组质粒进行PCR检测,反应体系(20 μL)为:rTaq(2.5 U·μL-1)0.2 μL,10×PCR buffer 2.0 μL,MgCl2(25 mmol·L-1)1.2 μL,dNTPs (10 mmol·L-1)0.3 μL,NUP、NGSP引物各0.5 μL,重组质粒模板0.3 μL,ddH2O 14.4 μL。循环参数与上述巢式PCR相同。挑选阳性克隆送北京博尚生物科技公司测序。
1.2.7 交错延伸PCR获得完整的目的基因全长cDNA首先以2对引物(AQPFo与NGSP,AQPFi与AQPRo)分别扩增含有起始密码子和终止密码子的2个交错模板(图 3),且在引物设计时引入酶切位点,以便插入到原核表达载体pET-30 a上。

|
图 3 油茶水通道蛋白的基因序列 Figure 3 The complete DNA sequence of the gene(CoAQP) for C. oleifera aquaporin 深色:起始密码子(ATG)与终止密码子(TGA);下划线:5′-UTR与3′-UTR;方框:终止信号(AATAA);着重号:另一个CoAQP的5′-UTR内多出的2个片段;灰色:5′-RACE获得的序列与原EST序列的重叠部分,以引物AQPFo及NGSP扩增CDS的前半部分,以引物AQPFi及AQPRo扩增CDS的后半部分,然后再以灰色部分的片段为交错模板通过交错延伸PCR将2部分连起来。 Fuscous:Initiation codon(ATG) and Stop condon(TGA). Underline:5′-UTR and 3′-UTR. Pane:Stop signal(AATAA). Emphatic dot: The two more segments of another CoAQP. Grayish:The overlapping segment between the original EST sequence and the sequence obtained through 5′-RACE; Two couples of primer, AQPFo and NGSP, AQPFi and AQPRo, were used to amplify the forward and subsequent segment of the CDS for CoAQP, respectively, before the two segment of the CDS were linked by using the grayish segment as overlapping template via the overlapping extension PCR. |
正向引物AQPFo:5′-CGGCATATGGAAGGGAAAGAAGAA-3′,相应的反向引物为NGSP,序列见1.2.5;
正向引物AQPFi:5′-TTGACGGTGATGGGGGTTGTTAG-3′(与两模板重叠区序列的5′互补);
反向引物AQPRo:5′-CGGGAATTCTCATCACTTGGACTT-3′ (TCA与终止密码子TGA反向互补)。
上述涂灰的部分分别为NdeⅠ及EcoRⅠ的识别序列,CGG为保护碱基,采用高保真pfu酶,反应体系(50 μL)为:pfu (2.5 U·μL-1)1.0 μL,10×pfu PCR buffer 5.0 μL,dNTPs (10 mmol·L-1)1 μL,引物(AQPFo、NGSP或AQPFi、AQPRo)各1.2 μL,文库质粒模板0.8 μL,ddH2O 39.8 μL。热循环程序采用降落PCR:94 ℃ 5 min;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 90 s,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 90 s,5个循环;94 ℃ 30 s,66 ℃ 30 s,72 ℃ 90 s,5个循环;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 5 min;4 ℃保存。电泳检测目的条带,然后使用安比奥公司(长沙)的DNA回收试剂盒切胶回收。
交错延伸PCR的反应体系(54 μL):ddH2O 25.6 μL,10×pfu PCR buffer 6.0 μL,2个交错模板各10.0 μL,dNTPs(10mmol·5L-1)1.2 μL,pfu (2.5 U·μL-1)1.2 μL。热循环程序:94 ℃ 5 min;94 ℃ 45 s,56 ℃ 60 s,72 ℃ 70 s,5个循环;72 ℃5 min;4 ℃保存。热循环完毕后立即加入AQPFo(10 μmol·L-1)、AQPRo(10 μmol·L-1)各3.0 μL,继续进行热循环,程序为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 90 s,35个循环;72 ℃ 5 min;4 ℃保存。取3 μL进行电泳检测。
1.2.8 生物信息学分析与水通道活性的预测利用NCBI(http://www.ncbi.nlm.nih.gov/)的Blast在线软件进行同源性分析,采用Vector NTI(AdvanceTM 9)软件进行比对和保守基序的识别,蛋白质理化性质的预测及同源建模则是利用http://www.expasy.org/tools网页上提示的相关网站的在线软件进行。
2 结果与分析 2.1 目的EST序列长度的PCR检测及双向测序结果油茶cDNA文库中6186号克隆的EST序列经NCBI的vecscreen分析后去除载体序列,其长度远小于电泳检测到的1 000~1 500 bp(图略),进行双向测序后发现,该克隆的目的序列长1 052 bp,其中含有70个寡聚A。NCBI的blastx程序得到的序列的基因注释全部为水通道蛋白(AQP),其中,即使最低的Score值也高达465,相应的E值为2e-129,相似性较高,为83%(氨基酸),因此该克隆可能代表一个AQP基因,为叙述方便,暂命名为CoAQP;结合水通道蛋白的一般性结构特点分析其开放阅读框(open reading frame, ORF),发现该克隆代表的基因序列缺少N端部分编码序列和5′-UTR。
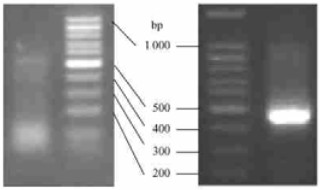
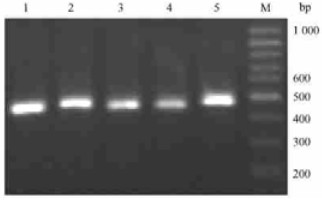
2.2 5′-RACE产物、巢式PCR产物及重组质粒的PCR检测RACE产物的电泳检测发现在约500 bp以下有轻微的拖带,暗示其中可能有目的条带(图 1左)。继续以RACE产物为模板进行巢式PCR,其产物的电泳检测清晰表明,确实存在一略小于500 bp的明亮条带(图 1右)。将该条带纯化后,进行TA克隆,挑取5个白色的单菌落培养,其重组质粒的PCR检测结果(图 2)显示:5个条带大小都与图 1(右)的条带吻合,其中2、3、4号条带一致,但1号略小,5号略大。选送1、3、5号的菌液测序。
|
图 1 5′-RACE产物(左)及巢式PCR产物(右)的电泳检测 Figure 1 The elctrophoresis testing of products from 5′-RACE(left) and nested PCR(right) |
|
图 2 重组质粒阳性克隆的PCR检测 Figure 2 The verifying of positive recombinant clones by PCR |
对已测序的这3个重组子的目的序列进行比对发现,1、3号重组子的目的条带序列完全一致,而5号重组子目的序列内相对于前者多了2个小片段,一个是简单重复序列内的4个GA,另一个是位于更前面的CTTTCACT,其余部分则完全一致(图 3)。将这2个不同的序列与原EST序列采用Vector NTI软件分别拼接,并比较二者的ORF,发现二者的编码序列CDS(coding sequence)完全一致,长861 bp,起始密码子ATG,终止密码子TGA(2个),编码287个氨基酸,5′-UTR长91 bp或107 bp,3′-UTR长302 bp,后接70 bp的寡聚A尾,完整的基因序列见图 3。
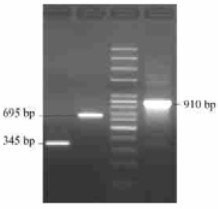
2.4 交错延伸PCR获得油茶AQP基因的CDS交错延伸PCR的原理是分别以两片段的3′(尾)及5′(头)的相同序列(即重叠部分)自身互为引物进行初次PCR,从而将2个片段连接;再迅速加入另一对引物将已连接的片段进行PCR扩增。对同一个基因的分别仅含有起始与终止密码子的2个片段进行交错延伸PCR,以获得完整的基因CDS,可用于各类表达研究,从而为基因的功能研究奠定基础。本研究的2个目的交错片段的理论值分别为:经巢式PCR获得的片段长345 bp、原EST序列长695 bp,二者分别含有引入的NdeⅠ与EcoRⅠ酶切位点,但不含非编码区,电泳检测结果与之一致(图 4)。经交错延伸PCR获得的编码区序列(含酶切位点)理论值为910 bp,为参照方便,与两交错片段一起电泳,其结果与理论值也吻合(图 4)。至此,可以确认已获得油茶AQP基因的一个完整编码序列。
|
图 4 CoAQP完整CDS的交错PCR扩增 Figure 4 Amplification of complete CDS for CoAQP by overlapping extension PCR |
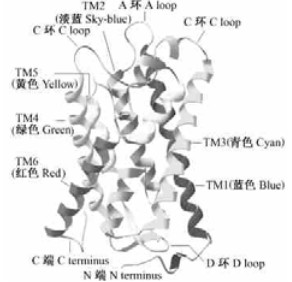
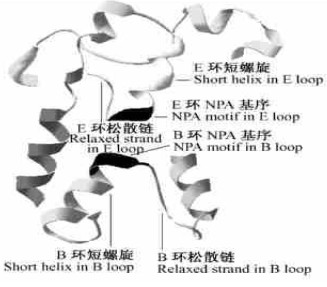
一个AQP分子由6个跨膜的长α-螺旋构成基本骨架, 围绕成水分子通道,N端、C端均在胞质侧。跨膜的骨架由A、B、C、D和E 5个环连接,B、D环在胞质侧,A、C及E环为胞外环(Luu et al., 2005)。B和E环的疏水部分是嵌入但不贯穿膜的短α-螺旋,两者几乎顶对顶地相对,在2个短螺旋相对的顶端各拥有一个十分保守的Asn-Pro-Ala (NPA)基序(隋海心等, 2004)。从这2个短螺旋的顶端分别延生出一条松散链回绕,走向各自的膜面。使用Vector NTI软件将上述油茶AQP的核酸序列翻译成蛋白质序列,提交到http://swissmodel.expasy.org/workspace/index.php?func=modelling_simple,用spdbv V3.7软件对返回的结果观察、绘图并与建模的模板——菠菜(Spinacia oleracea)AQP(SOPIP2;1)的一个同源四聚体(homo tetrameric)亚基1z98A进行比较,Ramachandran图显示仅3个残基的构型角位于最大容忍范围之外,说明二者的结构一致性良好。从不同侧面观察带型彩图,发现B环、E环、C环及6个跨膜螺旋都参与了水通道的形成,B环、E环构成水分子通道的狭口;C环在胞外覆盖在狭口上形成水通道的口缘(图 5、6)。经http://www.predictprotein.org/等相关在线软件分析,得知该蛋白质无糖基化位点,也无信号肽;结合PROF prediction的预测结果与Transmembrane tendency标度的疏水性分析(图略),得到6个跨膜的螺旋区(TM1-TM6,图 7)、2个胞内环B与D、3个胞外环A、C、E的序列位置(图 5),N端、C端都位于胞内,B环与E环各含有一个水通道蛋白特有的保守基序NPA(Chrispeels et al., 1994),形成顶对顶结构(图 6),与隋海心等(2004)的描述完全一致。
|
图 5 同源建模得到的跨膜螺旋及部分特征环 Figure 5 The transmembrane helices and partial characteristic loops by homology modeling |
|
图 6 CoAQP的顶对顶结构示意图 Figure 6 The schematic representation of top to top construction for CoAQP |

|
图 7 CoAQP与部分同源蛋白的比对 Figure 7 The alignment of CoAQP with its several homologous protein 图中各序号代表的蛋白序列号及所属物种The protein accession No. and corresponding plant species representd by the numeric code in the figure 00:CoAQP;01:CAE53882(蓖麻Ricinus communis);02:P25794(豌豆Pisum sativum); 03:AAB72149(菜豆Phaseolus vulgaris);04:CAH60718(欧洲山杨Populus tremula);05:CAA64895(油菜Brassica oleracea);06:ABG57184(柽柳Tamarix sp.);07:CAB56217(菠菜Spinacia oleracea).方框:磷酸化位点;长矩形:NPA基序;TM:跨膜螺旋。Small box: Phosphorylation site; Long rectangle: NPA motif; TM: Transmembrane helixes. |
用CoAQP的CDS序列在NCBI(http://www.ncbi.nlm.nih.gov/)上运行blastx程序搜寻蛋白质数据库,相似性搜索共得到100条序列,涉及到48个物种,score值大于465,E值小于2e-129,相似性都很高,所有的比对序列都覆盖了目的序列的全部(比对序列分布图略),说明该基因在不同的物种间十分保守。100条序列中有明确基因注释的多为Ⅰ类质膜AQP,即PIP1,提示CoAQP可能是质膜内在蛋白PIP1。为便于区分保守区和可变区,将这100条序列按照相似性大小排序,每隔约15条挑取1条与目的CoAQP一道进行比对,结果如图 7,涂色的部分为保守区域,其余为非保守区域,这反映出油茶CoAQP及其他物种的同源基因至少存在5个可变区:N端1-30 aa、C端最后3个aa、位于A环的VSSKTKCST(76-85 aa)、位于C环的EGTTQYDLLGG(155-165 aa)、位于E环的VFNKDRGWD(247-255 aa),6个跨膜螺旋中相对保守,仅有少数几个残基不同,TM3中涉及氧化门控机制的141 aa与146 aa的半胱氨酸(C)也很保守;B环与E环含有保守的NPA基序,且在NPA邻近部分也十分保守。
3.3 CoAQP的类型、定位所有植物质膜AQP(plasma membrane intrinsic protein, PIP)都有2个保守区域,一个位于C环的G-G-G-A-N-X-X-X-X-G-Y(CoAQP为GGGANSVNHGY,相符),另一个位于E环的T-G-I/T-N-P-A-R-S-L/F-G-A-A-I/V-I/V-F/Y-N(CoAQP为TGINPARSLGAAIVFN,也相符),这些基序是液泡膜AQP(TIP)家族中所没有的(Barone et al., 1997),因而推测CoAQP属于分布于质膜上的AQP,即PIP类型。植物的PIP1与PIP2相比,其N端长,而C端短(Chaumont et al., 2000),而CoAQP的N端(55个残基)明显也长于C端(11个残基),进而暗示本CoAQP可能属于PIP1型通道蛋白;从Blast比对结果来看,搜索到的100个同源基因中有明确亚细胞定位信息的基因个数为52个,且全部为PIP1类型,因此结合上述保守区域与N端长度的分析,可以认为CoAQP属于PIP1类型。由于是首次克隆到该基因,故定名为CoPIP1-1(Camellia oleifera PIP)。根据PIP的定义,推测CoPIP1-1分布于油茶种子细胞质膜上。
3.4 CoPIP1-1的水通道活性调节分析 3.4.1 CoPIP1-1的磷酸化位点及其对水通道活性的调节有充分的试验证据表明植物AQP的磷酸化上调水通道的活性(Chaumont et al., 2005),植物AQP的磷酸化可能直接就近参与原位的快速且可逆的门控(Johansson et al., 2000)。对CoPIP1-1采用Prosite程序共搜索到6个可能的磷酸化位点(图 7、图 8),它们的激酶种类及其位点分别是:cAMP依赖的蛋白激酶(胞内B环的RKLS)、蛋白激酶C(胞外A环的SSK)、酪蛋白激酶Ⅱ(胞外C环的TQYD、TKGD,胞内D环的SATD、SARD)。B环126位的RKLS靠近第一个NPA基序的胞质一侧的环内(图 8中以黑色显示),其丝氨酸(S)可能是磷酸化的靶位点(Johansson et al., 1998),它在所有的PIP和几个TIP中都是保守的,位于共有的磷酸化识别序列(Arg/X-Lys-X-Ser-X-X-Arg)的内部,可被包括CDPK(calcium dependent protein kinase)在内的几个蛋白激酶识别(Johansson et al., 2000),磷酸化激酶活性可能依赖于cAMP与cGMP。在SoPIP2;1或PvTIP3;1的这个丝氨酸如被丙氨酸取代,那么这2个蛋白质在卵母细胞中表达时水通道活性都降低(Maurel et al., 1995; Johansson et al., 1998)。因此,这个丝氨酸的高度保守性提示其在结构和功能上的重要性。油茶cDNA文库中发现有酪蛋白激酶Ⅱ(casein kinase Ⅱ)的一个催化亚基,但尚未发现蛋白激酶C与cAMP依赖的蛋白激酶。

|
图 8 胞内几个位点的磷酸化协同作用解除组氨酸质子化造成的通道口覆盖 Figure 8 The phosphorylation of intracellular sites coorperatively derepress the coverage caused by the protonization of histidine |
在http://www.expasy.org/tools/pi_tool.html进行多肽的理论等电点(pI)的计算,得到CoPIP1-1的理论pI为7.7,但其N端pI为4.41,因而在生理中性下,胞内N端带负电荷,而胞内D环(磷酸化位点SARD与SATD所在的环,图 8)的pI为8.49,在生理中性下,带正电荷,则N端和D环可能发生静电作用。有研究表明质膜AQP的活性可能受胞质pH值的影响,胞内D环的组氨酸残基(H)似乎控制着这种效应,该残基被丙氨酸取代时胞质的酸化效应减弱(Tournaire-Roux et al., 2003),考虑到能量的稳态,D环容易内向折叠(Chaumont et al., 2005)。CoPIP1-1含有这样的一个组氨酸(His208,D环上紧邻磷酸化位点SARD后),可感受pH值的变化。D环KRSAR(201-205 aa)中含有空间上紧邻的3个带正电荷的残基(1个K、2个R),强化了局部的荷电性,紧邻的208位组氨酸如被质子化(即胞内pH下降),则正电势更强,从而与带负电荷的N端发生静电作用的可能性增强,导致D环内向折叠而覆盖了水通道孔口,因而CoPIP1-1可能为组成型的低活性。但就在D环的KRSAR(201-205 aa)的两侧各有2个磷酸化位点(图 8以黑色标出):SARD(203-206 aa)、SATD(196-199 aa),因而在某些激酶作用下引起磷酸化级联反应,该位点的磷酸化基团所带的负电荷及空间位置效应可能减弱了D环与N端的静电作用,最终解除了水通道孔口的覆盖,使CoPIP1-1行使水通道功能。同理,胞内B环上带正电荷的RKLS(126-129 aa)的磷酸化,消弱了自身的正电荷,从而减弱了RKLS与N端的静电吸引,并可能同SARD与SATD两位点的磷酸化协同而最终解除通道口的覆盖。作者认为,CoPIP1-1的活性可受磷酸化和质子化的共同调节,其实质是D环与N端的静电作用导致通道口的覆盖与去覆盖,质子化增强D环的覆盖倾向,而磷酸化则是去覆盖从而增强水通道活性。
4 结论与讨论 4.1 5′-RACE产物的序列与原EST的正确拼接5′-RACE产物的序列与原EST拼接的正确性取决于交错模板的特异性。如果目的基因是属于一个多基因家族,而两重叠模板的相似性高会导致其两端的引物设计特异性降低,因此通过5′-RACE就可能得到多个缺失的序列信息,导致错误的序列拼接。本试验采用的2个引物NGSP和AQPFi间的核酸序列(图 3中的重叠区)较长(129 bp),其间的氨基酸序列对应于AQP同源蛋白的TM1、A环的可变区和全部的TM2及部分B环,因此具有基因特异性,可确保得到的2个5′-RACE序列信息正确对应于油茶文库的6186号克隆EST序列。两者5′-UTR有差异,这可能是因为CoPIP1-1的表达调控存在不同的方式,以应对不同的环境刺激或生理状态的改变。
4.2 CoPIP1-1的水通道活性调控机制与油茶种子的氧化胁迫状态CoPIP1-1胞内通道口的B环、D环、N端和C端存在几个活性位点。在正常生理pH时,CoPIP1-1的N端带负电,它与带正电荷的某些位点的静电作用导致通道口被D环与N端覆盖,质子化增强了这种覆盖倾向,而磷酸化的作用相反,可上调CoPIP1-1的水通道活性。因此,CoPIP1-1的水转运活性在正常生理pH下可能不高。根据经验统计,PIP1、PIP2和TIP的N端残基数依次递减,但活性却有增强的趋势(Schäffner, 1998; Chaumont et al., 2000),究其原因,可能是N端越长,与B、D环的作用可能性越大,D环与N端越有可能覆盖孔口(图 8)。如N端足够长,即使存在磷酸化的调节,也可以阻塞通道口。胞内的3个磷酸化位点,可被胞内或膜偶联的激酶磷酸化,这是可理解的,但胞外也存在3个磷酸化位点,其激酶种类和来源又是什么呢?近年的研究表明,钙调素(CaM)可以分泌到胞外并与其受体结合,并证明胞外CaM存在多个受体(周华林等, 2001),现证明动物AQP0上存在CaM的结合位点并可与CaM结合(Rose et al., 2008)。那么,由于AQP在不同物种间的保守性,CoPIP1-1的活性是否也通过CaM在胞外与磷酸化位点相互作用而得到调节?对该问题的探讨可能有助于揭示油茶或其他植物种子成熟时的脱水机理。
黄瓜(Cucumis sativus) (Lee et al., 2004)、番茄(Lycopersicon esculentum)(Bloom et al., 2004)、菠菜(Fennell et al., 1998)与玉米(Melkonian et al., 2004)的根置于寒冷下引起过氧化氢在质膜周围的释放,并降低根水通道蛋白的水力传导度(hydraulic conductivity);直接应用外源的过氧化氢也可导致皮层细胞水力传导度的降低,认为这是AQP的水转运活性受过氧化氢的影响而降低所致(Lee et al., 2004)。还发现活性氧种类(ROS)抑制珊瑚轮藻(Chara coralline)节间细胞水通道的活性(Henzler et al., 2004),可诱导细胞水压导度下降90%,这比经典的汞盐抑制更有效。推测羟自由基通过所谓的氧化门控机制作用,直接氧化AQP或间接氧化脂质膜并形成次级自由基(Henzler et al., 2004),它们可能扳动一系列的级联效应最终导致AQP的活性下调。在油茶cDNA文库中发现有多种与脱水胁迫或氧化胁迫有关的保护蛋白与解毒蛋白(谭晓风等, 2006),还发现1条活性氧来源之一的NADPH氧化酶的EST,暗示成熟或近成熟的油茶种子中ROS有相当的积累。
综上,认为CoPIP1-1在油茶近成熟种子中是组成型低活性的水通道蛋白,这有待试验进一步验证。
4.3 CoPIP1-1在近成熟油茶种子中的表达丰度与水分调节早期的研究指出一些物种的干燥种子中PIP含量极低,甚至检测不出(Daniels et al., 1994; Gao et al., 1999; Suga et al., 2001),其表达量的提高仅出现在胚生长的后期,如,在干燥的油菜(Brassica napus)种子中PIP2的mRNA为低水平积累(Gao et al., 1999)。从与油茶AQP比对的100个物种的AQP同源蛋白数量来看,一般都为1条,提示不同物种的该同源基因属于低丰度表达。实际上油茶cDNA文库中也仅有1条,本研究克隆出2条。在油茶种子近成熟或成熟期,贮藏性物质(酯酰甘油、蛋白质、淀粉)的积累达到高峰,种子内水分含量下降,位于质膜上的CoPIP1-1的编码基因表达的低丰度及蛋白的低活性暗示此时种子内胞外的水分进入胞内受到抑制,这种趋势与油茶油脂合成的联系尚待研究。
Sambrook J, Russell D W. 2002.分子克隆实验指南.黄培堂, 等译. 3版.北京: 科学出版社, 26-27.
|
隋海心, 任罡. 2004. 水分子通道蛋白的结构与功能. 化学进展, 16(2): 146-152. |
谭晓风, 胡芳名, 谢禄山, 等. 2006. 油茶种子EST文库构建及主要表达基因的分析. 林业科学, 42(1): 43-48. |
周华林, 马力耕, 刘曼, 等. 2001. 转融合基因烟草中钙调素分泌特性的研究. 植物学报, 43(12): 1300-1302. DOI:10.3321/j.issn:1672-9072.2001.12.017 |
Aharon R, Shahak Y, Wininger S, et al. 2003. Overexpression of a plasma membrane aquaporins in transgenic tobacco improves plant vigour under favourable growth conditions but not under drought or salt stress. Plant Cell, 15: 439-447. DOI:10.1105/tpc.009225 |
Barone L, Shih C, Wasserman P. 1997. Mercury-induced conformational changes and identification of conserved surface loops in plasma membrane aquaporins from higher plants. J Biol Chem, 272: 30672-30677. DOI:10.1074/jbc.272.49.30672 |
Bloom A J, Zwieniecki M A, Passoura J B, et al. 2004. Water relations under root chilling in a sensitive and tolerant tomato species. Plant, Cell and Environment, 27: 971-979. DOI:10.1111/pce.2004.27.issue-8 |
Chaumont F, Barrieu F, Jung R, et al. 2000. Plasma membrane intrinsic proteins from maize cluster in two sequence subgroups with differential aquaporin activity. Plant Physiol, 122: 1025-1034. DOI:10.1104/pp.122.4.1025 |
Chaumont F, Moshelion M, Daniels M J. 2005. Regulation of plant aquaporin activity. Biol Cell, 97: 749-764. DOI:10.1042/BC20040133 |
Chrispeels M, Maurel C. 1994. Aquaporins: the molecular basis of facilitated water movement through living plant cells?. Plant Physiol, 105: 9-13. DOI:10.1104/pp.105.1.9 |
Comparot S, Morilon R. 2000. Water permeability and revolving movement in Phaseolus vulgaris L. Plant Cell Physiol, 41: 114-118. DOI:10.1093/pcp/41.1.114 |
Daniels M J, Mirkov T E, Chrispeels M J. 1994. The plasma membrane of Arabidopsis thaliana contains a mercury-insensitive aquaporin that is a homolog of the tonoplast water channel protein TIP. Plant Physiol, 106: 1325-1333. DOI:10.1104/pp.106.4.1325 |
Fennell A, Markhart A. 1998. Rapid acclimation of root hydraulic conductivity to low temperature. Journal of Experimental Botany, 49: 879-884. DOI:10.1093/jxb/49.322.879 |
Gao Y P, Young L, Bonham-Smith P, et al. 1999. Characterization and expression of plasma and tonoplast membrane aquaporins in primed seed of Brassica napus during germination under stress conditions. Plant Mol Biol, 40: 635-644. DOI:10.1023/A:1006212216876 |
Henzler T, Ye Q, Steudle E. 2004. Oxidative gating of water channels (aquaporins) in Chara by hydroxyl radicals. Plant, Cell and Environment, 27: 1184-1195. DOI:10.1111/pce.2004.27.issue-9 |
Jang J Y, Lee S H, Rhee J Y, et al. 2007. Transgenic Arabidopsis and tobacco plants overexpressing an aquaporin respond differently to various abiotic stresses. Plant Mol Biol, 64: 621-632. DOI:10.1007/s11103-007-9181-8 |
Johansson I, Karlsson M, Johanson U, et al. 2000. The role of aquaporins in cellular and whole plant water balance. Biochim Biophys Acta, 1465: 324-342. DOI:10.1016/S0005-2736(00)00147-4 |
Johansson I, Karlsson M, Shukla V, et al. 1998. Water transport activity of the plasma membrane aquaporin PM28A is regulated by phosphorylation. Plant Cell Environ, 10: 451-459. DOI:10.1105/tpc.10.3.451 |
Kjelbom P, Larsson C, Johansson I, et al. 1999. Aquaporins and water homeostasis in plants. Trends Plant Sci, 4: 308-314. DOI:10.1016/S1360-1385(99)01438-7 |
Lee S H, Singh A P, Chung G C. 2004. Rapid accumulation of hydrogen peroxide in cucumber roots due to exposure to low temperature appears to mediate decreases in water transport. Journal of Experimental Botany, 55: 1733-1741. DOI:10.1093/jxb/erh189 |
Lee S H, Singh A P, Chung G C, et al. 2004. Exposure of roots of cucumber (Cucumis sativus) to low temperature severely reduces root pressure, hydraulic conductivity and active transport of nutrients. Physiologia Plantarum, 120: 413-420. DOI:10.1111/ppl.2004.120.issue-3 |
Luu D T, Maurel C. 2005. Aquaporins in a challenging environment: molecular gears for adjusting plant water status. Plant Cell Environ, 28: 85-96. DOI:10.1111/pce.2005.28.issue-1 |
Maeshima M, Ishikawa F. 2007. ER membrane aquaporins in plants. Pflugers Arch-Eur J Physiol, Springer, DOI10.1007/s00424-007-0363-7.
|
Mariaux J B, Bockel C, Salamini F, et al. 1998. Desiccation- and abscisic acid-responsive genes encoding major intrinsic proteins (MIPs) from the resurrection plant Craterostigma plantagineum. Plant Mol Biol, 38: 1089-1099. DOI:10.1023/A:1006013130681 |
Maurel C, Javot H, Lauvergeat V, et al. 2002. Molecular physiology of aquaporins in plants. Inter Revi Cytol, 215: 105-148. DOI:10.1016/S0074-7696(02)15007-8 |
Maurel C, Kado R T, Guern J, et al. 1995. Phosphorylation regulates the water channel activity of the seed-specific aquaporin α-TIP. EMBO, 14: 3028-3035. DOI:10.1002/embj.1995.14.issue-13 |
Melkonian J, Yu L X, Setter T L. 2004. Chilling responses of maize (Zea mays L.) seedlings: root hydraulic conductance, abscisic acid, and stomatal conductance. Journal of Experimental Botany, 55: 1751-1760. DOI:10.1093/jxb/erh215 |
Rose K M L, Wang Z, Magrath G N, et al. 2008. Aquaporin 0-calmodulin interaction and the effect of aquaporin-0 phosphorylation. Biochemistry, 47: 339-347. DOI:10.1021/bi701980t |
Schäffner A R. 1998. Aquaporin function, structure, and expression: are there more surprises to surface in water relations?. Planta, 204: 131-139. DOI:10.1007/s004250050239 |
Suga S, Imagawa S, Maeshima M. 2001. Specificity of the accumulation of mRNAs and proteins of the plasma membrane and tonoplast aquaporins in radish organs. Planta, 212: 294-304. DOI:10.1007/s004250000396 |
Tournaire-Roux C, Sutka M, Javot H, et al. 2003. Cytosolic pH regulates root water transport during anoxic stress through gating of aquaporins. Nature, 425: 393-397. DOI:10.1038/nature01853 |
 2008, Vol. 44
2008, Vol. 44
