文章信息
- 张颖娟, 王玉山.
- Zhang Yingjuan, Wang Yushan
- 濒危小灌木长叶红砂种群的遗传多样性
- Genetic Diversity of Endangered Shrub Reaumuria trigyna Population Detected by RAPD and ISSR Markers
- 林业科学, 2008, 44(12): 43-47.
- Scientia Silvae Sinicae, 2008, 44(12): 43-47.
-
文章历史
- 收稿日期:2008-02-19
-
作者相关文章
长叶红砂(Reaumuria trigyna)为柽柳科(Tamaricaceae)红砂属(Reaumuria)的强旱生小灌木,生于石质低山、山前洪积或冲积平原。分布于内蒙古、宁夏及甘肃与宁夏交界处沿黄河两岸桌子山至贺兰山区及其邻近的低山石质丘陵坡地和砂砾质地的狭长地带(赵一之,1996)。一般为红砂(Reaumuria soongorica)、四合木(Tetraena mongolica)、绵刺(Potaninia mongolica)等荒漠群落的亚优势种或伴生种,但在鄂尔多斯的桌子山山麓地带可形成建群种,是我国西北干旱荒漠区重要的超旱生小灌木,对维持荒漠脆弱生态系统的稳定性及保护荒漠生态环境具有重要作用。
长叶红砂是古地中海区系的孑遗植物,形态特征独特,因此对于植物分布和区系地理、生物生态学等方面的研究具有重要价值,被列为内蒙古和国家重点保护植物(赵一之,1991)。目前的研究仅在形态特征和区系地理分布、种子萌发等方面(宋玉霞等,1996;赵一之,1996;张敏等,2006),而有关生殖生态、种群遗传结构等方面的研究尚未见报道,缺乏对长叶红砂濒危原因各方面情况的足够了解。濒危植物的生态遗传学研究是揭示濒危原因的一个重要方面。对濒危植物遗传多样性的研究不仅能了解物种的进化过程以及濒危机制,而且为采取积极有效的措施保护濒危物种提供科学依据。因此, 有必要对长叶红砂进行分子水平上的研究。本文采用RAPD和ISSR技术对分布在内蒙古桌子山地带的5个长叶红砂种群进行了分析,旨在揭示长叶红砂自然种群的遗传结构和遗传多样性的水平,为长叶红砂遗传资源的保护提供依据。
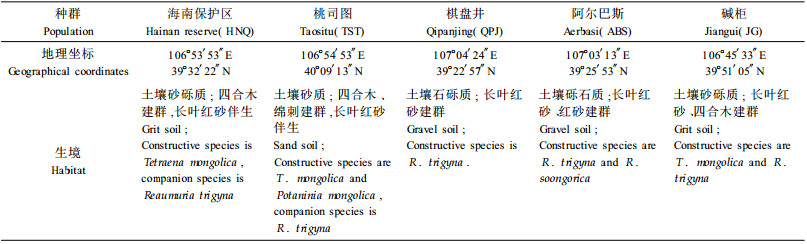
1 材料与方法 1.1 材料来源试验材料长叶红砂采自内蒙古的桌子山山麓和乌海市周边,选择5个不同生境类型的群落(表 1)。从各生境中采集20株生长健康的植株嫩叶,叶片经变色硅胶迅速干燥后,于-80 ℃保存备用。
|
|
采用CTAB法(Doyle et al., 1987),并根据物种特性适当调整。总DNA溶于0.1×TE缓冲液后4 ℃储存。DNA样品在0.75%琼脂糖凝胶中电泳,以0.5 μg·μL-1的标准λDNA/EcoRⅠ+ HindⅢ做对照,检测基因组DNA的浓度大小。
1.2.2 RAPD扩增及检测RAPD的反应条件同张颖娟等(2002),从90个RAPD引物(购自上海生工)中筛选出稳定性和重复性好、位点清晰的18个引物(S67,S69,S88,S90,S104,S111,S121,S127,S130,S141,S174,S208,S255,S279,S282,S315,S450,S459), 用于RAPD扩增。RAPD程序同张颖娟等(2002)。
扩增产物检测:用1.5%琼脂糖凝胶(含溴化乙锭)在0.5×TBE电泳缓冲液中电泳,电压为80 V,电泳2 h后在Tanon-GIS-2010凝胶成像仪上观察照相。
1.2.3 ISSR扩增及检测ISSR反应体系主要对DNA浓度、引物浓度等反应条件进行优化,确定的扩增反应总体积为10 μL,包括:模板DNA 25 ng,引物0.6 μmol·L-1,2×Master Mix 4.5 μL(包含Taq DNA聚合酶、dNTPs、MgCl2、反应缓冲液、PCR反应的增强剂和优化剂以及稳定剂),加双蒸水至10 μL。对60个ISSR引物进行筛选,筛选出14个用于PCR扩增(ISSR引物是根据加拿大哥伦比亚大学公布的第9套序列,由上海生工合成),名称和序列见表 2。
|
|
ISSR扩增程序如下:94 ℃预变性3 min; 94 ℃变性30 s,50 ℃退火45 s(退火温度依据引物变化),72 ℃延伸1.5 min,进行40个循环;最后72 ℃延伸5 min。扩增产物4 ℃保存。检测和照相同RAPD。
1.2.4 数据处理RAPD和ISSR都是显性标记,按同一位置上扩增产物条带的有无进行统计,有带的(包括反复出现的弱带)标记为“1",无带的标记为“0",缺失的(没有出现的)标记为“."。用1 kb plus DNA作分子量标记,对照反应产物在胶上的位置,将迁移率相同的带作为同源位点处理,得到1、0数据矩阵,应用Popgene32软件计算多态位点比率(P)、Shannon多样性指数(I)、Nei基因多样度(H)、基因分化系数(Gst)、基因流(Nm),分析其遗传多样性。并计算各引物扩增条带在种群和物种水平的表型多样性,计算种群内和种群间变异所占的比例,分析种群间的遗传关系。
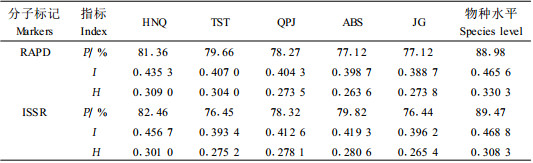
2 结果与分析 2.1 扩增的多态性18个RAPD引物在5个长叶红砂种群中扩增出118个位点,每条引物平均检测到6个位点,其中多态位点105个,多态位点比率88.98%。14个ISSR引物扩增出114个位点,其中多态位点102个,多态位点比率89.47%,每条引物平均检测到8个位点,略高于RAPD分析的结果。2种标记的扩增片断分子量都在200~2 000 bp之间,不同引物扩增的多态位点数不等,形成了带型丰富、片断大小及其组合不同的电泳图谱(图 1),表明长叶红砂具有较高的遗传多样性。但各种群的多态位点比率差异较大(表 3),其中海南保护区(HNQ)种群的多态性最高,碱柜(JG)种群的最低。

|
图 1 ISSR引物825(左)和840(右)在海南区种群中的扩增结果 Figure 1 ISSR amplification results of HNQ with primer UBC825(left) and 840(right) |
|
|
2种标记的扩增结果见表 3。RAPD分析的Shannon多样性指数(I)海南区种群的最高(0.435 3),碱柜(JG)种群的最低(0.388 7),物种水平上为0.465 6。Nei基因多样度指数(H)计算的结果与Shannon指数计算的结果一致,各种群在0.263 6~0.309 0之间变化。不论哪种指标,都显示在乌海市的海南保护区(HNQ)具有最高的遗传多样性。
ISSR计算的Shannon多样性指数在0.396 2~0.456 7,物种水平上为0.468 8。其中海南保护区(HNQ)的遗传多样性最高(0.456 7),桃司图(TST)种群的最低(0.393 4),Nei基因多样度指数计算各种群多样性在0.265 4~0.301 0之间变化,物种水平上为0.308 3。ISSR的结果同样表明,海南保护区(HNQ)具有最高的遗传多样性。
在物种水平上,14个ISSR引物的扩增结果略高于18个RAPD引物的结果,在种群水平,各种群的多态位点数在2种标记下相近(数据略),并未表明ISSR的结果高于RAPD。RAPD和ISSR均显示,各项多样性指标在海南保护区种群最高,碱柜种群相对较低。
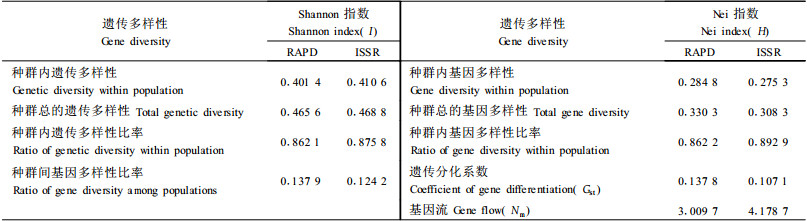
2.3 遗传结构基于I和H计算的种群内和种群间的遗传变异见表 4。在总的遗传多样性中, RAPD种群内的遗传多样性分别占86.21%和86.22%,种群间占13.79%和13.78%。ISSR种群内的遗传多样性分别占87.58%和89.29%,种群间占12.42%和10.71%。结果表明遗传变异大部分来自于种群内,遗传变异主要来自种群内不同个体的遗传差异,少数的遗传变异来自种群间。
|
|
虽然ISSR所检测的种群内遗传多样性并不高于RAPD,但种群内遗传多样性比率高于RAPD,反映了ISSR能以较少的引物检测到较高的多样性。
基于种群间遗传分化系数计算的基因流Nm分别为3.009 7和4.178 7,远大于1,说明不同种群间存在较强基因流,防止了由于遗传漂变导致的种群间的遗传分化。
3 结论与讨论 3.1 长叶红砂的遗传多样性研究认为,物种分布的地理范围与遗传多样性紧密相关,特有种的一个共同特点就是低水平的遗传多样性(金则新等, 2007; Ge et al., 2005; Godt et al., 1996; Gitzendanner et al., 2000; Zhang et al., 2005)。但近年来,有许多研究发现,珍稀濒危植物具有较高的遗传多样性,如云南特有濒危植物景东报春(Primula interjacens)(Xue et al., 2004)、杜鹃科的濒危植物Leucopogon obtectus(Zawko et al., 2001)及热带濒危树种Hagenia abyssinica (Feyissa et al., 2007)。本研究表明,尽管种群小,分布狭窄,长叶红砂的遗传多样性水平却很高。在物种水平上,RAPD和ISSR分析的值分别为:P为88.98%和89.47%,I为0.465 6和0.468 8,H为0.330 3和0.308 4。该地区其他濒危灌木如四合木的RAPD检测也具有较高的遗传多样性水平(P=84.76%,H=0.363 4)(张颖娟等,20002)。珍稀植物表现出的高水平遗传多样性与很多因子有关,如分布区或生境的变化、繁育系统、体细胞突变、奠基者效应、更新世产生的物种遗留区等。长叶红砂高水平的遗传多样性与进化历史有关。长叶红砂为第三纪孑遗种,推测曾经广泛分布,其祖先具有比较丰富的遗传基础,由于受第四纪冰川的影响, 幸存的个体在西鄂尔多斯这个第三纪残遗植物“避难所”中得以保留。
在种群水平上,长叶红砂同样维持较高水平遗传多样性。其中海南区种群在各项指标上均具有最高值,这与群落特征和微环境有关。乌海市的海南保护区是西鄂尔多斯珍稀濒危植物主要保护区,生长着一批古老的物种,如四合木、半日花(Helianthemum ordosicum)、霸王(Zygophllum xanthoxylon)、红砂、珍珠柴(Salsola passerina)等,保护区内物种较丰富,微气候条件较好,人为干扰少,有利于各植物生长繁衍,因而能够维持较高的遗传多样性水平。而阿尔巴斯种群自然环境较严酷,放牧较严重,牲畜采食植物叶和花蕾,影响了繁殖;挖煤等人为活动频繁,野生种群不断变小,遗传漂变和近交的作用增加,通过近交衰退和杂合度的降低影响个体的适合度,导致遗传多样性的丧失,造成种群内遗传多样性降低。
遗传变异水平受多方面因素影响,诸如生活型、繁殖方式、基因流、遗传漂变及自然选择和人为干扰等。繁育系统又是主要影响因素。长叶红砂以有性繁殖为主,雌雄同株,虽然缺乏传粉方面深入的研究,但这样的繁育系统有利于维持个体和种群的遗传多样性,同时促进种群内基因交流,减少遗传漂变。因此,多年生小灌木、风媒和虫媒传粉、行有性繁殖等特点都与长叶红砂种群较高的遗传多样性有关。长叶红砂在恶劣的环境中进化并积累了较多的遗传变异,以适应各种环境压力。
3.2 长叶红砂的遗传分化遗传分化显示,长叶红砂的遗传变异大部分存在于种群内,分别占86.22%和89.29%,种群间的遗传变异占13.78%和10.71%。Nybom和Bartish(2000)根据RAPD研究总结出自交、混交和异交物种的Gst分别为0.59、0.19、0.23。虽然目前缺乏长叶红砂繁殖生态学的确切证据,但从遗传分化系数看出,种群间分化程度远低于近交物种水平,与混交物种的平均水平相近(Gst=0.144),推测它是以混交为主的物种。
影响种群遗传结构的因素有很多,如繁育系统、分布范围、基因流等。其中基因流被认为是种群遗传结构均质化的主要因素之一,具有广泛基因流的物种往往比具有有限基因流的物种遗传分化小。野外观测发现,长叶红砂兼有风媒和虫媒传粉,种子外被种毛,质量较轻,植物种群间的基因流主要是靠花粉和种子扩散,各种群间地理距离也较近,因此种群间存在基因交流。
3.3 长叶红砂的保护与其他珍稀濒危物种不同,长叶红砂高水平的遗传多样性表明该物种还未发生遗传瓶颈,未产生自交衰退现象。遗传多样性水平在一定程度上体现着物种适应环境的能力,制约着物种进化水平。保护现存自然种群以保存尽可能多的遗传多样性是近期的保护措施。从长远看,最适宜的措施就是保护生境,生境适宜促进物种进化,有利于物种长期生存发展。因此建议,在以长叶红砂为建群种的棋盘井和阿尔巴斯地区建立保护小区或保护点,加强其原生境的保护,禁止人为破坏。由于该地区种群遗传基础较好,若采取有效的措施,种群是可以维持自然更新的。同时为生物生态学特性的研究提供基地。
金则新, 李钧敏. 2007. 濒危植物夏腊梅遗传多样性的ISSR分析. 应用生态学报, 18(2): 247-253. DOI:10.3321/j.issn:1001-9332.2007.02.003 |
宋玉霞, 于卫平, 王立英, 等. 1996. 贺兰山不同生境旱生灌木的解剖学研究. 西北植物学报, 16(5): 69-76. DOI:10.3321/j.issn:1000-4025.1996.05.015 |
张敏, 王迎春. 2006. 长叶红砂种子在萌发过程中细胞内营养物质动态研究. 内蒙古大学学报:自然科学版, 37(5): 535-539. |
张颖娟, 杨持. 2002. 中国特有种四合木种群遗传多样性的RAPD分析. 生态学报, 22(11): 1917-1922. DOI:10.3321/j.issn:1000-0933.2002.11.017 |
赵一之. 1991. 内蒙古珍稀濒危植物图谱. 北京: 中国农业科技出版社, 52.
|
赵一之. 1996. 长叶红砂(Reaumuria trigyna)植物区系地理分布研究. 内蒙古大学学报:自然科学版, 27(3): 369-370. |
Doyle J J, Doyle J L. 1987. A rapid isolation procedure for small quantities of fresh leaf tissue. Phytochem Bull, 19: 11. |
Feyissa T, Nybom H, Bartish I V. 2007. Analysis of genetic diversity in the endangered tropical tree species Hagenia abyssinica using ISSR markers. Genet Resour Crop Evol, 54: 947-958. DOI:10.1007/s10722-006-9155-8 |
Godt M J W, Hamrick J L. 1996. Genetic diversity and population size in four rare southern Appalachian plant species. Conservation Biology, 10: 796-805. DOI:10.1046/j.1523-1739.1996.10030796.x |
Ge Xuejun, Zhang Linbing, Hao Gang, et al. 2005. Strong genetic differentiation of the East-Himalayan Megacodon stylophorus (Gentianaceae) detected by Inter-Simple Sequence Repeats (ISSR). Biodiversity and Conservation, 14: 849-861. |
Gitzendanner M A, Soltis P S. 2000. Patterns of genetic variation in rare and widespread plant congeners. Amrican Journal of Botany, 87: 783-792. |
Nybom H, Bartish I V. 2000. Effects of life history traitsand sampling strategies on genetic diversity estimates obtained with RAPD markers in plants. Persp Plant Ecol Evol Syst, 3: 93-114. |
Xue Dawei, Ge Xuejun, Hao Gang, et al. 2004. High genetic diversity in a rare, narrowly endemic primrose species Primula interjacens by ISSR analysis. Acta Botanica Sinica, 46(10): 1163-1169. |
Zawko G, Krauss S L, Dixon K W, et al. 2001. Conservation genetics of the rare and endangered Leucopogon obtectus (Ericaceae). Molecular Ecology, 10: 2389-2396. DOI:10.1046/j.0962-1083.2001.01378.x |
Zhang Zhiyong, Chen Yongyan, Li Dezhu. 2005. Detection of low genetic variation in a critically endangered Chinese Pine, Pinus squamata, using RAPD and ISSR markers. Biochemical Genetics, 43: 239-249. |
 2008, Vol. 44
2008, Vol. 44