文章信息
- 刘亚娟, 苏俊霞, 杜秀丽, 张鹏, 魏学智.
- Liu Yajuan, Su Junxia, Du Xiuli, Zhang Peng, Wei Xuezhi
- 翅果油树大小孢子发生及雌雄配子体发育
- Megasporogenesis, Microsporogenesis and Development of Gametophytes of Elaeagnus mollis
- 林业科学, 2008, 44(12): 39-42.
- Scientia Silvae Sinicae, 2008, 44(12): 39-42.
-
文章历史
- 收稿日期:2008-01-14
-
作者相关文章
翅果油树(Elaeagnus mollis)属胡颓子科(Elaeagnaceae)胡颓子属, 国家二级保护植物(国务院,1999),主要分布于山西省吕梁山南端乡宁县木凹、关王庙和中条山北端翼城县甘泉、二曲等地海拔800~1 000 m的黄土沟壑和土石山区。此外,在陕西省户县涝峪沟曾发现残存10余株(狄维忠等, 1989)。翅果油树分布范围狭窄,个体数量日趋减少,处于濒危状态(上官铁梁等,2001)。翅果油树是我国特有优良的木本油料植物和蜜源植物。其种子含油量高,品质好,亚油酸含量高,有利于防治高血压、动脉硬化等病症。
近年来,对于翅果油树的营养器官(魏学智等, 2004)、快繁技术(陈惠等,1998;闫桂琴等,2003)、种群的遗传结构和遗传多样性(秦永燕等,2006;闫桂琴等,2004)及群落生态学(张峰等,2004;2000)等已有报道,但对于胚胎学研究还未见报道。本文通过对翅果油树大、小孢子发生及雌、雄配子体发育的研究,从生殖学角度研究翅果油树在生殖过程中是否存在障碍,为探讨翅果油树致濒的原因和机制提供生殖生物学依据。
1 材料与方法研究材料采自山西省翼城县甘泉乡林场。在2004年8月20日到2005年5月20日,即花芽分化开始到开花期,选取不同发育阶段的花芽、花蕾和花固定于FAA固定液中。采用常规的石蜡切片法,爱氏苏木精整体染色,伊红复染。部分切片使用铁矾-苏木精染色,切片厚度为6~10 μm。封片后在Nikon Eclipse E200光学显微镜下观察并拍照。在解剖镜下从固定材料中剥取早期发育胚珠,经过酒精逐级脱水,过醋酸异戊酯,再经过CO2临界点干燥,喷金后在KYKY Amray-1000型扫描电镜下观察胚珠形态并照相。
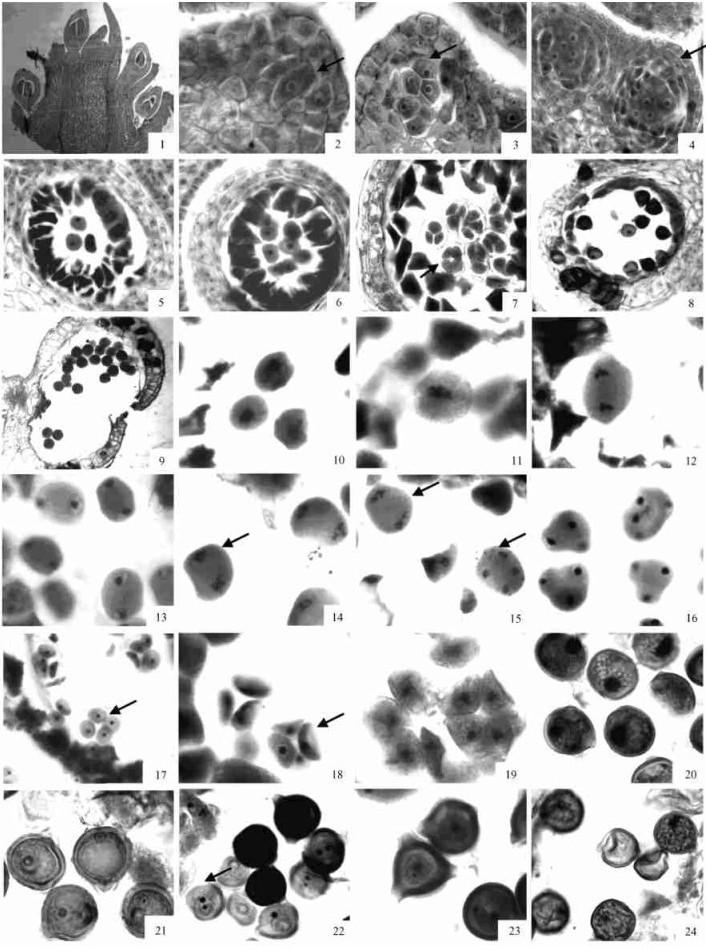
2 结果与分析 2.1 花药壁的发育翅果油树花器官分化较早,在开花前一年9月初部分花芽已经开始分化(图版Ⅰ-1)。翅果油树的花药具4个花粉囊,花药发育的早期,结构简单,最外面是一层表皮,表皮之内是一团分生组织。第2年3月中旬,花药分化速度加快,在4个角隅处分化出孢原细胞(图版Ⅰ-2),孢原细胞经平周分裂形成初生壁细胞和初生造孢细胞(图版Ⅰ-3)。初生壁细胞经过平周分裂和垂周分裂形成3~4层细胞(图版Ⅰ-4)。当其小孢子母细胞形成时药室壁已发育完全,自外向内依次为表皮层、药室内壁、1~2中层和绒毡层(图版Ⅰ-5)。翅果油树花药壁发育属于基本型。
|
图版Ⅰ Plate Ⅰ 1.花芽分化(×40); 2.孢原细胞(×400); 3.初生造孢细胞(×400); 4.次生造孢细胞发育后期的花药壁结构(×100);5.小孢子母细胞及分化完成的花药壁(×100); 6.减数分裂前的小孢子母细胞(×100); 7.左右对称的小孢子四分体 (×100); 8.单核小孢子时花药壁(×100); 9.成熟花药开裂(×100); 10.小孢子第1次减数分裂前期(×400); 11.第1次减数分裂中期(×400); 12.第1次减数分裂后期(×400);13.第1次减数分裂末期(×400); 14.小孢子第2次减数分裂中期(×400) ; 15.第2次减数分裂后期、末期(×400); 16.四面体型小孢子四分体 (×400); 17.交叉型小孢子四分体(×400); 18.交叉型的变形四分体(×400); 19.刚从四分体中释放出来的小孢子(×400); 20.单核小孢子(×400); 21.小孢子单核靠边期(×400); 22.二核花粉粒(×400); 23.花粉的3个萌发孔(×400); 24.异常小孢子(×400)。 1.Bud flower differentiation (×40);2.Archesporium cell (×400);3.Primary sporogenous cells (×400);4.The structure of anther wall when the secondary sporogenous cells having developed (×100);5.Microspore mother cell and the structure of anther wall (×100);6.Microspore mother cell before meiosis (×100); 7.The isobilateral tetrad (×100);8.The structure of anther wall when the cell wall of microspore expand (×100);9.Split of mature anther (×100);10.Prophase of microspore mother cell meiosis (×400);11~13.The stages of microspore mother cell meiosis, showing metaphase (×400), anaphase(×100) and telophase (×400), respectively;14,15.The stage of microspore mother cell meiosisⅡ (×400);16.Tetrahedral tetrad (×400);17.Decyssate tetrad (×400);18.Decussate tetrad (×400);19.The microspore having shedded from the tetrads (×400);20. Uninucleate microspores(×400);21.Uninucleate microspore at the vacuolation stage (×400);22.Bicelluar pollen (×400);23.Three germ pore (×400);24.Abnormal microspore (×400). |
3月下旬,小孢子母细胞减数分裂前,中层细胞逐渐解体、退化,变成长条状或残迹,绒毡层无明显变化(图版Ⅰ-6)。减数分裂完成时中层几乎全部退化消失,随着小孢子的发育,绒毡层细胞逐渐解体(图版Ⅰ-7,8)。4月中旬时,绒毡层细胞仅存残迹。4月下旬花粉粒成熟时,花药壁只剩下2层:表皮和呈“U”形纤维加厚的药室内壁(图版Ⅰ-9)。翅果油树的绒毡层属腺质绒毡层。
2.2 小孢子发生及雄配子体发育翅果油树花药在3月中下旬已经分化出初生造孢细胞(图版Ⅰ-3)。初生造孢组织分裂发育产生次生造孢细胞(图版Ⅰ-4)。次生造孢细胞继续发育成小孢子母细胞,小孢子母细胞体积大,细胞核大,细胞质浓(图版Ⅰ-5, 6)。3月底小孢子母细胞进入减数分裂期(图版Ⅰ-10~15),减数分裂第1次只有核分裂,不伴随细胞质的分裂,2个子核间不形成细胞壁,而是形成一双核细胞,不出现二分体时期(图版Ⅰ-13)。减数分裂第2次分裂时,2个子核同时分裂(图版Ⅰ-14, 15),减数分裂完成后,4个子细胞为共同的胼胝质包围,即为四分体,四分体排列成左右对称型、四面体型或交叉型(图版Ⅰ-7, 16, 17)。其中有部分四分体小孢子在形态上发生程度不同的收缩变形(图版Ⅰ-18)。小孢子母细胞减数分裂的胞质分裂为同时型。
每个药室内的小孢子母细胞进行减数分裂时处于同一时期,具有同步性。在同一花药中的4个药室中,小孢子母细胞的减数分裂不具有同步性,彼此可相差1~2个分裂时期。以后,随着胼胝质的溶解,4个小孢子彼此分开。刚从四分体中分离的小孢子细胞壁薄,细胞质浓,细胞核位于细胞中央(图版Ⅰ-19)。随之小孢子发育,体积增大,成为圆球形,细胞核较大,成为单核小孢子(图版Ⅰ-20)。随后小孢子细胞质出现液泡化形成一个中央大液泡,细胞核被挤到细胞的边缘,此时小孢子为单核靠边期(图版Ⅰ-21)。
经历了单核靠边期后,小孢子进行一次不均等有丝分裂,形成一个大的营养细胞和一个小的生殖细胞。营养细胞占据花粉的绝大部分体积(图版Ⅰ-22)。随着生殖细胞与营养细胞之间细胞壁消失,生殖细胞逐渐脱离花粉内壁,并游离于营养细胞的细胞质中。成熟花粉粒为2-细胞型,具有3个萌发孔(图版Ⅰ-23)。
在雄配子体发育过程中,观察到存在小孢子败育现象。败育的小孢子收缩变小,变形为月牙状结构且不见细胞核(图板Ⅰ-24)。
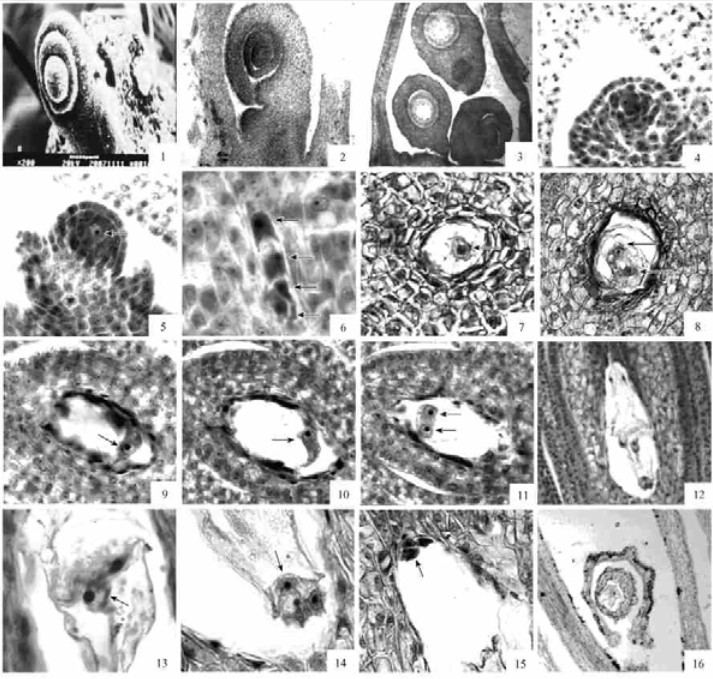
2.3 胚珠的发育与结构翅果油树雌蕊子房上位,单心皮,每个子房内一般只有1个胚珠,稀见2或3个胚珠(图版Ⅱ-2,3)。最初子房底部首先分化出胚珠原基,原基顶部进一步分化出珠心。随后珠心基部分化出内外珠被,外珠被的发育稍快于内珠被,逐渐将珠心和内珠被包围(图版Ⅱ-1,2)。4月初形成完整的胚珠,胚珠在发育过程中,由于珠柄两侧细胞分裂速度不均等,整个胚珠弯曲近180°,成为倒生胚珠(图版Ⅱ-2)。基生胎座,双珠被,厚珠心。
|
图版Ⅱ Plate Ⅱ 1.胚珠电镜扫描:内外珠被的发育(×200);2.子房上位,胚珠倒生(×100);3.3个胚珠(×40);4.造孢细胞(×400);5.大孢子母细胞(×400);6.四分体(×400);7.单核胚囊(×400);8.双核胚囊(×400);9~11.3张连续切片的四核胚囊(×400);12.成熟胚囊(×100);13.中央细胞(×400);14.卵器(×400):12图的部分放大;15.3个反足细胞(×400);16.异常胚囊(×100). 1.Development of the inner integument and outer integument in SEM (×200);2.The ovary is superior and the ovule is anatropous (×100);3.Three ovules (×40);4.Archesporium of female gametophyte (×400);5.Megaspore mother cell (×400);6.Tetrad of megaspores(×400);7.Uninucleate embryo sac(×400);8.Two-nucleate embryo sac (×400);9~11.Four-nucleate embryo sac (×400);12.The mature embryo sac (×100);13.Central cell (×400);14.Egg apparatus (×400);15.Antipodal cell (×400);16.Abnormal embryo sac (×100). |
胚珠发育初期,珠心表皮下分化出一个孢原细胞,孢原细胞进行有丝分裂形成周缘细胞和造孢细胞(图版Ⅱ-4)。造孢细胞发育成大孢子母细胞(图版Ⅱ-5),大孢子母细胞位于珠心表皮细胞下方第2层,故翅果油树是厚珠心。
随之大孢子母细胞进行减数分裂,形成4个大孢子,即大孢子四分体。由于第1次分裂和第2次分裂都形成横的分隔壁,故4个大孢子成一直线排列(图版Ⅱ-6)。四分体中只有近合点端的一个大孢子起作用,形成功能大孢子,其余3个退化。
功能大孢子直接发育为单核胚囊(图版Ⅱ-7)。单核胚囊体积继续增大,细胞核进行有丝分裂形成二核胚囊(图版Ⅱ-8)。二核形成初期互相靠近,随后在中央液泡的作用下移向胚囊的两端。二核经过有丝分裂形成四核胚囊(图版Ⅱ-9~11)。再经过一次有丝分裂形成八核胚囊(图版Ⅱ-12),胚囊显著地增大。其中珠孔端和合点端各有1个细胞核向胚囊中间移动,发育成中央极核(图版Ⅱ-13),珠孔端另外3个细胞核形成由1个卵细胞和2个助细胞组成的卵器(图版Ⅱ-14)。而合点端的另外3个细胞核则形成反足细胞,成“品”字型排列(图版Ⅱ-15),胚囊发育完成,不久反足细胞便退化。因此,翅果油树雌配子体属蓼型胚囊。
对翅果油树不同阶段的花进行完整切片,观察到有极少数不正常发育的胚囊,一些胚囊小,胚珠形状不规则,珠心细胞排列不规则(图版Ⅱ-16)。
2.5 雌、雄配子体发育与花蕾外部形态及时间的相关性翅果油树雌、雄蕊发育不同步(表 1),在整个发育过程中,雄蕊发育早,雌蕊发育相对迟缓。小孢子母细胞进行减数分裂时,雌蕊才出现胚珠原基。至小孢子四分体解体形成单核小孢子时,才观察到大孢子母细胞。此后胚囊的发育进程加快,花粉成熟时,胚囊也趋于成熟。胚囊的成熟一般发生在花药开裂后2~5 d。当柱头变黑时,其合子细胞进入胚胎发育时期。因此,要确定内部配子体发育的变化情况可根据花蕾外部形态来进行判断。
|
|
有关胡颓子科胚胎学研究资料很少,主要工作是对沙棘属沙棘(Hippophae rhamnoides)的研究报道(马瑞君等, 1999; 2000;李文钿等, 1988; 王太鑫等, 2000),胡颓子属的研究仅见刘育梅(2003)对羊奶果(Elaeagnus conferta)的研究报道。本文对翅果油树的大、小孢子及雌、雄配子体发育的研究表明,翅果油树小孢子母细胞减数分裂的胞质分裂方式为同时型,小孢子四分体为四面体型、交叉型及左右对称型,绒毡层为腺质绒毡层。成熟花粉粒为二细胞型,有3个萌发孔。本文研究结果表明,其子房上位,这与狄维忠等(1989)所描述的子房下位不同,而与谢树莲等(1997)的描述相同。在翅果油树的解剖观察中偶见2个或3个胚珠,但比例很小,约占2%,在310个切片材料中有6个,其中1个胚珠能正常发育。这一特点在胡颓子科其他植物的观察研究中尚未见报道。其胚珠倒生,双珠被,厚珠心,大孢子母细胞减数分裂为线形排列的四分体,胚囊为单孢发生的蓼形胚囊发育方式。
与同属的羊奶果(刘育梅, 2003)的研究结果相比,二者的共同特征是:倒生胚珠、基生胎座、厚珠心、双珠被,蓼形胚囊,反足细胞退化早等。不同的是:羊奶果的小孢子四分体为“十字交叉型”,而翅果油树的小孢子四分体既有“十字交叉型”,又有“四面体型”及“左右对称型”。除此之外,羊奶果小孢子发育成3-细胞花粉,而翅果油树的成熟花粉为2-细胞花粉。这些特点可作为胡颓子属植物分类和系统研究的依据。
从雌、雄蕊发育的相关性来看,雄蕊分化发育早于雌蕊。在小孢子完成减数分裂Ⅰ期时,大孢子发生还只处于孢原细胞期。在发育后期,即在单核花粉至二胞花粉期,雌蕊的发育速度明显加快。开花当天,当雄蕊发育为成熟的2-细胞花粉时,胚囊则尚未发育成熟,胚囊的成熟还需要经过2~5 d的时间。推测授粉以后,大孢子可能会受到某种刺激作用加速其发育,从而以达到两者发育进程和谐。翅果油树雌雄蕊的发育早期是不同步的,即翅果油树有雄蕊先熟的现象。由于雌蕊发育滞后于雄蕊,这样能够最大限度地减少自花传粉,增强了后代的生活力。魏学智等(2007)在研究翅果油树传粉时指出,开花之前套袋其结实率为4.8%,而在自然条件下的结实率为25%,自花传粉率低的这一现象与本研究中的雌雄异熟减少自花传粉率相一致。
研究发现翅果油树雌、雄配子体发育过程中有部分小孢子有异常现象,但是其数量较少,因此对于传粉受精过程几乎没有影响。同时,在观察中发现翅果油树在二核胚囊、四核胚囊以及卵细胞形成时期均有胚囊细胞的退化现象,经过统计,开花当天胚囊细胞退化率约为9.09%。胚囊细胞的退化将会导致胚囊败育,推测这可能是翅果油树不能正常受精,“花多果少”的原因之一。对于此方面的原因还需作进一步的研究。
陈惠, 白新生. 1998. 翅果油树茎段愈伤组织和芽发生的组织学研究. 广西植物, 18(2): 157-159. |
狄维忠, 于兆英. 1989. 陕西省第一批国家珍稀濒危保护植物. 西安: 西北大学出版社, 81.
|
国务院. 1999. 国家重点保护野生植物名录(第一批). 植物杂志, (5): 38-41. |
李文钿, 朱彤. 1988. 中国沙棘花部形态学和胚胎学研究Ⅰ.雄花的形态发育. 林业科学, 24(3): 276-281. |
刘育梅.2003.羊奶果各显微结构、化学成分以及胚胎发育和固氮研究.厦门: 福建师范大学硕士学位论文. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y502845
|
马瑞君, 李常宝, 廉永善, 等. 1999. 四种沙棘雌花形态及发育研究. 云南植物研究, 21(3): 351-356. DOI:10.3969/j.issn.2095-0845.1999.03.011 |
马瑞君, 周爱玲, 王静, 等. 2000. 4种沙棘雄配子体发育的研究. 兰州大学学报:自然科学版, 36(2): 93-99. |
秦永燕, 张钦弟, 闫桂琴. 2006. 濒危植物翅果油树种群遗传多样性的RAPD分析. 分子植物育种, 4(6s): 31-36. |
上官铁梁, 张峰. 2001. 我国特有珍稀植物翅果油树濒危原因分析. 生态学报, 21(3): 502-505. DOI:10.3321/j.issn:1000-0933.2001.03.026 |
王太鑫, 廉永善, 陈学林. 2000. 中国沙棘的胚珠和胚囊发育过程. 沙棘, 13(2): 1-6. |
魏学智, 张悦正, 宋东亮. 2004. 国家二级保护植物翅果油树营养器官结构的研究. 植物研究, 24(3): 297-300. |
魏学智, 刘亚娟, 郭小虎, 等. 2007. 国家二级保护植物翅果油树传粉生物学的初步研究. 植物研究, 27(6): 753-757. DOI:10.3969/j.issn.1673-5102.2007.06.019 |
谢树莲, 凌元洁. 1997. 珍稀濒危植物翅果油树的生物学特性及其保护. 植物研究, 17(2): 153-157. |
闫桂琴, 张伟, 张艳芳, 等. 2003. 翅果油树脱毒试管苗的组织培养技术研究. 西北植物学报, 23(7): 1297-1303. DOI:10.3321/j.issn:1000-4025.2003.07.046 |
闫桂琴, 张俊彦, 李秀梅. 2004. 濒危植物翅果油树种群的叶绿素和硝酸还原酶活性的研究. 西北植物学报, 24(6): 1047-1051. DOI:10.3321/j.issn:1000-4025.2004.06.016 |
张峰, 上官铁梁. 2004. 翅果油树群落优势种群生态位分析. 西北植物学报, 24(1): 70-74. DOI:10.3321/j.issn:1000-4025.2004.01.013 |
张峰, 上官铁梁. 2000. 山西翅果油树群落种间关系的数量分析. 植物生态学报, 24(3): 351-355. DOI:10.3321/j.issn:1005-264X.2000.03.018 |
 2008, Vol. 44
2008, Vol. 44