文章信息
- 任士福, 王梅, 高志奎, 史保胜, 戈晓立.
- Ren Shifu, Wang Mei, Gao Zhikui, Shi Baosheng, Ge Xiaoli
- 温度对银杏光系统Ⅱ光抑制的影响
- Effects of Temperature on Photosystem Ⅱ Photoinhibition in Ginkgo
- 林业科学, 2008, 44(12): 28-34.
- Scientia Silvae Sinicae, 2008, 44(12): 28-34.
-
文章历史
- 收稿日期:2007-10-31
-
作者相关文章
银杏(Ginkgo biloba)是原产于中国的孑遗植物,集食用、药用、绿化、观赏、药材于一体的多功能树种。但与其他高等植物相比,生长缓慢。银杏喜温暖气候(贺立红等,2006),但是光合适温并不高(约20~26 ℃)(孟庆伟等,1995;郭志华等,1997)。银杏在生长季节中,不仅要度过高温强光的夏季,也会在春季特别是深秋遭遇冷凉强光的天气,还可能会在一天中历经上午和下午的冷凉强光与中午的高温强光。因此与强光相伴的炎热和冷凉对光合机构,特别是PSⅡ的光抑制影响有待进一步探讨。
光系统Ⅱ(PSⅡ)是位于类囊体膜上的高度组织的色素蛋白复合体,主要由反应中心复合体、捕光天线复合体和放氧复合体等亚单位组成,通过一系列光驱动电子传递最终使光能转化为化学能。光抑制是光化学量子产量下降的现象,主要与引起PSⅡ损伤的光破坏及防御光破坏的光保护有关(Long et al., 1994)。潘伟明等(2004)观察到夏季6—9月份受强烈光照和高温天气的影响,银杏的生长明显变慢。光合作用是植物干物质合成的基础。光合测试发现:银杏具有耐阴喜光忌强光的特性,超过光饱和点(约1 000 μmol·m-2s-1)的光强下,Pn明显下降(陶俊等,1999);在晴天中午发生光合“午休”现象与强光、高温、空气干燥有关(杨模华等,2004)。张往祥等(2002)采用叶绿素荧光动力学测试技术证实银杏光合“午休”现象与光系统Ⅱ(PSⅡ)光抑制有关。并对银杏光抑制程度和叶黄素循环各组分含量的关系,特别是和玉米黄质(Z)的关系,以及D蛋白周转与光抑制的关系进行研究(孟庆伟等,1999;张宁等,1999),同时提出夏季采用遮光、灌水(张往祥等,2002;景茂等,2005)或喷灌等措施减轻光抑制和光合午休程度,以期提高银杏的同化能力。目前高温强光对银杏的光合特性研究已有报道,但与强光相伴的炎热和冷凉对光合机构,特别是PSⅡ的光抑制影响及作用位点未见报道。
本研究以快速叶绿素荧光诱导动力学分析(JIP test)为手段,进行高低温处理下PSⅡ的光抑制研究,辨析冷热双向胁迫条件下银杏叶片PSⅡ中光抑制的作用位点及其保护机制,探寻能减轻光抑制和提高逆境光合能力的有效途径。
1 材料与方法 1.1 试验材料2007年5月在河北省林木良繁场以‘园铃’银杏为试材。选取树冠南侧生长势一致的新梢中部叶片测定田间连体5次重复光合光强响应。
2007年9月于河北农业大学标本园银杏苗圃选取健壮‘园铃’银杏植株向阳处的枝条,剪下带有7片叶子的枝条,浸泡于盛有清水的烧杯中,将其带回实验室,进行光强照射处理和不同温度处理,5次重复。
1.2 试验方法 1.2.1 银杏叶片光强照射处理选取银杏枝条上的第4~6片叶子,在光照培养箱中25 ℃下,用LED发光二极管白光光源分别在光强0,500,1 000,1 500,2 000,2 500,3 000 μmol·m-2s-1下,照射处理20 min后室温下黑暗处恢复1 h进行叶绿素荧光动力学曲线及其参数测定。
1.2.2 银杏叶片温度处理选取银杏枝条上的第4~6片叶子,置于光照培养箱中,分别在5、10、15、20、25、30、35、40和45 ℃的温度胁迫下,用光强PAR为1 000 μmol·m-2s-1的LED发光二极管白光光源照射处理20 min。处理后室温下黑暗处恢复1 h进行叶绿素荧光动力学曲线及其参数测定。
1.2.3 光合光强响应测定采用英国PP Systems公司CIRAS-2型便携式光合系统,在CO2浓度350 μL·L-1、温度25 ℃下,进行光合光强响应测定。叶温、光强及CO2浓度等均用该仪器自控系统控制。均为连体5次重复测定。测定部位为顶部第3~4片叶。光合光转化效率LCE是指净光合速率与入射光量的比值,即LCE=Pn/PARin。其中,LCE单位为molCO2·mol-1quanta,Pn单位为μmolCO2·(m2·s)-1,PARin单位为μmol·(m2·s)-1。
1.2.4 叶绿素荧光参数测定光强照射处理和不同温度处理后,采用英国Hansatech公司生产的植物效率仪(plant efficiency analyser,PEA,即连续激发式荧光仪或非调制式荧光仪),根据Strasser等(2000)方法进行叶绿素荧光诱导曲线及其参数的测定。具体步骤如下:叶片暗适应10 min后,用1 950 μmol·m-2s-1饱和红闪光照射1 s下以10 μs(2 ms之前)和1 ms(2 ms之后)的间隔记录荧光信号,测得叶绿素荧光诱导曲线及其参数Fo、Fm。
叶绿素荧光参数的计算参考Strasser等(2000)的计算方法。暗适应下PSⅡ最大光化学效率Fv/Fm=(Fm-Fo)/Fm。单位反应中心复合体吸收的能量ABS/RC=Mo/VJ/(Fv/Fm);单位反应中心以热能形式耗散的能量DIo/RC=ABS/RC-TRo/RC;单位反应中心复合体中被核心捕获的能量TRo/RC=Mo/VJ。单位面积的光合机构含有的反应中心数目RC/CSo=(Fv/Fm)×(VJ/Mo)×Fo。复合体吸收能量中活性反应中心的数目RC/ABS=[(1-(Fo/Fm))] / (Mo/VJ)。其中,荧光曲线的相对初始斜率Mo=4×(F300 μs-F50 μs)/(Fm-F50 μs);2 ms时可变荧光VJ=(F2 ms-F50 μs)/(Fm-F50 μs)。
2 结果与分析 2.1 光合光转化效率LCE的光强响应将测试的光合光强响应转化成光合光转化效率LCE的光强响应曲线发现,在光强约100 μmol·m-2s-1时银杏LCE最高,光强超过约1 000 μmol·m-2s-1时银杏LCE趋于最低(图 1)。
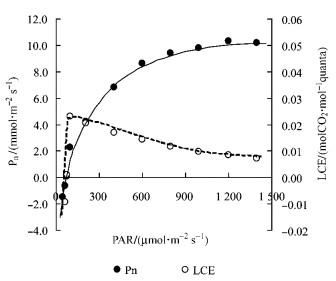
|
图 1 银杏叶片的光合光强响应曲线 Figure 1 Response curve of photosynthesis to light intensity in leaves of Ginkgo |
在常温25 ℃下,不同光强照射20 min后银杏叶片的快速叶绿素荧光诱导动力学曲线均呈现典型的O-J-I-P 4相型(图 2)。随着照射光强的增加(从500增至3 000 μmol·m-2s-1),O-J-I-P 4相均呈逐渐下降趋势,但是,2 000 μmol·m-2s-1以上的照射光强会使O-J-I-P 4相大幅度下降。
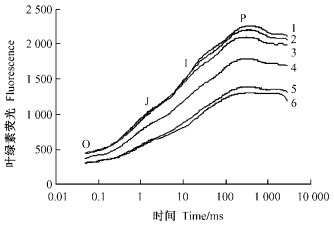
|
图 2 光强对银杏叶片快速荧光诱导曲线的影响 Figure 2 Effects of light intensity on curves of fast fluorescence transient in leaves of Ginkgo 1:500;2:1 000;3:1 500;4:2 000;5:2 500;6:3 000 μmol·m-2s-1 |
随着冷胁迫温度的降低和热胁迫温度的升高,快速叶绿素荧光诱导动力学曲线的J-I-P 3相呈现逐渐下降趋势(图 3);而O相在冷胁迫下升高,在热胁迫下降低。其中,J-I-P 3相以常温25 ℃最高,30和35 ℃其次,低温15~5 ℃和高温40~45 ℃依次降至最低(图 3)。
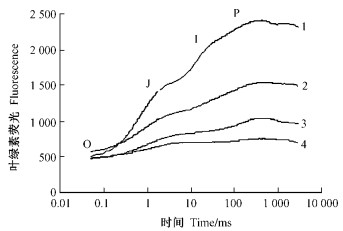
|
图 3 冷热胁迫对银杏叶片快速荧光诱导曲线的影响 Figure 3 Effects of chilling stress and heat stess on curves of fast fluorescence transient in leaves of Ginkgo 1:25 ℃;2:10 ℃;3:30 ℃;4:40 ℃ |
银杏叶片的PSⅡ最大光化学效率Fv/Fm,随着光强的增加呈现S型下降趋势(图 4)。与对照相比,2 000 μmol·m-2s-1的强光会使Fv/Fm值降低52.1%。
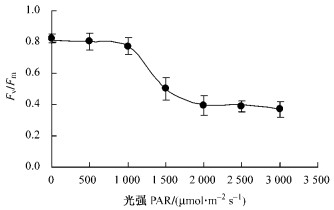
|
图 4 光强对银杏叶片Fv/Fm的影响 Figure 4 Effects of light intensity on Fv/Fm in leaves of Ginkgo |
随冷胁迫温度的降低,银杏叶片的PSⅡ最大光化学效率Fv/Fm明显下降,10 ℃时的Fv/Fm值比常温25 ℃时的降低了23.4%,5 ℃时降低40%(图 5)。随着热胁迫温度的增加,同样导致Fv/Fm值明显下降(图 5)。但是,热胁迫比冷胁迫的Fv/Fm更为严重下降,因为5~20 ℃下Fv/Fm的直线回归斜率为kcilling=0.015 4,而25~45 ℃下为kheat=-0.018 2,|kheat|比|kchilling|增大了15.4%。
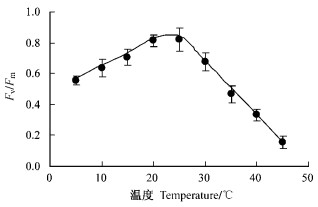
|
图 5 冷热胁迫对银杏叶片Fv/Fm的影响 Figure 5 Effects of chilling stress and heat stess on Fv/Fm in leaves of Ginkgo |
在Strasser等(2000)的能量流动模型参数中,当照射光强PAR超过1 000 μmol·m-2s-1时,银杏叶片单位反应中心复合体吸收的能量ABS/RC和单位反应中心以热能形式耗散的能量DIo/RC会急剧增加(图 6)。

|
图 6 光强对银杏叶片PSⅡ反应中心能流分配的影响 Figure 6 Effects of light intensity on specific energy fluxes of PSⅡ reaction centers in leaves of Ginkgo |
强光照射下PSⅡ反应中心能流分配状况受热胁迫影响较大(图 7)。与25 ℃相比,超过35 ℃的高温强光会引起ABS/RC和DIo/RC的急剧增加,而5~10 ℃的低温胁迫对ABS/RC和DIo/RC无明显影响。但是,TRo/RC受高温和低温胁迫的影响不明显。
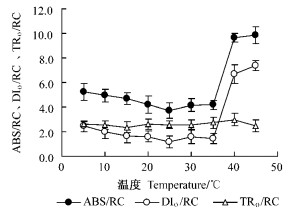
|
图 7 冷热胁迫对银杏叶片PSⅡ反应中心能流分配的影响 Figure 7 Effects of chilling stress and heat stess on specific energy fluxes of PSⅡ reaction centers in leaves of Ginkgo |
当照射光强从0增加至1 500 μmol·m-2s-1时,银杏叶片单位面积的光合机构含有的反应中心数目RC/CSo和PSⅡ复合体吸收的能量中活性反应中心的数目RC/ABS会明显下降;当光强超过1 500 μmol·m-2s-1时,RC/CSo和RC/ABS降至最低(图 8)。
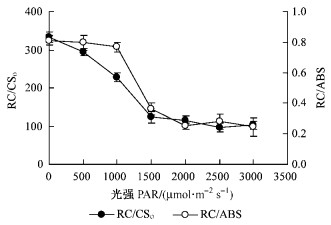
|
图 8 光强对银杏叶片PSⅡ反应中心数目的影响 Figure 8 Effects of light intensity on density of PS Ⅱ reaction centers in leaves of Ginkgo |
冷胁迫会降低PSⅡ反应中心数目,但是热胁迫会使之降低更多(图 9)。从图 9可见,与20 ℃相比,5~10 ℃下强光会使RC/CSo和RC/ABS明显下降,而35~45 ℃下强光会使之更严重下降。
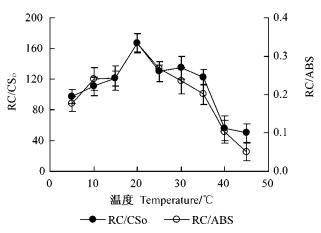
|
图 9 冷热胁迫对银杏叶片PSⅡ反应中心数目的影响 Figure 9 Effects of chilling stress and heat stess on density of PS Ⅱ reaction centers in leaves of Ginkgo |
从图 5和图 9可得知,冷热胁迫下强光引起的光抑制(Fv/Fm)与PSⅡ反应中心数目RC/CSo或RC/ABS与之间显著正相关(相关系数分别为0.972或0.807)。
3 讨论 3.1 银杏光抑制作用效果当植物光合机构吸收的光能超过光合作用所能利用的数量时,引起光合效率降低现象称为光抑制。研究者认为:光抑制不仅发生在强光下,有环境胁迫存在时中度光强就可引发光抑制(Robert et al., 1986)。离体试验证明:只要照光时间足够长,PSⅡ反应中心在弱光下依然会发生光抑制(Park et al., 1995)。而且当光抑制达到一定程度,就会发生植物光合器官的破坏即光破坏(主要是D1蛋白的净损失)。
用1 200 μmol·m-2s-1强光照射胁迫5 h,银杏叶片发生严重的光抑制(李新国等2004);夏季田间光照超过饱和光强(午间高达1 400~1 500 μmol·m-2s-1),导致银杏严重光抑制的发生(张往祥等,2002;孟庆伟等,1999)。高温强光(42 ℃,1 000 μmol·m-2s-1光照处理2 h,对照25 ℃)导致黄瓜(Cucumis)叶片的光合作用发生光抑制现象(孙艳等,2006)。低温增加冷敏感植物和抗冷植物发生光抑制的可能性(Hetherington et al., 1989)。Sonoike(1996)提出冷敏感植物低温光抑制的条件:(1)低温(0~10 ℃);(2)氧;(3)弱光(约100 μmol·m-2s-1);(4)相对长时间的低温处理(约5 h);(5)冷敏感植物(如黄瓜等);(6)从PS(光系统)发出的电子流正常。
本研究对光合光转化效率LCE的光强响应测试分析表明:在达到最大LCE之前的光强(100 μmol·m-2s-1)下,为光合机构快速启动过程;在光强100~1 000 μmol·m-2s-1范围内银杏LCE逐渐降低,为光合机构趋于满负荷运转过程;在光强超过约1 000 μmol·m-2s-1时银杏LCE趋于最低,进入较为严重的光抑制过程(图 1)。通过快速叶绿素荧光诱导动力学曲线及其参数Fv/Fm分析可见,在25 ℃常温下光强超过1 000 μmol·m-2s-1(照射20 min)时银杏光抑制程度明显加重(图 2和图 4)。因此,银杏光抑制呈现光强剂量效应。还发现银杏光抑制的温度剂量效应,15 ℃以下低温和35 ℃以上高温均会使Fv/Fm进一步降低(图 3和图 5);而且热胁迫比冷胁迫的光抑制程度更大,因为25~45 ℃下Fv/Fm的|kheat|比5~20 ℃下的|kcilling|增加15.4%。
3.2 冷热胁迫下银杏光抑制作用位点与保护机制的转移动态一般认为,光抑制主要发生在光系统Ⅱ(PSⅡ)(Krause et al., 1991)。光抑制可能是光合机构被光破坏(Powles, 1984)和能量耗散过程加强运转(Demmig et al., 1992)的共同结果,也可能仅仅是能量耗散过程加强运转的反映(汪炳良等,2004)。许大全(2002)指出:在没有其他严重环境胁迫的自然条件下,光抑制主要热耗散过剩光能从而保护光合机构免遭光破坏的过程;而光破坏的发生常常是强光与其他严重环境胁迫(如低温、干旱、营养亏缺等)共同作用的结果(郭连旺等,1996)。
热胁迫会导致PSⅡ结构和功能的一系列变化甚至损害(宋春雨等,2002)。热胁迫会引起类囊体膜的流动性增加导致PSⅡ蛋白复合体的稳定性降低、造成外周天线LHCⅡ与PSⅡ中心分离(Goltsev et al., 1987)、诱导PSⅡ活性中心转化为无活性中心(Cao J et al., 1990;温晓刚等,1996)、致使一些光合碳循环及活性氧清除酶系统被钝化、PSⅡ的供体侧(OEC)比受体侧更易受到伤害而发生放氧复合体失活(Guissé et al., 1995;Srivastava et al., 1997)、以及热耗散DIo/RC有大幅度的增加(王梅等,2007)。
高温强光处理比单独高温或单独强光的光抑制程度更为严重。非辐射能量(非光化学猝灭系数NPQ)消耗增加对防御光破坏起着重要的作用(徐凯等,2005)。高温或强光下出现过剩光能使叶黄素循环启动,但高温使强光下叶黄素循环明显受到抑制。
随着对光抑制和光保护机制研究的不断深入,低温光抑制的生化保护机制的研究主要集中在PSI和PSⅡ中叶黄素循环的保护作用(Demmig et al., 1992)、D1蛋白周转的保护作用(曾纪晴等,1997)、PSⅡ光抑制对PSI的保护作用(李新国等,2002)等方面。
低温导致黄瓜叶片严重的光抑制,同时类囊体膜不饱和脂肪酸含量下降(代玉华等,2004)。孙艳等(2006)观察到非辐射能量消耗增加(非光化学猝灭系数NPQ的升高)和叶黄素循环启动对黄瓜叶片防御高温强光(42 ℃,1 000 μmol·m-2s-1处理2 h,对照25 ℃)导致光破坏起着重要的作用。夏季晴天田间高温强光下,银杏叶片天线热耗散和叶黄素循环引起的非辐射能量耗散增加、D1蛋白的可逆失活与快速周转或PSⅡ反应中心可逆失活是避免强光损伤的保护性反应。
本研究中,与冷胁迫光抑制相比,热胁迫光抑制下会显著加强银杏叶片PSⅡ能量耗散运转过程,这与热胁迫下PSⅡ反应中心数目降低更多有关。通过Strasse的能量流动模型参数分析可见,5~10 ℃的低温强光引起银杏叶片热耗散DIo/RC略微增加,而35 ℃以上的高温强光会热耗散DIo/RC剧增(图 8)。同时可见冷胁迫会降低PSⅡ反应中心数目,但是热胁迫会使之降低更多(图 7)。据此推测,热胁迫下在PSⅡ蛋白复合体的电子传递过程中,由于PSⅡ反应中心可逆失活(即PSⅡ的异质性)(温晓刚等,1996)会阻止被天线色素吸收的能量向下游传递,被PSⅡ反应中心捕获的电子流TRo/RC变化不明显(图 7),致使剧增的单位“有活性反应中心”复合体吸收的能量ABS/RC(图 7)必须以热能形式耗散掉。因此,热胁迫下造成PSⅡ“有活性反应中心”减少,进而导致能量耗散过程运转加强,表现出热胁迫光抑制加重;同时,PSⅡ的这种异质性(PSⅡ反应中心的可逆失活)亦是热胁迫下光合机构发生光抑制的保护机制。
尽管冷胁迫光抑制不如热胁迫光抑制严重(图 5),而且冷胁迫下PSⅡ反应中心数目降低不如热胁迫的严重,可是冷胁迫下Fv/Fm的降低趋势与PSⅡ反应中心数目的降低趋势相近(图 5和图 9)。PSⅡ的这种异质性(PSⅡ反应中心的可逆失活)亦是冷胁迫下光合机构发生光抑制的保护机制。但是冷胁迫下热耗散DIo/RC的增加趋势不明显。过剩光能耗散可能与活性氧清除系统运转加强有关,也可能与低温环境下有助于叶片的热传导和热幅射散热有关。该方面有待深入研究。
无论是热胁迫还是冷胁迫,银杏快速荧光诱导动力学曲线仍然呈现OJIP型,均未出现与放氧复合体失活有关的K相。因此推测高温强光未对银杏的PSⅡ供体侧(OEC)产生明显影响;也推测涉及到低温强光下可能活性氧清除系统对PSI保护发挥着一定的作用,该方面尚需深入研究。
代玉华, 刘训言, 孟庆伟, 等. 2004. 低温弱光处理及恢复期间黄瓜叶片的光抑制与类囊体膜中脂肪酸组成的变化. 植物生理学通讯, 40(1): 14-18. |
郭连旺, 许大全, 沈允钢. 1996. 田间小麦无D1蛋白净损失条件下的光抑制. 植物学报, 38: 196-202. |
郭志华, 张宏达. 1997. 庐山银杏光合作用的研究. 生态科学, 16(1): 30-33. |
贺立红, 贺立静, 梁红. 2006. 银杏不同品种叶绿素荧光参数的比较. 华南农业大学学报, 27(4): 43-46. DOI:10.3969/j.issn.1001-411X.2006.04.012 |
景茂, 曹福亮, 汪贵斌, 等. 2005. 土壤水分含量对银杏光合特性的影响. 南京林业大学学报:自然科学版, 29(4): 83-86. |
李新国, 段伟, 孟庆伟, 等. 2002. PSI的低温光抑制. 植物生理学通讯, 38(4): 375-381. |
李新国, 孟庆伟, 赵世杰. 2004. 强光胁迫下银杏叶片的光抑制及其防御机制. 林业科学, 40(3): 56-59. DOI:10.3321/j.issn:1001-7488.2004.03.009 |
孟庆伟, 王春霞, 赵世杰, 等. 1995. 银杏光合特性的研究. 林业科学, 31(1): 69-71. |
孟庆伟, EngelbertWeis, 邹琦, 等. 1999. 银杏叶片的光抑制和光保护机制:温度、CO2和O2的影响. 植物学报, 41(4): 398-404. |
潘伟明, 李华军, 许凤英, 等. 2004. 银杏夏季生长光温条件的初步研究. 农业与技术, 24(1): 67-70. DOI:10.3969/j.issn.1671-962X.2004.01.022 |
孙艳, 徐伟君, 范爱丽. 2006. 高温强光下水杨酸对黄瓜叶片叶绿素荧光和叶黄素循环的影响. 应用生态学报, 17(3): 399-402. DOI:10.3321/j.issn:1001-9332.2006.03.009 |
宋春雨, 刘晓冰, 金彩霞. 2002. 高温胁迫下光合器官受损及其适应机理. 农业系统科学与综合研究, 18(4): 252-256. DOI:10.3969/j.issn.1001-0068.2002.04.004 |
陶俊, 陈鹏, 佘旭东. 1999. 银杏光合特性的研究. 园艺学报, 26(3): 157-160. DOI:10.3321/j.issn:0513-353X.1999.03.004 |
王梅, 高志奎, 黄瑞虹, 等. 2007. 茄子光系统Ⅱ的热胁特性研究. 应用生态学报, 18(1): 63-68. DOI:10.3321/j.issn:1001-9332.2007.01.011 |
汪炳良, 徐敏史, 庆华. 2004. 高温胁迫对早熟花椰菜叶片抗氧化系统和叶绿素及其荧光参数的影响. 中国农业科学, 37(8): 1245-1250. DOI:10.3321/j.issn:0578-1752.2004.08.029 |
温晓刚, 林世青, 匡延云. 1996. 高温胁迫对光系统Ⅱ异质性的影响. 生物物理学报, 12(4): 714-718. |
徐凯, 郭延平, 张上隆. 2005. 草莓叶片光合作用对强光响应机理的研究. 应用生态学报, 16(1): 73-78. DOI:10.3321/j.issn:1001-9332.2005.01.015 |
许大全. 2002. 光合作用效率. 上海: 上海科学技术出版社, 126-161.
|
杨模华, 李志辉, 黄丽群, 等. 2004. 银杏光合特性的日变化. 经济林研究, 22(4): 15-21. DOI:10.3969/j.issn.1003-8981.2004.04.005 |
张往祥, 吴家胜, 曹福亮. 2002. 光强对银杏光合作用和光化学效率的影响. 南京林业大学学报:自然科学版, 26(6): 5-9. |
张宁, 孟庆伟, 赵世杰, 等. 1999. 光胁迫下银杏光合作用的光抑制. 西北植物学报, 19(3): 461-465. |
张往祥, 曹福亮. 2002. 高温期间水分对银杏光合作用和光化学效率的影响. 林业科学研究, 15(6): 672-679. DOI:10.3321/j.issn:1001-1498.2002.06.007 |
曾纪晴, 刘鸿先, 王以柔, 等. 1997. 黄瓜幼苗子叶在低温下的光抑制及其恢复. 植物生理学报, 23: 15-20. DOI:10.3321/j.issn:1671-3877.1997.01.003 |
Cao J, Govindjee. 1990. Chlorophy Ⅱ a fluorescence transient as an indicator of active and inactive photosystem Ⅱ in thylakoid membranes. Biochem Biophysiol Acta, 10(15): 180-188. |
Demmig-Adams B, Adams W W. 1992. Photoprotection and other responses of plants to high light stress. Annu Rev Plant Physiol Plant Mol Biol, 43: 599-605. DOI:10.1146/annurev.pp.43.060192.003123 |
Goltsev V, Yordanov I, Stoyanova, et al. 1987. High temperature damage and acclimation of the photosynthetic apparatus Ⅱ. Effect of mono and divalent cations and pH on the temperature sensitivity of some functional characteristics of chloroplasts isolated from heat acclimated and non-acclimated bean plants. Planta, (170): 478-488. |
Guissé B, Srivastava A, Strasser R J. 1995. The polyphasic rise of the chlorophy Ⅱ a fluorescence (O-K-J-I-P) in heat-stressed leaves. Archs Sci Genève, 48: 147-160. |
Hetherington S E, He J, Smillie R M. 1989. Photoinhibition at low temperature in chilling susceptible and resistant plants. Plant Physiol, 90: 1609-1615. DOI:10.1104/pp.90.4.1609 |
Krause G H, Weis E. 1991. Chlorophy Ⅱ fluorescence and photosynthesis. Ann Rev Plant Physiol Plant Mol Biol, 42: 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |
Park Y I, Chow W S, Anderson J M. 1995. Light inactivation of functional photosystem Ⅱ in leaves of pears grown in moderate light depends on photon exposure. Planta, 196: 401-411. |
Powles S B. 1984. Photoinhibition of photosynthesis induced by visible light. Annu Rev Plant Physiol, 35: 15-44. DOI:10.1146/annurev.pp.35.060184.000311 |
Robert E S, John S B. 1986. Photosynthesis at low water potentials in Sunflower: lack of photoinhibitory effects. Plant Physiol, 82: 90-95. DOI:10.1104/pp.82.1.90 |
Strasser R J, Tsimilli-Michael M, Srivastava A. 2000. The fluorescence transient as a tool to characterise and screen photosynthetic samples//Yunus M, Pathre U, Mohanty E. Probing Photosynthesis: Mechanisms, Regulation and Adaptation. London: Taylor & Francis, 25: 445-483.
|
Srivastava A, Guisse B, Greppin H, et al. 1997. Regulation of antenna structure and electr on transport in PS Ⅱ of Pisum sativum under elevated temperature probed by the fast polyphasic chlorophy Ⅱ. a fluorescence transient OKJIP. Biochim Biophys Acta, 1320: 95-106. DOI:10.1016/S0005-2728(97)00017-0 |
Sonoike K. 1996. Photoinhibition of photosystem Ⅰ. Its physiological significance in the chilling sensitivity of plants. Plant Cell Physiol, 37: 239-247. DOI:10.1093/oxfordjournals.pcp.a028938 |
 2008, Vol. 44
2008, Vol. 44
