文章信息
- 李琰, 崔宏安, 冯俊涛, 丁虹茹, 易晓华, 张兴.
- Li Yan, Cui Hong'an, Feng Juntao, Ding Hongru, Yi Xiaohua, Zhang Xing
- 雷公藤体细胞胚发生及其植株再生
- Somatic Embryogenesis and Plantlet Regeneration of Tripterygium wilfordii
- 林业科学, 2008, 44(10): 148-152.
- Scientia Silvae Sinicae, 2008, 44(10): 148-152.
-
文章历史
- 收稿日期:2007-11-23
-
作者相关文章
2. 西北农林科技大学生命科学学院 杨凌 712100
2. College of Life Science, Northwest A & F University Yangling 712100
雷公藤(Tripterygium wilfordii)系卫矛科(Celastraceae)雷公藤属植物,在我国很早以前就用于医学和害虫防治,是生产无公害农药的宝贵资源之一(李琰等,2008;夏焱等,2005;陈同素,1933)。雷公藤的活性成分主要存在于根部(杨春欣等,2001),但其属多年生木质藤本,生长较慢,人工栽培极少,因而人们对野生资源大量盲目采挖,使资源遭到严重破坏。目前对雷公藤的研究主要集中在有效成分分离鉴定、开发利用等方面(Jun et al., 2007;Canter et al., 2006;周琳等,2006),未见到关于组培快繁及体细胞胚诱导方面的报道。本文研究了基本培养基及植物生长调节剂组合等对雷公藤体细胞胚发生及其植株再生的影响及体细胞胚的发生组织学,以期建立一个稳定的雷公藤再生体系,为进一步通过基因工程改良雷公藤的性状奠定基础。
1 材料与方法 1.1 试验材料愈伤组织获得:从福建省泰宁地区采集生长良好的雷公藤单株1年生枝条,第2年春季扦插于杨凌温室苗床上。新长出的幼茎高度达5 cm时,嫩叶、幼茎及根用洗洁精洗涤并用自来水反复清洗后,流水冲洗2 h,70%酒精消毒20 s,无菌水冲洗4次,1 g·L-1 HgCl2消毒4 min,无菌水冲洗4次。幼茎及根切成0.7 cm左右小段,叶切成0.5 cm×0.5 cm方块,接种在MS+1.0 mg·L-1 2,4-D+0.5 mg·L-1 KT培养基上,30 d后形成愈伤组织。愈伤组织在同样培养基上连续继代5次,形成的各种愈伤组织备用。研究愈伤组织类型对雷公藤植株再生的影响时采用根、茎和叶3种来源的愈伤组织,其余试验材料均为绿色致密型愈伤组织。
1.2 试验方法1) 不同类型愈伤组织对植株再生的影响 以MS为基本培养基添加0.1 mg·L-1 NAA+1.0 mg·L-1 6-BA,研究不同类型愈伤组织对植株再生的影响。2)植物生长调节剂浓度筛选以MS为基本培养基添加不同浓度2,4-D、NAA以及与6-BA、KT组合,确定雷公藤愈伤组织植株再生的最佳植物生长调节剂组合。3)相同比例不同水平6-BA /NAA及活性炭对愈伤组织植株再生的影响以MS为基本培养基添加相同比例不同水平6-BA /NAA及活性炭,确定相同比例不同水平6-BA /NAA及活性炭对雷公藤愈伤组织植株再生的最佳组合。4)培养基筛选选用MS、B5、H、1/2MS(大量元素减半)、6,7-Ⅴ、White为基本培养基,添加0.1 mg·L-1 NAA+1.0 mg·L-1 6-BA,确定雷公藤愈伤组织植株再生的最佳培养基。5)雷公藤愈伤组织对卡那霉素(Km)敏感性试验以MS+0.1 mg·L-1 NAA+1.0 mg·L-1 6-BA,添加不同浓度Km确定雷公藤愈伤组织抗Km的临界浓度。6)体细胞胚发生的组织学观察将不同分化时期的愈伤组织用FAA固定液固定,常规石蜡切片,番红-固绿染色,显微镜观察并照相。
上述试验所用培养基,加入蔗糖30 g·L-1,用琼脂7 g·L-1固化,pH调至5.8,每个处理接种30瓶,每瓶接种3块外植体。在温度(25±2)℃,光照12 h·d-1,光照强度为1 000~1 500 lx的培养室培养30 d后,调查发芽愈伤组织块数、每块愈伤组织平均形成芽个数,并计算分化率。
2 结果与分析 2.1 愈伤组织类型对植株再生的影响雷公藤不同外植体诱导的愈伤组织经过继代培养多次以后,愈伤组织类型有3种(表 1):一是灰白色质地疏松型(主要为根来源的愈伤组织,图版Ⅰ-1),二是乳白色致密型(主要为茎来源的愈伤组织,图版Ⅰ-2),三是绿色致密型(主要为叶来源的愈伤组织,图版Ⅰ-3)。在添加了0.1 mg·L-1 NAA+1.0 mg·L-1 6-BA的MS培养基上,叶来源的愈伤组织分化率最高,接近100%(表 1),且每块愈伤组织平均形成的芽个数也比较多,小苗生长健壮,叶色深绿。其次为茎来源的愈伤组织,愈伤组织增殖膨大后开始逐渐变绿,出现芽点(图版Ⅰ-9),分化率达82%。而疏松的根愈伤组织分化率较差,愈伤增殖膨大后,开始褐化,个别愈伤组织分化出芽,小苗生长缓慢,细弱,黄化,分化率仅为31%。
|
|

|
图版Ⅰ 李琰等:雷公藤体细胞胚发生及其植株再生 Plate Ⅰ Li Yan et al.:Somatic embryogenesis and plantlet regeneration of Tripterygium wilfordii 1.灰白色疏松型愈伤组织;2.白色致密型愈伤组织;3.绿色致密型愈伤组织;4.胚性细胞;5.八细胞原胚;6.球形胚;7.心形胚;8.鱼雷形胚;9.萌芽的体胚;10.新长出的幼芽;11.芽苗形成;12.形成完整植株。 1. Offwhite loose callus: 2. Whitc compact callus: 3. Green compact callus; 4. Embryogenic cells; 5. Kight-cdl sotnauc embryo: 6. UlobuKur somatic embryo; 7. Heart-shaped smatic embryo; 8. Torpedo stage; 9.Budding embryo; 10. New groun germ; 11. Plantlet formaation; 12. Complete plantlet. |
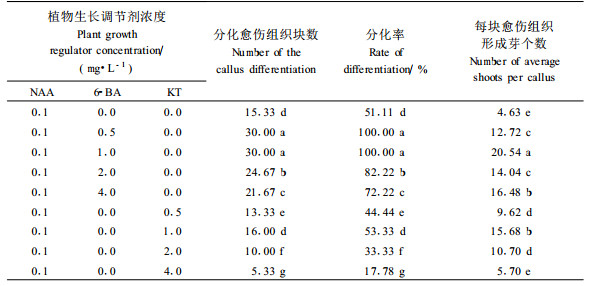
1) 2,4-D和NAA对愈伤组织植株再生的影响 不同生长素及其浓度,对愈伤组织植株再生的影响差异较大(表 2)。在不添加植物生长调节剂的培养基上,没有芽的分化,愈伤组织逐渐褐化,枯死。NAA浓度在0.05~1.0 mg·L-1时,愈伤组织膨大明显,生长后期有芽点出现,小苗生长较弱,分化率随浓度增加而降低;每块愈伤组织平均形成芽数也随NAA浓度的增加而下降,其中以NAA 0.1 mg·L-1时愈伤组织分化率最高,形成芽数最多,但小苗生长较弱,部分逐渐枯死。加入不同浓度的2,4-D后,愈伤组织的分化率均比较低,每块愈伤组织分化形成的芽数也比较少,浓度在0.5~1.0 mg·L-1时,愈伤膨大明显,是刚接种的数十倍左右,但分化的芽数较少。
|
|
2) NAA与6-BA、KT配合使用对愈伤组织植株再生的影响 如表 3所示,加入6-BA后,愈伤组织分化率可达100%。当6-BA为1.0 mg·L-1时,不仅每块愈伤组织平均形成芽个数较多,且小苗生长健壮。随着6-BA浓度的增加虽然分化率和芽数变化不大,但小苗的生长受到了抑制。当6-BA /NAA浓度比为10左右时较有利于雷公藤愈伤组织植株再生。与对照相比,加入KT,愈伤组织分化率明显降低,平均形成芽数随浓度增加而降低;KT浓度大于2.0 mg·L-1时,愈伤组织分化率明显下降。
|
|
如表 4所示,当6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1时,愈伤组织分化出芽率最高,达到100%,且分化出的小苗生长较好。随着植物生长调节剂浓度的加大分化率明显下降,当6-BA 10 mg·L-1+NAA 1.0 mg·L-1时,不仅分化率下降到了41%,形成芽数减少,而且分化出来的小苗逐渐黄化枯死。
|
|
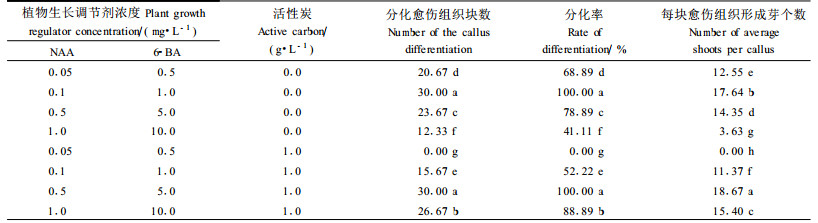
活性炭加入培养基中的目的主要是利用其吸附能力,减少一些有害物质的影响,例如可以防止酚类物质污染而引起的组织褐化死亡,其对形态发生和器官形成也有良好的效应。本试验中,当同样培养基中加入1 g·L-1活性炭后,6-BA 5.0 mg·L-1+NAA 0.5 mg·L-1时,愈伤组织分化率及小苗生长情况才与不加活性炭的6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1时相当,6-BA/NAA浓度较低时明显抑制愈伤组织的分化,分析其原因可能是因为活性炭有较强的吸附能力,吸附了培养基中的大量植物生长调节剂所致。加入活性炭的培养基小苗分化形成后,生根较不加活性炭早5~7 d,形成根的数量也明显增多,小苗生长比较健壮。
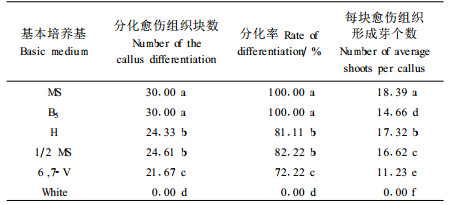
2.4 基本培养基对愈伤组织植株再生的影响在加相同外源植物生长调节剂的条件下,比较了6种基本培养基对愈伤组织分化的影响,结果(表 5)表明,在高盐和中等无机盐的培养基上愈伤组织的分化率均达80%以上,但分化植株的生长情况差异较大。在高盐的MS和高硝酸盐的B5培养基上分化出的小苗生长较好,在MS培养基上小苗在后期还有生根现象;中等无机盐的H、1/2MS上虽然分化率较高,但小苗在后期开始出现黄化,长势较弱;6,7-Ⅴ培养基上不仅分化率和每块愈伤组织的成苗数下降,而且对小苗的生长也不利;低盐的White培养基上愈伤组织稍有膨大后,便逐渐枯死,无小苗生成。
|
|
根获得的愈伤组织经过几代培养后质地疏松(图版Ⅰ-1),其细胞大多为薄壁组织,体积大,排列疏松,内部为大液泡所占据。茎和叶产生的愈伤组织经过多代培养后在其内部出现细胞较小、排列紧密的胚性细胞(图版Ⅰ-4)。胚性细胞细胞质浓、细胞核明显,每个细胞继续横分裂形成二细胞胚,其中基细胞连续多次横向分裂后形成胚柄(图版Ⅰ-6)。顶细胞经过2次相互垂直的纵向分裂后再进行1次横向分裂形成八细胞原胚(图版Ⅰ-5)。随着原胚的细胞分裂,胚体进行多次的各个方向分裂逐渐增大为球形原胚(图版Ⅰ-6)。以后球形胚顶端两侧分裂生长较快,形成2个突起,即子叶原基,经过初步分化形成心形原胚(图版Ⅰ-7)。心形胚继续培养后,子叶原基进一步生长,形成鱼雷形胚(图版Ⅰ-8),胚芽逐渐生长,形成幼芽(图版Ⅰ-9),幼芽逐渐生长变绿(图版Ⅰ-10),基部细胞形成胚根的一部分逐渐发育形成成熟而完整的胚体。继续培养体胚呈现明显的发育状态,由淡黄色逐渐转为浅绿色(图版Ⅰ-11)。萌发的体胚在发育培养基上继续培养20 d后,几乎都能萌发成完整植株(图版Ⅰ-12)。
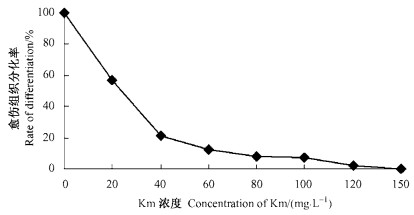
2.6 雷公藤愈伤组织对卡那霉素(Km)敏感性试验在遗传转化中,Km往往作为抗性标记构建载体,转化成功的植株有抗Km基因的表达,能够在Km较大的浓度下生长,而未转化的植株则受到Km的抑制而死亡。通过Km对雷公藤愈伤组织分化的影响试验,研究雷公藤愈伤组织抗Km的临界浓度,主要用于转基因植株的筛选。在含不同Km浓度的愈伤组织再生培养基MS+0.1 mg·L-1NAA+1.0 mg·L-1 6-BA上,随着Km浓度的增加,分化率呈急剧下降趋势(图 1)。当Km浓度达120 mg·L-1时,愈伤组织的诱导率仅为2.15%,而且随着Km浓度的增加,分化出的小苗黄化程度也逐渐加深。当Km浓度超过80 mg·L-1时,分化出的小苗叶为浅黄色,逐渐全部枯死。而未加Km的愈伤组织分化出来的植株小苗生长健壮,叶色浓绿,因此本试验的Km浓度为80 mg·L-1,可以有效地筛选出雷公藤转基因植株。
|
图 1 Km浓度对雷公藤愈伤组织分化的影响 Figure 1 The effect of Km on callus differentiation |
组织培养中,不同植物生长发育所需要的无机离子、有机营养物质等各不相同,应根据培养材料和培养目的选择一种适宜的培养基。有研究表明,培养基中较高的渗透势(张万军等,2002)、高的总氮含量和较高比例的还原态氮(韩晓玲等,2006;Moyer et al., 1984;Ammirato,1989)对体细胞胚胎发生和发育有重要的促进作用。本试验在高渗、高氮含量、高比例铵态氮的MS以及B5培养基上得到了类似的结果,但这类培养基却不利于雷公藤愈伤组织的生长,而在低铵态氮、高硝态氮培养基上生长较好。
植物生长调节剂是影响愈伤组织分化最重要的因素之一。一般高浓度的生长素和低浓度的细胞分裂素有利于愈伤组织的诱导和增殖,高浓度细胞分裂素和低浓度生长素有利于愈伤组织的芽分化(姜蕾等,2006)。本试验对雷公藤愈伤组织体细胞胚胎发生的研究表明,2,4-D对雷公藤愈伤组织诱导是必需的,但愈伤组织形成后,若不及时去掉2,4-D,胚性愈伤组织就不能正常发生,这与在枸杞(Lycium barbarum)体细胞胚发生的研究中得出的结论一致(崔凯荣等,1998)。Lightbourn等(1990)和夏时云等(2006)在红掌(Anthurium andraeanum)体细胞胚再生的研究中发现,6-BA是影响愈伤组织芽分化最重要的植物生长调节剂,本研究也得出了类似的结果,加入6-BA后,愈伤组织分化率达100%,且形成芽苗数也比较多。也有人认为,6-BA对幼胚的发育起阻碍作用,在含有6-BA的培养基上,难以发生体细胞胚(Jap-Allemand et al., 1991;Kornova et al., 1993)。本试验中加入KT,愈伤组织分化率明显降低,每块愈伤组织平均形成芽数也随浓度增加而减少。而在苜蓿(Medicago sativa)体细胞胚诱导中,加入2,4-D与6-BA或KT均可诱导体细胞胚发生(王玉民等,2005;孟庆玉等,2003)。可见对不同植物,不定芽的诱导、增殖需要不同的植物生长调节剂组合,其机理有待于进一步研究。
陈同素. 1933. 国产杀虫药剂雷公藤调查报告. 中华农学会报, 125: 79-82. |
崔凯荣, 任红旭, 邢更妹, 等. 1998. 枸杞组织培养中抗氧化酶活性与体细胞胚发生相关性研究. 兰州大学学报:自然科学版, 34(3): 93-99. |
韩晓玲, 王冰雪, 林雪, 等. 2006. 小冠花高效体细胞胚胎发生与植株再生的研究. 西北大学学报:自然科学版, 3(3): 420-423. |
姜蕾, 兰天维, 黎扬辉, 等. 2006. 影响红掌愈伤组织诱导、增殖和芽分化的因素. 种子, 25(11): 26-30. |
李琰, 冯俊涛, 王永宏, 等. 2008. 雷公藤愈伤组织诱导及杀虫活性研究. 西北农林科技大学学报:自然科学版, 36(5): 103-108. |
孟庆玉, 王冬梅, 曹艳艳, 等. 2003. 新疆彩色棉体细胞胚状体的发生及植株再生. 中国棉花, 30(12): 8-9. DOI:10.3969/j.issn.1000-632X.2003.12.003 |
王玉民, 刘艳芝, 夏彤, 等. 2005. 苜蓿子叶体细胞胚的诱导和植株再生. 草地学报, 13(1): 79-81. |
夏时云, 麦瑜玲, 许继勇, 等. 2006. 红掌叶片离体培养过程中内源激素含量的变化. 华北农学报, 21(3): 16-18. DOI:10.3321/j.issn:1000-7091.2006.03.005 |
夏焱, 段宏泉, 张铁军, 等. 2005. 雷公藤属药用植物的研究进展. 中草药, 36(7): 1093-1096. DOI:10.3321/j.issn:0253-2670.2005.07.052 |
杨春欣, 周庭川. 2001. 雷公藤内酯醇不同季节的含量变化. 中国医院药学杂志, 21(1): 25-26. DOI:10.3321/j.issn:1001-5213.2001.01.012 |
张万军, 王涛. 2002. 紫花苜蓿愈伤成苗高频再生体系的建立及其影响因子的研究. 中国农业科学, 35(12): 157-158. |
周琳, 马志卿, 冯俊涛, 等. 2006. 雷公藤生物碱制品对小菜蛾和菜青虫的控制效果. 西北农林科技大学学报:自然科学版, 34(12): 169-173. |
Ammirato P V. 1989. Progress in somatic embryogenesis. News Letter of International Association for Plant Tissue Culture, 57: 2-16. |
Canter P H, Lee H S, Ernst E. 2006. A systematic review of randomised clinical trials of Tripterygium wilfordii for rheumatoid arthritis. Phytomedicine, 13(5): 371-378. DOI:10.1016/j.phymed.2006.01.010 |
Jap-Allemand C, Jouanin L, Deng M D, et al. 1991. Transfer of chalcone synthase antisense gene:new strategy for studying polyphenols involved in walnut rhizogenesis. Plant Sci Today, 59: 305. |
Jun M, Moul D, Hui Y, et al. 2007. Anti-inflammatory and immunosuppressive compounds from Tripterygium wilfordii. Phytochemistry, 68: 1172-1178. DOI:10.1016/j.phytochem.2007.02.021 |
Kornova K, Stephanova A, Terzijsky D. 1993. In vitro culture of immature embryos and cotyledons of Juglans regia L:morphological and anatomical analyses of some regenerants. Acta Hort, 311: 125-133. |
Lightbourn G J, Deviprasad P V. 1990. In vitro techniques for rapid multiplicati on of four varieties of Anthrium andraeanum in Jamaica. Proceedings of the Interamerican Society for Tropical Horticulture, 34: 3-5. |
Moyer B G, Gustine D L. 1984. Regeneration of Coronilla varia L(crownvetch) plans from callus culture. Plant Cell Tissue Organ Culture, 3: 143-148. DOI:10.1007/BF00033735 |
 2008, Vol. 44
2008, Vol. 44