文章信息
- 彭梅芳, 阳义健, 杨春贤, 陈敏, 廖志华.
- Peng Meifang, Yang Yijian, Yang Chunxian, Chen Min, Liao Zhihua
- 银杏IspF基因的克隆与功能分析
- Cloning and Functional Analysis of a New IspF Gene from Ginkgo biloba
- 林业科学, 2008, 44(10): 49-54.
- Scientia Silvae Sinicae, 2008, 44(10): 49-54.
-
文章历史
- 收稿日期:2007-12-12
-
作者相关文章
2. 西南大学药学院 重庆 400715
2. College of Pharmaceutical Sciences, Southwest University Chongqing 400715
银杏(Ginkgo biloba)是著名的孑遗植物,含有多种药用活性成分,主要包括银杏内酯和黄酮类(Gong et al., 2005)。其中银杏内酯是目前最好的血小板活化因子受体的天然专一拮抗剂,广泛应用于治疗心血管疾病(Kim et al., 2006a)。银杏内酯在天然银杏中含量很低,我国出产的优质银杏干叶中仅为0.06%(Van Beek et al., 1991),但市场需求巨大,使得其价格居高不下,高达20万美元·kg-1(韩金玉等, 2000)。近年来,寻找和扩大银杏内酯药源研究十分活跃,包括:1)银杏内酯化学全合成(Crimmins et al., 2000);2)银杏组织培养(Laurain et al., 1997)及毛状根的诱导(Ayadi et al., 2003);3)利用基因工程技术遗传改良银杏,开展银杏内酯代谢工程研究。而开展银杏内酯代谢工程的前提是阐明其生物合成的分子机制,即分离该途径上多个酶促反应步骤的基因,进行功能验证和表达研究,考察目的基因在银杏内酯生物合成途径中的作用,为银杏内酯的代谢工程提供候选基因和作用靶点。银杏内酯属于萜类化合物,由萜类物质共用5碳前体异戊烯基焦磷酸(isopentenyl diphosphate,IPP)和它的异构物二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)(Maruyama et al., 1967)为骨架合成。主要是以来源于三羧酸循环的丙酮酸(pyruvate)和3-磷酸甘油醛(glyceraldehyde 3-phosphate,G3P)为底物,经过定位于质体的MEP途径(Eisenreich et al., 2001; Schwarz, 1994)合成IPP和DMAPP,二者再经一系列羟化和酰化等酶促反应最终合成银杏内酯(图 1)。IspF是MEP途径中的第5个酶,是银杏内酯生物合成途径中的关键酶,也可能是其次生代谢工程的重要靶点。本研究采用RACE技术克隆银杏IspF基因全长cDNA,并对其进行相关生物信息学分析、组织表达谱分析和对该基因进行功能验证,为最终实现银杏内酯的代谢工程提供候选基因和作用靶点。
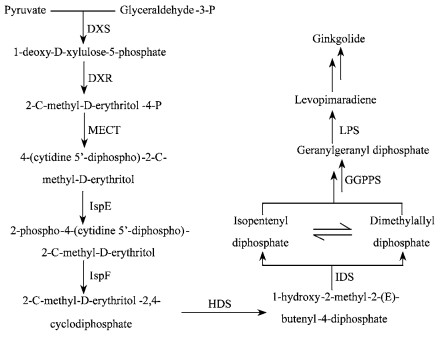
|
图 1 由MEP途径提供前体物质的银杏内酯生物合成途径 Figure 1 Ginkgolide biosynthesis through the MEP pathway |
银杏种植于西南大学校园(重庆北碚)。3月中旬采集幼叶,8月中旬采集同株的根、茎、果,经液氮速冻后贮藏于-70 ℃冰箱中备用。pAC-BETA和pTrcAtIPI质粒、大肠杆菌XL1-Blue由西南大学生命科学学院天然产物与代谢工程实验室保存。
1.2 方法 1.2.1 银杏总RNA的提取取-70 ℃冰箱中保存的银杏幼叶、根、茎、果各0.1 g,用RNAplant试剂盒(天为时代,北京)分别提取总RNA,存于-70 ℃冰箱备用。
1.2.2 GbIspF核心片段的获得GbIspF核心片段特异性引物根据同源序列设计,正向引物df GbIspF:5′-ATGGCTGCCGCATTCTCTGC-3′,反向引物dr GbIspF:5′-TCACTTCTTCATCAAAAGTACAATTG-3′。cDNA第一链合成使用TaKaRa RNA PCR Kit(AMV),按照试剂盒操作手册合成cDNA链。以cDNA为模板进行PCR扩增,反应条件为:94 ℃预变性5 min;94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸1 min,共30个循环;最后72 ℃总延伸10 min。PCR产物纯化按照上海赛百盛基因技术有限公司的PCR产物纯化试剂盒说明操作,将回收产物与pMD18-T连接后转化DH5α,进行蓝白斑筛选,挑取白斑进行菌落PCR检测,阳性克隆送至上海英骏生物技术有限公司测序。测序结果进行BLAST分析以获得GbIspF核心片段。
1.2.3 GbIspF全长cDNA的获得根据GbIspF核心片段序列设计RACE引物:GbIspF3-1:5′-GGTCTTCCTGACATTGGGCA-3′,GbIspF3-2:5′-TTGAAGGAGG CGGTACGTC-3′;GbIspF5-1:5′-GACGTACCGCCTCC TTCAA-3′,GbIspF5-2:5′-TGCCCAATGTCA GGAAGA CC-3′。RACE-PCR扩增按照SMART RACE cDNA扩增试剂盒(Clontech)的说明书进行。RACE产物的纯化、克隆及测序按上述步骤操作。3′ RACE、5′ RACE和核心片段进行电子拼接(Vector NTI Suite 8.0)获得全长cDNA序列,根据拼接序列设计全长特异性引物,正向引物fi GbIspF:5′-ATCAGA ACTCATTCGTATTTCTCC-3′,反向引物ri GbIspF:5′-GTAAAGGTCA TAGTAATGGGCC-3′,克隆获得物理全长cDNA序列。
1.2.4 序列分析序列比对均使用Vector NTI Suite 8.0软件和BlastP2.2.3(http://www.ncbi.nlm. nih.gov)进行分析;ORF的查找和核苷酸的翻译在http://www.ncbi.nlm.nih.gov网站的ORF Finder上完成;用CLUXTALX(Thompson et al., 1997)进行多重序列比对,用MEGA3.0(Kumar et al., 2004)中的临位相联法(neighbor-joining,NJ)构建进化树;蛋白质基本性质及转运肽的分析使用http://www.expasy.org网站提供的相关生物信息学分析软件进行。
1.2.5 组织差异表达分析以银杏根、茎、叶、果RNA为材料,利用看家基因18S rRNA(18SF:5′-ATGATAACTCGACGGATCGC-3′和18SR:5′-CTTGGATGTGGT AGCCGTTT-3′)为内参照,调整各样品RNA浓度,采用半定量one-step RT-PCR(TaKaRa)研究GbIspF在不同组织中的表达情况,正向引物f GbIspF:5′-ATGGCTGCCGCATTCTCTGC -3′,反向引物r GbIspF:5′-TCACTTC TTCATCAAAAGTACAATTG-3′。PCR反应条件为50 ℃ 30 min,94 ℃ 2 min;然后94 ℃ 30 s, 55 ℃ 30 s,72 ℃ 2 min,共30个循环;最后72 ℃总延伸10 min。
1.2.6 GbIspF基因的功能验证设计带Bgl Ⅱ、EcoR Ⅰ酶切位点的引物,用高保真Taq酶扩增GbIspF ORF片段,连T载体转化DH5α。上游引物为f GbIspF: 5′-CCAGATCTATGGCTGCCGCATTCTCTGC-3′(画线处为BglⅡ酶切位点);下游引物为rGbIspF:5′-CCGAATTCTCACTTCTTCATCAAAAGTACAATTG-3′(画线处为EcoRⅠ酶切位点)。抽提质粒、双酶切、回收小片段获得GbIspF,将本实验室保藏的质粒pTrcAtIPI,用BglⅡ、EcoRⅠ双酶切后回收大片段骨架,连接构建好pTrc-GbIspF,转化携带了pAC-BETA质粒的大肠杆菌XL1-Blue,在LB+100 mg·L-1Amp+50 mg·L-1 Cm的双抗平板上筛选阳性克隆获得携带pTrc-GbIspF-pAC-BETA的工程菌。用拟南芥(Arabidopsis thaliana)IspF基因导入pTrc获得pTrc-AtIspF,将pTrc-AtIspF和pAC-BETA导入XL1-Blue获得工程菌作为阳性对照。
用限制性内切酶PstⅠ单酶切pTrcAtIPI质粒,切去pTrcAtIPI质粒携带的来源于拟南芥的IPI基因编码区,回收大片段,按照DNA High Ligation试剂盒方案自连该大片段获得不带IPI基因的空质粒pTrc,转化DH5α感受态,涂布在LB+100 mg·L-1Amp平板上,挑取阳性菌斑扩大培养,质粒纯化试剂盒抽提质粒并进行酶切检测,获得pTrc空菌,按照上述转化方法,分别将pTrc+pAC-BETA、pTrc-GbIspF导入XL1-Blue菌株,获得对照菌株。
在平板上挑取XL1-Blue、XL1-Blue+pTrc-GbIspF、XL1-Blue+pAC-BETA、XL1-Blue+pTrc+pAC-BETA、XL1-Blue+pTrc-GbIspF+pAC-BETA的单菌落,在LB+100 mg·L-1Amp+50 mg ·L-1 Cm的双抗平板上划线,28 ℃倒置暗培养72 h,获得颜色互补平板,以验证其功能。
2 结果与分析 2.1 基因GbIspF的克隆银杏总RNA反转录为cDNA后,以df GbIspF和dr GbIspF为引物,cDNA为模板进行PCR扩增,获得一条特异性扩增的条带,回收目的片段,亚克隆后测序,结果表明该片段长717 bp,经BLAST分析初步鉴定为银杏IspF基因核心片段,并命名为GbIspF。根据所得片段设计基因特异性引物用于扩增GbIspF的cDNA末端,通过3′-RACE和5′-RACE分别获得362 bp的3′-末端和553 bp 5′-末端。将GbIspF基因的3个片段拼接后获得其全长cDNA并最终扩增获得其物理全长,测序结果表明GbIspF基因全长897 bp(图 2),GenBank登录号为EF062579。

|
图 2 银杏GbIspF cDNA全长序列和由此推测的氨基酸序列 Figure 2 The full-length cDNA sequence and the deduced amino acid sequence of GbIspF 编码区和翻译的氨基酸用大写字母表示,非编码区(UTR)用小写字母表示,终止密码子用*表示,画横线处为质体转运肽。 The coding sequence and its deduced amino acid sequence are shown in capital letters, and the UTR are shown in small letters. The stop codon (TGA) is marked with an aster, the plastidial transit peptide is underlined. |
GbIspF全长cDNA包含一个长度为720 bp的ORF,编码含239个氨基酸残基的蛋白(GbIspF)。GbIspF分子量预测为74.854 ku,等电点为5.11。GbIspF的BlastP分析结果表明,该序列与GenBank中的甜菊(Stevia rebaudiana)、长春花(Catharanthus roseus)、橡胶树(Hevea brasiliensis)、三尖杉(Cephalotaxus fortunei)的IspF氨基酸序列一致性分别为85%、85%、82%、76%,初步表明GbIspF是银杏内酯生物合成途径上的功能基因,编码2-C-甲基-D-赤藓醇-2, 4-环焦磷酸合成酶。
GbIspF与其他植物来源的IspF具有较高的同源性,但在蛋白质不同区域表现出不同的相似度,在该类蛋白质N端即转运肽区域,相似度极小;而在催化功能区域,相似度很高(图 3)。GbIspF与其他用于比对的IspF序列均包含典型的IspF蛋白最保守活性位点D8、H10、H42 (Zn2+结合位点)、E135 (Mg2+或Mn2+结合位点) (Marchler-Bauer et al., 2004)。用TargetP和ChloroP对GbIspF进行亚细胞定位预测,发现GbIspF在N端带有59个氨基酸残基的质体转运肽,与MEP途径定位于质体的理论相符(Laule et al., 2003) (图 2)。在Expasy中进一步预测GbIspF的二级结构,显示GbIspF中随机卷曲占65.27%,α-螺旋占25.52%,延伸链占9.21%(图 4)。

|
图 3 银杏GbIspF和其他植物IspFs氨基酸序列的多重比对 Figure 3 Multi-alignment of amino acid sequences of GbIspF and other plant IspFs 一致氨基酸和保守氨基酸残基分别显示为黑色背景和灰色背景;其他氨基酸残基用黑色字体白色背景表示。D8、H10、H42 (Zn2+结合位点)保守活性位点用★表示,E135 (Mg2+或Mn2+结合位点)保守活性位点用●表示。 The identical amino acids are shown in white with black background and the conserved amino acids are shown in black with gray background, other amino acids are shown in black with white background. "★" indicates amino acids coordinating with zinc ion. Magnesium or manganese ion binding site is marked with "●". |

|
图 4 预测的GbIspF二级结构 Figure 4 The putative secondary structure of GbIspF h.α-螺旋Alpha helix;c.随机卷曲Random coil;e.延伸链Extended strand. |
用CLUSTALX和MEGA3.0软件对GbIspF进行分子系统发育树分析,结果显示,IspFs在进化树上分为2支:一支为细菌类,另一支为植物类,表明细菌和植物中IspF差异较大。其中GbIspF与来源于三尖杉和曼地亚红豆杉(Taxus media)的IspF在进化树上最接近,表明IspF在裸子植物中分子进化水平较为一致(图 5),都是较为古老的植物。

|
图 5 银杏GbIspF与其他物种IspFs的分子进化树聚类分析 Figure 5 A phylogenetic tree of GbIspF and other species IspFs 细菌分支用◇表示,植物分支用◆表示。分支上的数字为自引导值,重复次数为1 000次。 IspFs from bacteria are marked with "◇" and IspFs from plants with "◆".The numbers on the branches represent the bootstrap values supported for 1 000 replicates. |
根据GbIspF编码区设计特异性引物,以18S rRNA为内参,对该基因在银杏茎、叶、果实、根中的表达情况进行组织表达谱分析。显示GbIspF在上述组织中均有表达,但表达量存在较大差异,在叶中的表达量最高,其次为果实和茎,在根中表达量最低(图 6)。表明GbIspF的表达具有很强的组织特异性,表达量最高的叶中银杏内酯含量也最高(Cartayrade et al., 1997),初步说明GbIspF可能是银杏内酯生物合成中的关键酶基因。

|
图 6 GbIspF在银杏不同组织中的差异表达 Figure 6 Expression profile of GbIspF in different tissues of G. biloba |
大肠杆菌本身不能产生β-胡萝卜素,但能提供其5碳前体IPP和DMAPP。Cunningham等(2000)把与β-胡萝卜素生物合成相关的4个基因构建到pAC-BETA质粒上,该质粒导入大肠杆菌中就可以在菌中重建β-胡萝卜素生物合成途径,但只能在本底水平上表达,其原因是上游限速步骤的存在。将pTrcGbIspF导入该菌后,在原核表达强启动子Trc的驱动下,GbIspF在大肠杆菌中过量表达,突破了上游代谢瓶颈,推动萜类代谢流向β-胡萝卜素合成的方向流动,使该菌能大量生产β-胡萝卜素。
在获得的颜色互补平板上,作为对照的XL1-Blue空菌、XL1-Blue+pTrcGbIspF和XL1-Blue+pAC-BETA由于不是双抗菌株,不能在双抗平板上生长;XL1-Blue+pTrc+pAC-BETA虽然能在双抗平板上生长,但仅能在本底水平上表达β-胡萝卜素,菌体仍然呈现大肠杆菌本身的白色;只有XL1-Blue+pTrcGbIspF+pAC-BETA由于突破了上游限速步骤,可以大量积累β-胡萝卜素,经过72 h的培养,菌体呈现β-胡萝卜素特有的橘黄色,同时作为阳性对照组的XL1-Blue+pTrcAtIspF+pAC-BETA的菌体也呈现出特有的橘黄色(图 7)。从而证明了在GbIspF和pAC-BETA上携带的几个外源基因的共同作用下,可以推动代谢流向β-胡萝卜素合成的方向流动,表明GbIspF是一个与拟南芥IspF功能相同的基因。

|
图 7 GbIspF在大肠杆菌XL1-Blue中的颜色互补 Figure 7 The functional complementation of GbIspF in E. coli strain XL1-Blue XL1-Blue+pTrcGbIspF+pAC-BETA超表达推动代谢流,生成黄色的类胡萝卜素。 The engineered XL1-Blue haboring pTrcGbIspF and pAC-BETA could overexpress and promote the β-carotene accumulation, then showed the brightly orange. |
银杏是植物中的“活化石",是连接远古植物和现代植物的纽带。银杏提取物中含有多种药用次生代谢产物,其活性成分研究最多的是银杏黄酮和萜类化合物,随着研究的进一步深入,证实属于二萜类天然代谢产物的银杏内酯是治疗心血管疾病最有效的天然药物之一,但在天然银杏中含量很低。基因工程技术是提高包括银杏内酯在内的植物次生代谢产物含量的最有效手段之一。本文采用RACE技术从银杏中克隆了银杏内酯生物合成途径上的GbIspF,为进一步研究萜类代谢途径提供一定依据,为今后利用基因工程技术提高银杏内酯含量打下一定基础。
MVA途径作为经典的萜类前体生物合成途径,一直被认为是萜类5碳前体合成的唯一通道;20世纪90年代,独立于MVA途径的MEP途径(Rohmer et al., 1993)才首先在细菌和植物中被发现,该途径也能提供萜类5碳前体。该途径的发现为阐明银杏内酯的化学起源提供了依据,证实作为二萜类的银杏内酯是由定位于质体的MEP途径提供5碳前体IPP和DMAPP。韩国一个研究组先后从银杏中克隆了MEP途径中的前3个酶:GbDXS1(Kim et al., 2005),GbDXS2(Kim et al., 2006a), GbDXR(Kim et al., 2006a)和GbMECT(Kim et al., 2006b)。而银杏MEP途径中的第5个酶IspF少有报道,该酶催化CDP-MEP转变为2-甲基-D-赤藓醇-2, 4-环焦磷酸(2-C-methylerythritol 2, 4-cyclodiphosphate, ME-cPP)。在长春花中过量表达IspF有利于代谢流向更下游的方向,其表达量与长春花中单萜吲哚生物碱(monoterpenoid indole alkaloids)的积累呈正相关(Veau et al., 2000),可以预测在银杏中过量表达IspF有可能提高其银杏内酯的含量。本研究从银杏中成功克隆出897 bp的基因GbIspF全长序列,采用基于遗传功能互补的策略,验证了GbIspF的功能,为同类基因功能分析提供了一种简便快速、结果易于分析的方法。银杏IspF基因的克隆和功能分析为进一步在分子水平和生物化学水平阐明该基因及其编码的酶在银杏内酯合成中的作用提供目的基因,也可为实现银杏内酯代谢工程提供候选基因。
韩金玉, 李海静, 褚巧伟. 2000. 天然药物银杏内酯研究进展. 化工进展, (2): 23-25. |
Ayadi R, Tremouillaux-Guiller J. 2003. Root formation from transgenic calli of Ginkgo biloba. Tree Physiology, 23(10): 713-718. DOI:10.1093/treephys/23.10.713 |
Cartayrade A, Neau E, Sohier C, et al. 1997. Sites of synthesis, translocat ion and accumulation of ginkgolides and bilobalide. Plant Physiology and Biochemistry, 35(11): 859-868. |
Crimmins M T, Pace J M, Nantermet P G, et al. 2000. The total synthesis of (+/-)-ginkgolide B. Journal of the American Chemical Society, 122: 8453-8463. DOI:10.1021/ja001747s |
Cunningham F X, Gantt E. 2000. Identification of multigene families encoding isopentenyl diphosphate isomerase in plants by heterologous complementation in Escherichia coli. Plant Cell Physiol, 41: 119. DOI:10.1093/pcp/41.1.119 |
Eisenreich W, Rohdich F, Bacher A. 2001. Deoxyxylulose phosphate pathway to terpenoids. Trends Plant Sci, 6: 78-84. |
Gong Yifu, Liao Zhihua, Guo Binhui, et al. 2005. Molecular cloning and expression profile analysis of Ginkgo biloba DXS gene encoding 1-deoxy-d-xylulose 5-phosphate synthase, the first committed enzyme of the 2-C-methyl-d-erythritol 4-phosphate pathway. Planta Medica, 68: 1-7. |
Kim S M, Kuzuyama T, Chang Y J, et al. 2005. Functional identification of Ginkgo biloba 1-deoxy-D-xylulose 5-phosphate synthase (DXS) gene by using Escherichia coli disruptants defective in DXS gene. Agr Chem Biotechno, 48: 101-104. |
Kim S M, Kuzuyama T, Chang Y J, et al. 2006a. Identification of class 2 1-d eoxy- d-xylulose 5-phosphate synthase and 1-deoxy-d-xylulose 5-phosphate reducto isomerase genes from Ginkgo biloba and their transcription in embryo culture with respect to ginkgolide biosynthesis. Planta Med, 72: 234-240. DOI:10.1055/s-2005-916180 |
Kim S M, Kuzuyama T, Chang Y J, et al. 2006b. Cloning and functional characterization of 2-C-methyl-D-erythritol 4-phosphate cytidyltransferase (GbMECT) gene from Ginkgo biloba. Phytochemistry, 67: 1435-1441. DOI:10.1016/j.phytochem.2006.05.034 |
Kumar S, Tamura K, Nei M. 2004. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment. Brief Bioinform, 5: 150-163. DOI:10.1093/bib/5.2.150 |
Laule O, Furholz A, Chang H S, et al. 2003. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana. Proceedings of the National Acacemy of Sciences of the United States of America (PNAS), 100: 6866-6871. DOI:10.1073/pnas.1031755100 |
Laurain D, Trémouillaux-Guiller J, Chénieux J C, et al. 1997. Production of ginkgolides and bilobalide in transformed and gametophyte derived cell cultures of Ginkgo biloba. Phytochemistry, 46(1): 127-130. DOI:10.1016/S0031-9422(97)00217-3 |
Marchler-Bauer A, Bryant S H. 2004. CD-Search: protein domain annotations on the fly. Nucleic Acids Res, 32: 327-331. DOI:10.1093/nar/gkh454 |
Maruyama M, Terahara A, Nakadaira Y, et al. 1967. The ginkgolides Ⅵ: Stere ochemistry of the ginkgolides. Tetrahedron Letters, (4): 315. |
Rohmer M, Knani M, Simonin P, et al. 1993. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate. Biochemical Journal, 295(Pt2): 517-524. |
Schwarz M K. 1994. Terpen-Biosynthese in Ginkgo biloba: eine überraschende Geschichte. Ph. D. Thesis. ETH, Zürich, Switzerland.
|
Thompson J D, Gibson T J, Plewniak F, et al. 1997. The CLUSTAL X windows in terface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res, 25: 4876-4882. DOI:10.1093/nar/25.24.4876 |
Van Beek T A, Scheeren H A, Rantio T, et al. 1991. Determination of ginkgolides and bilobalide in Ginkgo biloba leaves and phytopharmaceuticals. Journal of Chromatography, 543: 375-387. |
Veau B, Courtois M, Oudin A, et al. 2000. Cloning and expression of cDNAs encoding two enzymes of the MEP pathway in Catharanthus roseus. Biochimica et Biophysica Acta, 1517: 159-163. DOI:10.1016/S0167-4781(00)00240-2 |
 2008, Vol. 44
2008, Vol. 44

