文章信息
- 张大鹏, 曹帮华, 贾波, 唐全.
- Zhang Dapeng, Cao Banghua, Jia Bo, Tang Quan
- 盐碱胁迫下合欢种子的抗逆萌发生理
- Germination and Physiological Response of Albizia julibrissin Seeds under Alkali-Salt Stress
- 林业科学, 2008, 44(9): 157-161.
- Scientia Silvae Sinicae, 2008, 44(9): 157-161.
-
文章历史
- 收稿日期:2007-08-16
-
作者相关文章
社会经济不断发展,全球人口急剧增长,人们可利用的耕地面积正逐渐减少。开发利用盐碱地已成为改善生态环境、减缓土地人口压力的一项重要措施。然而,我国北方盐碱地多属于既含有中性盐又含有碱性盐的复合盐碱地,盐化与碱化往往相伴发生,碱性盐不仅具有中性盐的胁迫作用,还具有高pH值及明显降低矿质元素可利用性等特点,因而较NaCl等中性盐具有更大的生态破坏力(石德成等,1998a;1998b)。因此,如何能更多了解盐碱地的作用机制,更深入开发利用盐碱地已成为当今亟需解决的主要问题。
至今许多人仍将土壤盐化与碱化混为一谈,笼统地称为盐碱化。其实盐、碱对于植物来说是2种不同性质的胁迫,植物的适应机制也有所不同。植物在盐碱环境下生长时,因渗透胁迫而导致活性氧的生成、脂质过氧化和生理代谢的变化,最终生长受到抑制。土壤盐化与碱化的含义也应有所区别,盐化应以土壤盐度升高为主要特征,碱化则应以土壤pH值升高为主要特征。从目前植物抗逆生理学研究现状来看,多以NaCl为研究对象,以Na+代谢、植物抗盐相关基因的分子生物学及盐胁迫的信息传导等为研究方向(林西凤等,2000;Carmina et al., 2000),尽管目前在认识植物抗盐机制方面有了长足进展,但在碱性盐胁迫及盐碱混合胁迫方面仍很少有人涉及,仅在羊草(Aneurolepidium chinense)(王萍,1994)、星星草(Puccinellia tenuiflor)(杨春武等,2006)、棉花(Gossypium spp.)(谢德意,2000)、高粱(Sorghum bicolor)(李玉明,2002)、盐地碱蓬(Suaeda alsa)(段德玉等,2003)、刺槐(Robinia pseudoacacia)(武德等,2007)等植物中作过一些报道。
适地适树是造林绿化基本原则,盐碱地改良措施中相对于改造立地条件,选择树种是更为经济有效的途径。合欢(Albizia julibrissin)具有较强的抗盐碱能力,是重要的盐碱地造林绿化树种;但是,关于合欢方面的研究却很少见。因此,本文以合欢种子为材料,研究盐碱胁迫下合欢种子耐盐碱萌发机制,讨论合欢的耐盐碱极限,以期为盐碱地高效育苗、造林提供理论依据。
1 材料与方法 1.1 供试材料试验用合欢种子2006年11月底采集,种子千粒质量为(38.75±0.13)g。采后种子自然干藏,试验于2007年5月在山东农业大学森林培育实验室进行。
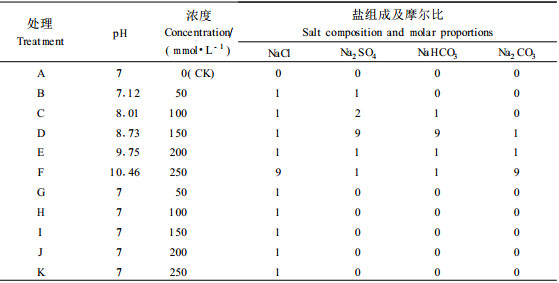
1.2 试验设计根据内陆盐碱地主要盐分组成特点,选定2种中性盐NaCl和Na2SO4和2种碱性盐NaHCO3和Na2CO3,根据其盐度与pH值复杂多变特点,将NaCl、Na2SO4、NaHCO3和Na2CO3按不同摩尔比混合,使其随着盐度的提高,pH值也不断提高。以相同浓度的中性盐(NaCl)作对比,观察其各项指标的变化差异。各处理的盐分组成、浓度及其摩尔比见表 1。
|
|
每处理种子用四分法随机获取4组100粒种子,4次重复。种子先用0.5%高锰酸钾溶液消毒2 h,无菌水冲洗净、晾干后,用始温为70 ℃热水浸种24 h。
发芽床用培养皿内置海绵,海绵上铺滤纸制成。将吸胀的种子分别摆在已经放置了处理溶液的发芽床上,置于ZRX-258DF型智能人工气候培养箱内发芽。每天光照8 h,发芽温度25℃,光照强度1 200 lx,每天称量补充蒸发的水分。
1.4 指标与测定方法从种子置床开始每天观察记录,按国家标准GB 2772-1999规定第7天统计发芽势(%),第14天统计发芽率(%),分别计算种子的发芽势(Ge)、发芽率(Gr)、发芽指数(Gi)和活力指数(Vi)。其中发芽指数Gi=ΣGt/Dt;活力指数Vi=Gi×S; Gt为在时间t日的发芽数;Dt为相应的发芽日数;S为幼苗鲜质量。
发芽结束后,选取幼苗子叶以下部分,称样0.5 g,加入5 mL pH值为7.8的磷酸缓冲溶液后冰浴研磨,8 000 r·min-1的转速离心,20 min后取上清液保存在冰箱待用。超氧化物歧化酶(SOD)和过氧化物酶(POD)测定参照李合生(2000);过氧化氢酶(CAT)测定参照张治安等(2004)。
2 结果与分析 2.1 不同盐碱胁迫下合欢种子发芽率(Gr)和发芽势(Ge)的变化合欢种子的Gr和Ge在不同盐碱胁迫下的变化情况如图 1a、b所示。由图中可看出,随着盐浓度的增加,合欢种子的发芽率和发芽势均呈下降趋势,但下降幅度明显不同。混合盐碱处理下的种子发芽率和发芽势在100 mmol·L-1时急剧下降,而中性盐处理的种子变化相对平缓,这可能与种子对胁迫的忍耐程度有关。
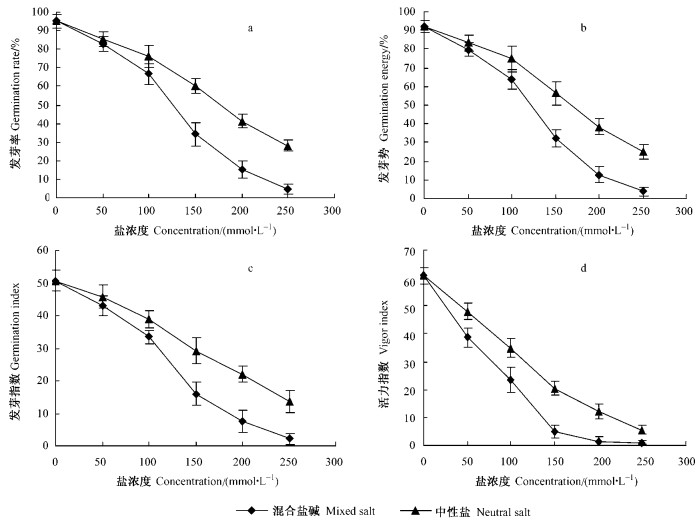
|
图 1 不同处理对合欢种子发芽的影响 Figure 1 Effect of different treatments on the germination of A. julibrissin seeds |
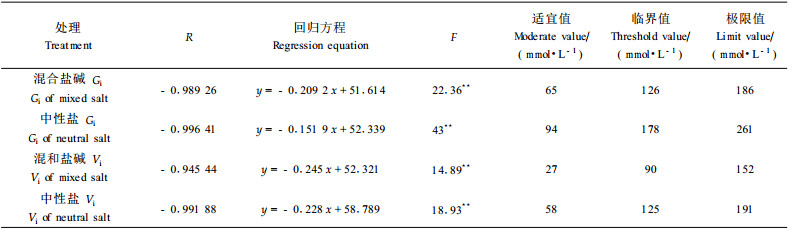
对种子的相对发芽率、相对发芽势进行相关分析,并进行回归统计检验,求得回归方程。求得相对发芽率、相对发芽势(无盐处理为100%)为75%、50%、25%所对应的盐溶液浓度作为种子发芽时抗性的适宜值(达到75%时的盐溶液浓度)、临界值和极限值(李存桢等,2005),结果见表 2。由表 2知,混合盐碱处理的种子的相对发芽率、相对发芽势各值均低于中性盐的处理,说明混合盐碱较中性盐对种子有更强的胁迫作用,由相关系数可以看出,种子的发芽率、发芽势与盐浓度间存在着极显著的负相关关系,这与刘建平等(2004)、时丽冉等(2006)的结果相符。
|
|
发芽率是种子发芽的常用指标,但用发芽指数和活力指数作为种子活力综合指标更具优越性:它们同每粒发芽种子的相应发芽时间及其整齐度均发生关系;活力强的种子在不利环境条件下的出苗能力强,贮藏后能保持发芽力,活力弱的种子则相反。由此可见,种子活力不是单一的测定特性,而是描述种子出苗不同方面(包括试验、田间和贮藏期间)的综合特性。
由图 1c、d可知,不同盐溶液处理下其Gi和Vi随盐浓度的变化表现出相似性。随着盐浓度增加,各处理下的Gi和Vi都呈下降趋势,当混合盐碱浓度达到150 mmol·L-1时种子的Gi、Vi变化趋于平缓,而中性盐则始终保持着相对均匀的下降趋势。相关分析表明:各种盐胁迫下Gi和Vi与盐浓度也具有极显著的负相关关系(表 3)。
|
|
盐碱胁迫下合欢幼苗叶片保护酶系统活性发生了显著的变化(图 2a、b、c)。由图 2a可以看出,随着盐浓度的增加,SOD酶活性变化的总趋势都是先升后降,但是变化幅度明显不同:混合盐碱处理的种子SOD活性变化幅度明显高于中性盐处理的种子。经混合盐碱胁迫的种子的SOD活性在150 mmol·L-1便开始下降且幅度较大,而中性盐处理的种子在200 mmol·L-1时才开始有小幅度的降低趋势。图 2b中CAT活性的变化和SOD活性的变化趋势大体相似,只有浓度在250 mmol·L-1时,才稍微的差别。其原因可能是植物组织中高浓度的H2O2主要靠CAT清除,使H2O2控制在较低的水平(杨淑慎等,2001),而H2O2的产生又与SOD的清除能力有关,因此CAT活性的变化随着SOD清除能力的变化而变化。图 2c中幼苗的POD酶活性随着2种盐浓度的逐渐增加而呈高低交替的变化趋势,其中经混合盐碱处理的种子的POD酶活性波动性较大,且变化幅度(29.3 U·g-1FW)明显高于中性盐处理的POD酶活性(23.8 U·g-1FW)。总体来讲,经混合盐碱处理的种子的SOD、POD和CAT活性的变化要比中性盐处理的种子变化剧烈,混合盐的胁迫作用大于中性盐。

|
图 2 不同处理对合欢种子SOD、CAT、POD活性的影响 Figure 2 Effect of different treatments on the activity of SOD, CAT, POD of A. julibrissin seeds |
盐碱对植物的伤害主要包括3个方面:渗透胁迫、离子伤害和营养失衡(Greenway et al., 1980),具体表现在影响了植物种子的萌发(Cuartero et al., 1999)、植株的生长发育(Alshammary et al., 2004)和结实等,耐盐碱植物通过一系列的形态学和生理学的适应性反应来降低这些伤害(Poljakoff-Mayber,1988)。本试验通过不同浓度的NaCl和按一定比例混合的NaCl、Na2SO4、NaHCO3和Na2CO3盐溶液处理合欢种子,模拟中性盐和混合盐碱对合欢种子萌发的影响,观察其形态学和生理学的变化情况。结果表明:2种盐溶液对合欢种子的萌发均具有明显的抑制作用,种子的相对发芽率、发芽势、发芽指数和活力指数与盐浓度之间呈显著的负相关关系,且不同种类、浓度的盐处理对合欢种子的萌发具有不同的影响。尽管整个萌发过程变化趋势相似,但存在程度上的显著差异。合欢种子的发芽指数和活力指数在中性盐胁迫下的萌发临界值和极限值(177、267 mmol·L-1)都要高于混合盐碱溶液(125、188 mmol·L-1)。其原因可能是:中性盐胁迫主要是Na+的毒性作用和由Na+浓度引起的膜渗漏作用;而混合盐碱除了造成离子毒害和渗透胁迫外,还有高pH值胁迫,以及两者的协同作用,使合欢种子的营养状况破坏严重,影响矿质元素的吸收,最终导致萌发困难。因此,混合盐碱的毒害作用远远大于中性盐。
盐碱胁迫下, 保护酶活性的变化因植物品种、胁迫方式、胁迫强度和胁迫时间的不同而不同。整个保护酶系统的防御能力的大小取决于这几种酶彼此协调的综合结果(陈少裕,1991;蒋明义等,1996;孙国荣等,2003)。研究发现,SOD、POD、CAT作为植物保护酶系统的成员, 在盐逆境中各自作用与活性变化不同。SOD酶作用是将逆境下产生并积累超氧阴离子(O2-)歧化成H2O2,POD和CAT协同SOD清除自由基危害,将H2O2分解成H2O和O2。本研究表明,在轻度及中度胁迫下,SOD、CAT活性升高,POD变化不大。SOD酶是一种诱导酶,合欢种子在胁迫条件下,会产生并积累超氧阴离子(O2-),诱导SOD活性增加。至于POD变化平缓,可能与CAT活性较高,可清除大量的H2O2有关,也可能是由于POD的启动有一个过程,需要在某种条件(如一定量的H2O2积累等)下才得以实现(郑淮兵等,2005)。而重度盐胁迫下,SOD、POD以及CAT活性均下降,可能与盐胁迫使自由基的生成过量,对酶活性的伤害作用增大(刘志礼等,1998),超越了防御系统的清除能力,造成H2O2在幼苗体内的大量积累,从而进一步加大对酶活性的伤害有关。
陈少裕. 1991. 膜脂过氧化对植物细胞的伤害. 植物生理学通讯, 27(2): 84-90. |
段德玉, 刘小京, 冯凤莲, 等. 2003. 不同盐分胁迫对盐地碱蓬种子萌发的效应. 中国农学通报, 19(6): 168-172. DOI:10.3969/j.issn.1000-6850.2003.06.054 |
李存桢, 刘小京, 黄玮, 等. 2005. 不同盐分胁迫对中亚滨藜种子萌发及其恢复的影响. 河北农业大学学报, 28(6): 1-4. DOI:10.3969/j.issn.1000-1573.2005.06.001 |
李合生. 2000. 植物生理生化实验原理和技术. 北京: 高等教育出版社.
|
李玉明. 2002. 混合盐碱胁迫对高粱幼苗的影响. 杂粮作物, 22(1): 41-45. DOI:10.3969/j.issn.2095-0896.2002.01.017 |
林西凤, 李冠一. 2000. 植物耐盐性研究进展. 生物工程进展, 20(2): 20-25. DOI:10.3969/j.issn.1671-8135.2000.02.005 |
刘建平, 李志军, 何良荣, 等. 2004. 灰叶胡杨种子萌发期抗盐性的研究. 林业科学, 40(2): 165-169. DOI:10.3321/j.issn:1001-7488.2004.02.029 |
刘志礼, 李鹏云. 1998. NaCl胁迫对螺旋藻生长及抗氧化酶活性的影响. 植物学通报, 15(3): 43-47. DOI:10.3969/j.issn.1674-3466.1998.03.009 |
蒋明义, 郭绍川. 1996. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用. 植物生理学通讯, 32(2): 144-150. |
时丽冉, 崔兴国, 刘志华, 等. 2006. 混合盐碱胁迫对旱稻种子萌发的影响. 种子, 25(2): 25-27, 31. |
石德成, 盛艳敏. 1998a. 不同盐浓度的混合盐对羊草苗的胁迫效应. 植物学报, 40(12): 1136-1142. |
石德成, 盛艳敏. 1998b. 复杂盐碱生态条件的人工模拟及其对羊草生长的影响. 草业学报, 7(1): 36-41. |
孙国荣, 彭永臻, 张睿, 等. 2003. 干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响. 林业科学, 39(1): 165-167. DOI:10.3321/j.issn:1001-7488.2003.01.027 |
王萍. 1994. 中性盐和碱性盐对羊草幼苗胁迫的研究. 草业科学, 3(2): 37-42. |
武德, 曹帮华, 刘欣玲, 等. 2007. 盐碱胁迫下刺槐种子萌发主导因素的确定. 山东科学, 20(1): 25-29. DOI:10.3969/j.issn.1002-4026.2007.01.007 |
谢德意. 2000. 盐胁迫对棉花种子萌发及幼苗生长的影响. 种子, 19(3): 9-13. |
杨春武, 贾娜尔·阿汗, 石德成, 等. 2006. 复杂盐碱条件对星星草种子萌发的影响. 草业学报, 15(5): 47-51. |
杨淑慎, 高俊凤. 2001. 活性氧、自由基与植物的衰老. 西北植物学报, 21(2): 215-220. |
张治安, 张美善, 蔚荣海. 2004. 植物生理学实验指导. 北京: 中国农业科技出版社.
|
郑淮兵, 董丽, 郑彩霞. 2005. 低温和PEG"渗控"预处理促进石楠种子萌发的研究. 林业科学, 41(3): 54-57. DOI:10.3321/j.issn:1001-7488.2005.03.009 |
Alshammary S F, Qian Y L, Wallner S J. 2004. Growth response of four turf grass species to salinity. Agricultural Water Management, 66: 97-111. |
Carmina G, Ana M R, Carmen M B, et al. 2000. The yeast HAL1 gene improves salt tolerance of transgenic tomato. Plant Physiology, 123: 393-402. DOI:10.1104/pp.123.1.393 |
Cuartero J, Rafael F M. 1999. Tomato and salinity. Sciatica Horticulture, 78: 83-125. |
Greenway H, Munns R. 1980. Mechanisms of salt tolerance in non-halophytes. Plant physiology, 31: 149-190. DOI:10.1146/annurev.pp.31.060180.001053 |
Poljakoff-Mayber A. 1988. Ecological-physiological studies on the responses of higher plants to salinity and drought. Sci Rev Arid Zone Res, 6: 163-183. |
 2008, Vol. 44
2008, Vol. 44