文章信息
- 王纪杰, 徐秋芳, 姜培坤.
- Wang Jijie, Xu Qiufang, Jiang Peikun
- 毛竹凋落物对阔叶林土壤微生物群落功能多样性的影响
- Impacts of Litter of Phyllostachy pubescens on Functional Biodiversity of Soil Microorganism Communities in Broad-Leaved Forest
- 林业科学, 2008, 44(9): 146-151.
- Scientia Silvae Sinicae, 2008, 44(9): 146-151.
-
文章历史
- 收稿日期:2006-12-30
- 修回日期:2008-06-30
-
作者相关文章
林地凋落物分解在森林生态系统物质能量循环中有着重要地位,它是森林土壤养分的主要来源之一(蒋有绪,1981;曹群根等,1996)。土壤微生物作为森林凋落物的主要分解者,其群落结构和功能以及微生物活性受到凋落物的影响(赵吉等,2002; Paul et al., 2005; Bragazza et al., 2006)。微生物活性与林地肥力状况以及地力的维持与提高有着密切关系(曹群根等,1996),土壤微生物群落结构和功能多样性是土壤质量最敏感的潜力指标之一(白清云,1997; 任天志,2000; 滕应等,2004),因而研究凋落物对土壤微生物的影响可以反映出林地演替或人为经营过程中土壤质量的变化。
毛竹(Phyllostachy pubescens)是我国重要的森林资源之一,其面积达420万hm2,占总竹林面积的68.7%。毛竹的高经济效益导致了许多阔叶林或其他森林逐渐被毛竹林替代,竹林面积不断扩展,纯林集约化程度与日俱增,经营面积也在不断扩大,从而出现了林分结构单一,地上部分生物多样性减退,土壤质量变差的局面。本试验应用Biolog GN2微平板法研究外加不同比例的毛竹纯林凋落物对阔叶林土壤微生物群落功能多样性的影响,旨在揭示毛竹纯林化特别是集约化经营过程中土壤微生物群落的演变规律,为毛竹林土壤质量评估提供理论依据。
1 材料与方法 1.1 研究区概况土样采样地位于浙江省临安市(30°14′ N,119°42′ E)玲珑山的木荷(Schima superba)阔叶林内,该地区属中亚热带季风气候,年均气温15.9℃,年降水量1 424 mm,全年无霜期236 d。样地海拔200 m位于丘陵上,土壤为发育于凝灰岩的黄红壤,阔叶林下土壤A层一般厚10 cm左右。阔叶林优势树种的树龄均在25年左右,林下灌木及杂草茂盛,郁闭度0.8,枯落物层厚3~4 cm,乔木层以木荷(Schima superba)为主,有少量石栎(Lithocarpus glaber)、马尾松(Pinus massoniana);灌木层有木荷、乌饭(Vaccinium bracteatum)、马银花(Rhododendron ovatum)、檵木(Loropetalum chinense)、赤楠(Syzygium buxifolium)、格药柃(Eurya muricata)、杨桐(Adinandra millettii)、老鼠矢(Symplocos stellaris)等。
毛竹凋落物主要源于竹叶,竹叶采集地位于临安市青山湖区典型集约经营毛竹纯林,集约经营历史5年以上,林下无其他灌木或杂草。
1.2 试验材料于2006年3月上旬,随机收集临安市青山湖区毛竹林地表新凋落物(主要是竹叶),带回实验室自然风干后粉碎,装袋备用。选择几处阔叶树密集的区域,片状采集0~20 cm表层土样至足够试验用量,带回实验室,去杂过2 mm钢筛后充分混匀备用。
1.3 试验设计试验分5组,每组培养时间分别为2,5,10,20与30周,每组设4个处理,每个处理3个重复,试验共准备60只150 mL三角瓶。对照不加任何凋落物;处理1加入相当于干土质量1%的凋落物粉末;处理2加入相当于干土质量2%的凋落物粉末;处理3加入相当于干土质量4%的凋落物粉末。按处理要求将竹叶与土壤充分混匀,并将湿度调至60%的田间持水量后装瓶,然后用双层纱布封住瓶口,将准备好的样品一并放入25 ℃人工气候箱,箱内湿度控制在75%~80%,培养过程中失水用恒质量法补充。分别在未培养前和培养后的2,5,10,20与30周,应用Biolog法分析土壤微生物功能多样性。
1.4 土壤微生物多样性分析方法应用Biolog GN2(Biolog Inc. Hayward, C.A., USA)微平板测定土壤微生物利用有机碳的能力,Biolog GN2是96孔的微平板,共有95种不同的碳源,除对照外每孔含有一种不同的单一碳源。微生物利用碳源的程度可用内含的指示剂指示,通过测定其光密度值的变化来衡量微生物利用碳源的能力。微生物多样性测定参照Garland等(1991)的方法:称相当于10 g干土质量的鲜土,在超净工作台中将土壤加入存有100 mL无菌蒸馏水的三角瓶中,加盖振荡30 min(转速为300 r·min-1),静止澄清后,取10 mL上清液加入90 mL的无菌蒸馏水中;重复以上稀释过程使溶液的最终浓度为最初的1/1 000。将以上溶液接种至GN2微平板中,接种后的GN2微平板放入25℃培养箱中温育8 d,每隔24 h(即分别在24, 48, 72, 96, 120, 144, 168和192 h)于595 nm处用VAMAX自动读盘机进行自动读取光密度值(Microlog ReL 3.5软件)。每组试验的12个样品均进行以上分析。
1.5 数据处理土壤微生物群落利用碳源的能力,采用每孔平均光密度(AWCD)来描述,AWCD=[∑(C-R)]/95,式中C为所测95个反应孔的光密度,R为对照孔的光密度。
土壤微生物群落功能多样性指数依据120 h的光密度值计算。Shannon多样性指数(H)按下式计算:H=-∑PilnPi,式中Pi为每孔相对吸光值(C-R)与95孔吸光值总和之比。Evenes(J′)均匀度指数按下式计算:J′=H/lnS,式中:S为物种总数,即被利用的碳源总数。McIntosh指数(U)的表达式为:U=
数据分析采用DPS统计软件(唐启义等, 1997)。
2 结果与分析 2.1 外加不同比例竹叶对土壤微生物功能多样性的影响Biolog微盘每孔中碳源被利用的程度可通过光密度值反映,因为二者呈正相关关系,平均光密度值(AWCD)可反映土壤微生物群落利用碳源的能力,是衡量微生物群落生理功能多样性的一个重要指标(滕应等,2003),对土壤环境变化反应敏感。土壤微生物接种到GN2微平板后,温育过程中Biolog GN2微平板中碳源被不同的微生物利用。平均光密度值的大小取决于2个因素:1)接种液中含有的微生物种类的多少,种类越多则能被利用的碳源种类越多;2)微生物种群个体数量,即微生物的生物量,数量越多则微盘中某些碳源被同化利用的程度越高。
从图 1可以看出,加入竹叶培养2周后,AWCD值表现为处理1>处理2>对照>处理3,但处理1、处理2与对照之间差异均未达显著水平,而处理3与前3者差异显著(P < 0.05);培养5周时,外加竹叶的3个处理的AWCD值均高于对照,差异也未达显著水平。培养2周和5周时不同处理AWCD值的差异说明,4%的竹叶(处理3)在2周时对土壤微生物表现为抑制作用,而到第5周时外加竹叶的对土壤微生物均表现为激发作用。培养10周时处理2土壤AWCD值低于其他各处理(P < 0.05),处理3在192 h的AWCD值比处理2高25%(P < 0.05),处理3虽高于对照及处理1,但差异未达显著水平。在环境因素及土壤养分相同的情况下,土壤的碳源水平是影响微生物活性的重要因素。按常识分析,处理1外加的碳源少于处理2,随着培养时间增加,有机碳不断消耗,土壤微生物活性出现下降的首先应是处理1,而本试验的结果却是处理2。以上异常现象可能是外加2%竹叶后使土壤碳氮比正好落在微生物最适范围,因而在第5~10周的中间某段时间(本试验未进行分析)微生物活动非常活跃,分解有机物速度很快,而到第10周时因碳源消耗过多,土壤微生物活性下降。也可能还有其他未知原因,待以后试验探明。培养20周后,外加竹叶3个处理的AWCD值反而明显低于未加竹叶的对照,30周后竹叶处理与对照之间的差距与20周时类似。以上结果说明外加不同质量的竹林凋落物在短期内(5~10周)刺激了原本稳定的阔叶林土壤微生物,使之同化碳源的能力增强,随着培养时间的延长,微生物活性逐渐增加,而竹叶中易被利用的活性碳源有限,较强的微生物活性使得到土壤中能被利用的碳源急剧下降,因而到培养后期,外加竹叶土壤微生物活性反而低于对照。
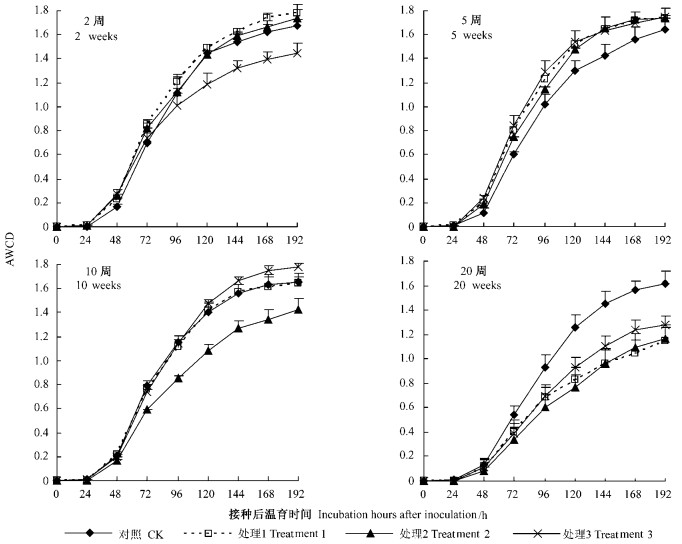
|
图 1 不同培养时间各处理土壤微生物AWCD值 Figure 1 AWCD of the different treatments with various culture times |
处理1和3在未培养前土壤微生物的AWCD值居于中等水平,其AWCD值低于2,5和10周而高于20和30周(图 2);处理2的AWCD值低于2和5周,高于10,20和30周。说明短期内土壤微生物活性随培养时间的增加而增加,其原因为:1)竹叶中活性有机碳激发微生物;2) 25℃适宜的培养条件使土壤微生物活性增强,因为试验土壤的采集时间为2006年3月,此时野外气温还比较低,土壤微生物趋于低活性状态,而25℃的培养条件是大部分微生物的最适温度。20周以后土壤微生物活性呈现下降趋势,处理1,2和3培养30周时土壤微生物接种温育192 h后的AWCD值与未培养相比分别下降了64.8%,55.7%和60.4%,因为此时易被微生物利用的碳源已被逐渐消耗。然而,未加竹叶的对照土壤AWCD值随培养时间的变化不同于竹叶处理,表现为20周以前略高于未培养时,但未达到显著差异;而30周时明显低于未培养时,其192 h的AWCD值与未培养时相比下降40.4%。对照土壤微生物随时间变化的这种动态规律可作以下解释:在没有外加碳源的情况下,温度是影响微生物的重要因素,25℃适宜的温度使土壤微生物活性逐渐增强,对土壤碳源的消耗逐渐积累,在20周与30周之间的某个时间,碳的消耗达到临界点,因此30周土壤微生物活性急剧下降。所有处理30周时土壤活性有机碳源不足是限制微生物活动,导致其活性下降的主要因素。
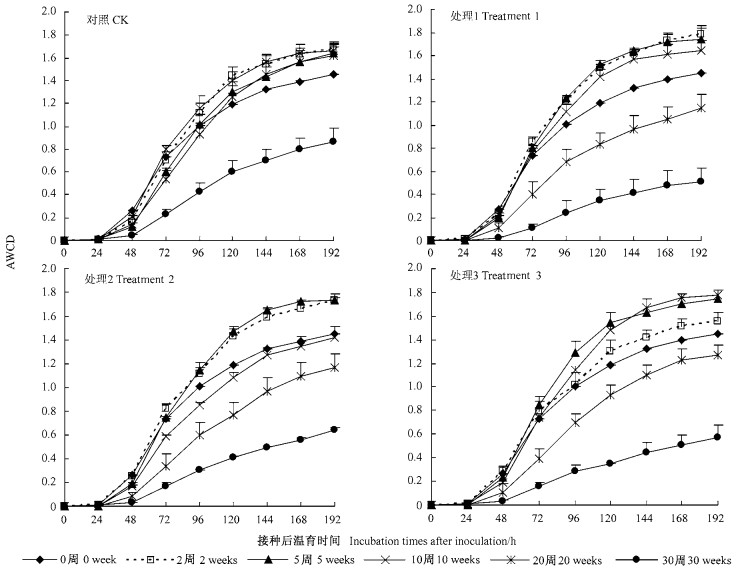
|
图 2 不同处理土壤AWCD值随着培养时间的变化 Figure 2 Changes of soil AWCD of different treatments with culture times |
将不同处理土壤微生物接种后温育结束时(192 h)的AWCD最大值与土壤培养时间(周)作关系图,可以更清楚地显示土壤微生物活性随培养时间先增后降的动态规律,但不同处理间变化规律稍有差异(图 3)。这一结果与钟哲科(2003)的土壤中加入杨树(Populus spp.)、水杉(Metasequoia glyptostroboides)叶子培养后其微生物量碳变化的研究结果类似,与外加新鲜有机物对土壤酶活性的影响的研究结论(Fontaine et al., 2003)一致,土壤酶活性能反映微生物活性。说明外加碳源可剌激土壤微生物,但持续时间较短。

|
图 3 不同处理接种后温育192 h时的AWCD值与土壤培养时间的关系 Figure 3 Relationship between the maximum AWCD (192 h) and culture times of different treatments |
Biolog微平板法可以根据微孔颜色变化状况间接估测微生物群落状况(滕应等,2003)。但更能准确反映微生物群落功能多样性变化的当属多样性指数。Shannon指数把种的多度和均匀度分开计算,能够客观反映物种的丰富度和均匀度(Zak, 1994),微盘中能被利用的碳源越多且利用强度越大则Shannon指数也越大,它是目前应用最为广泛的群落多样性指数之一(Magurran, 1988);McIntosh指数既能反映碳源利用种类数上的差别,也能区分利用程度上的不同,碳源利用种类数相同时,利用程度大的则其McIntosh指数大。
以培养120 h时的光密度为依据计算微生物利用碳源的功能多样性指数(表 1),结果表明:Shannon指数只在培养30周时表现为对照高于竹叶处理;Evenes均匀度指数也在第30周时表现为对照和处理2高于处理1和3;而McIntosh指数的差异则在第20周时就显现出来,结果是对照显著高于其他处理,到第30周时虽然对照仍高于其他处理,但差异没有达到显著水平。
|
|
比较培养不同时间段各指数变化规律发现,短期内(10周以前)各指数没有表现变异。整个培养过程中对照的Shannon指数未发生变化,第30周时处理1,2与3的Shannon指数显著低于第20周及以前几周(P < 0.05)。处理1,2与3的Evenes均匀度指数的变化规律与Shannon指数不同的是对照土壤30周时明显低于第10周(P < 0.05),但与20周时无显著差异。第20周时处理1,2与3的McIntosh指数明显低于前10周(P < 0.05),30周时这种差异则更明显,而对照30周时才出现明显下降(P < 0.05)。以上结果说明,加入竹叶的质量多少没有导致土壤群落结构的显著差异,但与对照相比,外加竹叶使土壤微生物多样性下降,土壤微生物群落有趋于简单化的可能。
分析不同培养时间各处理土壤微生物对微平板单一碳源利用的情况发现(表 2),前期外加竹叶剌激了土壤微生物对某些碳源的利用。培养2周时,加竹叶处理的土壤微生物利用氨基酸和核苷类碳的能力明显高于对照(P<0.05);培养5周时,加竹叶处理对所分析的几种碳的利用能力一般高于对照。但从第20周起,对照及竹叶量最少的处理1土壤微生物对糖及其衍生物和聚合物的利用高于处理2和3;则处理1在20周时对核苷类物质及在30周时对磷酸及糖类的利用能力明显高于处理2和3,但与对照无差异。
|
|
以上结果说明,外加竹叶改变了土壤微生物对碳源利用的模式,碳源的种类和程度均发生了变化,这与Tracy等(2004)的研究结果一致。
|
|
不同处理间土壤微生物活性在培养前期无显著差异,到20周以后对照的AWCD值高于外加竹叶的3个处理。外加竹叶培养土壤微生物活性表现为先增强后逐渐下降的抛物线模式。不同处理开始增强的时间先后及保持最高活性的时间长短不同,但10周后3个处理均急剧下降,直到30周;而对照则在20周后才开始下降。
微生物利用碳源的功能多样性指数表现为随时间的延长,微生物丰富度及均匀度均呈下降态势,但直到30周时外加竹叶的3处理明显(P < 0.05)下降。而对照则一直变化不大。说明外加竹叶导致土壤微生物多样性下降,土壤微生物群落趋于简单化。
白清云. 1997. 土壤微生物群落结构的化学估价方法. 农业环境保护, 16(6): 252-256, 265. |
曹群根, 罗佩韬. 1996. 毛竹林凋落叶分解过程中土壤微生物学特性的研究. 竹子研究汇刊, 15(3): 58-65. |
蒋有绪. 1981. 川西亚高山冷杉林枯枝落叶层的群落学作用. 植物生态学与地植物学丛刊, 5(2): 89-98. |
任天志. 2000. 持续农业中的土壤生物指标研究. 中国农业科学, 33(1): 68-75. |
唐启义, 冯明光. 1997. DPS数据处理系统:软件. 北京: 农业出版社, 407.
|
滕应, 黄昌勇, 龙健, 等. 2003. 矿区侵蚀土壤的微生物活性及其群落功能多样性研究. 水土保持学报, 17(1): 115-118. DOI:10.3321/j.issn:1009-2242.2003.01.028 |
滕应, 黄昌勇, 骆永明, 等. 2004. 铅锌银尾矿区土壤微生物活性及其群落功能多样性研究. 土壤学报, 41(1): 113-119. DOI:10.3321/j.issn:0564-3929.2004.01.019 |
赵吉, 邵玉琴, 孔祥辉. 2002. 皇甫川地区枯枝落叶的分解及其对土壤生物环境的影响. 农业环境保护, 21(6): 543-545. |
钟哲科, 高智慧. 2003. 杨树、水杉林带枯落物对土壤微生物C、N的影响. 林业科学, 39(2): 153-157. |
Bragazza L, Siffi C, Iacumin P, et al. 2006. Mass loss and nutrient re lease during litter decay in peatland: the role of microbial adaptability to litter chemistry. Soil Biology and Biochemistry, (1): 257-267. |
Fontaine S, Mariotti A, Abbadie L. 2003. The priming effect of organic matter: a question of microbial competition. Soil Biology and Biochemistry, 35: 837-843. DOI:10.1016/S0038-0717(03)00123-8 |
Garland J L, Mills A L. 1991. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-car bon-source-utilization. Applied Environmental Microbiology, 57: 2351-2359. |
Magurran A E. 1988. Ecological diversity and its measurement. Princeton: Prince ton University Press, 34-59.
|
Paul C S, Stephen C H, Sarah I B. 2005. Red alder (Alnus rubra) alters community-level soil microbial function in conifer forests of the Pacific Northwest, USA. Soil Biol and Biochem, (10): 1860-1868. |
Tracy B G, Zoe G C. 2004. Decomposition dynamics in mixed-species leaf litter. Oikos, (104): 230-246. |
Zak J C. 1994. Functional diversity of microbial communities: a quantitative approach. Soil Biol and Biochem, (26): 1101-1108. |
 2008, Vol. 44
2008, Vol. 44




